Спирты. Химические свойства спиртов
Цели урока:
Дать учащимся первоначальные понятия о кислородсодержащих органических соединениях. Познакомить с составом и строением предельных одноатомных спиртов, дать понятие о функциональной группе атомов и ее влиянии на свойства спиртов. Знать определение спиртов, общую формулу, сущность водородной связи и ее влияние на физические свойства спиртов.
Уметь составлять молекулярные, структурные и электронные формулы спиртов, показывать распределение электронной плотности в молекуле.
Уметь составлять формулы изомеров у спиртов, называть их по систематической номенклатуре. Познакомить учащихся с влиянием спиртов на живой организм.
Оборудование: компьютер, проектор, мультимедийная презентация по теме "Спирты. Химические свойства спиртов".
Ход урока:
Оргмомент, проверка готовности учащихся к уроку, организация внимания учащихся.
Целеполагание и мотивация
Вещества мы не простые
И известны с древних пор.
В медицине применимы:
Дать инфекции отпор.
По свойствам мы не так просты,
А называемся … (спирты)
Итак, тема нашего урока сегодня – “Спирты. Химические свойства спиртов”
Мы познакомимся с составом, строением, изомерией и номенклатурой этих соединений. А также узнаем, какие бывают спирты и какие опасности могут быть скрыты в физических свойствах спиртов.
Изучение нового материала с опорой на презентацию по теме
" Спирты. Химические свойства спиртов": (презентация)
Определение спиртов, краткая характеристика (рассказ учителя, демонстрация презентации)
Общая формула всех одноатомных спиртов СпН2п+1ОН или ROH. Рассмотрим строение молекулы спирта на примере С2Н5ОН – этилового спирта.
Один из атомов водорода отличается от других атомов (Вопрос учащимся – Почему?) Он соединен с атомом углерода через кислород. Следовательно, можно предположить, что он будет вести себя по-другому. На чем основано это предположение?
На этот вопрос вы ответите сами, так как знаете, что кислород обладает более высокой электроотрицательностью. Он будет оттягивать на себя электроны атома водорода. Связь О-Н получается полярной. Это обозначается направленной стрелочкой: О ¬ Н. Именно эта группа -ОН в спиртах и будет определять их химические свойства, т.е. их химическую функцию. Такие группы называются функциональными.
Функциональной называется группа атомов, определяющая химические свойства вещества.
То, что остается в молекуле спирта после мысленного удаления функциональной группы, называют углеводородным радикалом.
Спиртами называются органические вещества, молекулы которых содержат одну или несколько функциональных гидроксильных групп, соединенных с углеводородным радикалом.
Спирты – это производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на функциональные (гидроксильные) группы.
Спирты – это органические соединения, в молекулах которых содержатся одна или несколько гидроксильных групп, соединенных с углеводородным радикалом.
Классификация спиртов (рассказ учителя, демонстрация презентации)
В зависимости от валентности спиртовой группировки спирты бывают: первичные – содержат одновалентную спиртовую группировку –СН2ОН (например, СН3-СН2ОН этанол); вторичные – содержат двухвалентную спиртовую группировку =СНОН (например, СН3-СНОН-СН3 пропанол-2); третичные – содержат трехвалентную спиртовую группировку =С-ОН (например, 2-метилбутанол:
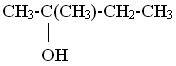
По характеру углеводородного радикала спирты бывают: предельные – углеводородный радикал содержит только одинарные связи (например, СН3ОН метанол, С4Н9ОН бутанол); непредельные – содержат ненасыщенный углеводородный радикал (например, СН2=СН-СН2ОН аллиловый спирт); ароматические – содержат ароматический углеводородный радикал (например, С6Н5-СН2ОН бензиловый спирт).
По количеству гидроксильных групп различают спирты: одноатомные – содержат одну ОН-группу (например, СН3-СН2-ОН этанол); двухатомные – содержат две ОН-группы (например, НО-СН2-СН2-ОН этиленгликоль или этандиол-1,2); трехатомные – содержат три ОН-группы в молекуле (например, НО-СН2-СНОН-СН2-ОН глицерин или пропантриол-1,2,3).
По количеству атомов углерода в молекуле спирта: низшие – содержат от 1 до 10 атомов углерода в молекуле; высшие – содержат более 11 атомов углерода.
Номенклатура спиртов (рассказ учителя, демонстрация презентации)
Тривиальная номенклатура – названия спиртов происходят от названий радикалов:
СН3ОН – метиловый спирт (С2Н5ОН, С3Н7ОН – называют самостоятельно)
Систематическая номенклатура – названия спиртов образуются из названий предельных углеводородов добавлением суффикса –ол:
СН3ОН – метанол.
Основные принципы номенклатуры спиртов:
Выбирают самую длинную углеродную цепь и нумеруют с того конца цепи, к которому ближе находится гидроксо-группа.
Называют заместители в основной углеродной цепи и цифрами указывают их положения.
Называют основную цепь как алкан и добавляют суффикс –ол.
Цифрой указывают положение ОН-группы.
(Учащиеся выполняют задание по номенклатуре спиртов, записанное на доске)
Задание на доске: Назовите по систематической номенклатуре спирты:
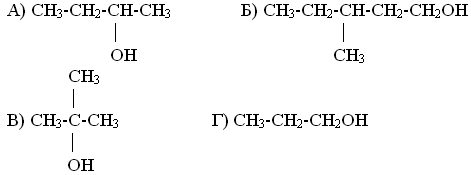
Изомерия предельных одноатомных спиртов (демонстрация моделей)
Для спиртов характерны следующие виды изомерии:
Изомерия углеродного скелета
| СН3-СН2-СН2-СН2-ОН | СН3-СН(СН3)-СН2ОН |
| Бутанол-1 | 2-метилпропанол-1 |
Изомерия положения функциональной группы
| СН3-СН2-СН2ОН | СН3-СН(ОН)-СН3 |
| Пропанол-1 | пропанол-2 |
Межклассовая изомерия: спирты изомерны простым эфирам.
| СН3-СН2ОН | СН3-О-СН3 |
| Этанол | диметиловый эфир |
Физические свойства спиртов (рассказ учителя, демонстрация презентации)
Если рассмотреть гомологический ряд спиртов, то можно увидеть нечто общее для них – то, что среди них нет газов (в отличие от углеводородов). Все спирты жидкости. А так как молекула спирта полярна из-за наличия ОН-группы, то атом кислорода обладает частично отрицательным зарядом, атом водорода – частично положительным. Атом кислорода одной молекулы спирта может взаимодействовать с атомом водорода другой молекулы, имеющим положительный заряд. Образуется водородная связь
Водородные связи менее прочные, чем ковалентные, примерно в 10 раз. Но их много, поэтому молекулы спирта оказываются как бы “прилипшими” между собой, т.е. ассоциированными. Вот почему все спирты имеют жидкую консистенцию.
Однако растворимость спиртов в воде разная. Чем это можно объяснить? (ответы учащихся)
Тем, что в состав разных спиртов входят разные углеводородные радикалы. Чем больше радикал, тем растворимость будет ниже, т.к. радикал отталкивается от воды. Гидроксильной группе такой большой молекулы трудно за счет образования водородных связей удержать ее в водной среде. Таким образом, спирты с большой молекулярной массой в воде будут растворяться хуже.
Этанол С2Н5ОН – бесцветная жидкость со своеобразным запахом, легче воды (р=0,8 г/мл), кипит при 78,3оС, хорошо растворяется в воде и является сам растворителем многих неорганических и органических веществ.
Метанол СН3ОН – похож по свойствам на этанол, но это яд.
Химические свойства спиртов (рассказ учителя, демонстрация презентации, запись в тетрадях учащихся)
IV. Домашнее задание: §21-23, задание в тетради







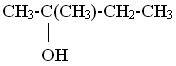








![Щелочной гидролиз галогеналканов. С 2 Н 5 С I + NaOH C 2 H 5 OH + NaCI Гидратация алкенов. СН 2 =СН 2 + Н 2 О С 2 Н 5 ОН Гидрирование альдегидов и кетонов. СН 3 -СОН + Н 2 С 2 Н 5 ОН Окисление алкенов . СН 2 =СН 2 + [ О ] + Н 2 О НО-СН 2 -СН 2 -ОН Специфические способы получения спиртов.](https://fhd.multiurok.ru/3/a/3/3a39761cba1847df6251b38ed3f1cb6743d80323/img_phpFgF2aJ_Spirty_0_8.jpg)











