
Строение атома углерода Автор: Салиева К.Э

Самая большая формула:
C 5750 H 7227 О 4131 N 2215 S 690
(19913 атомов!)
В составе ДНК бактериофагов

Строение атома углерода. Валентные состояния атома углерода.
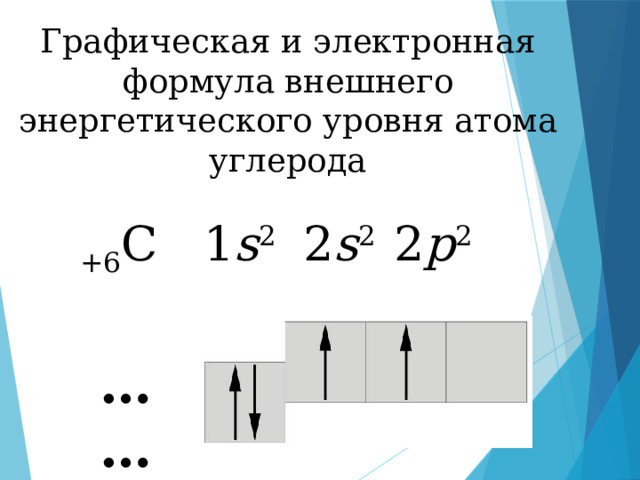
Графическая и электронная формула внешнего энергетического уровня атома углерода
+6 С 1 s 2 2 s 2 2 p 2
……
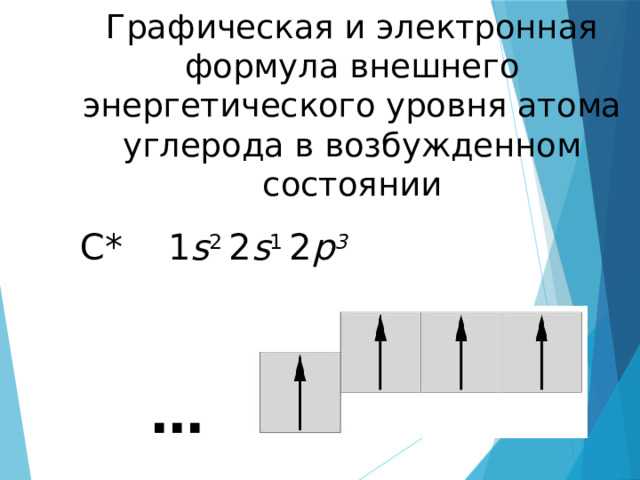
Графическая и электронная формула внешнего энергетического уровня атома углерода в возбужденном состоянии
С* 1 s 2 2 s 1 2 p 3
1 s -электрон и 3 p -электрона внешнего энергетического уровня атома углерода, то, следовательно, химические связи должны быть неравноценными по прочности и длине.
……

- Гибридизация – взаимное выравнивание электронных облаков в атоме углерода по форме и энергии (Л.Полинг, 20-е годы XX века )

Типы гибридизации:
sp 3 -гибридизация
sp 2 -гибридизация
sp -гибридизация
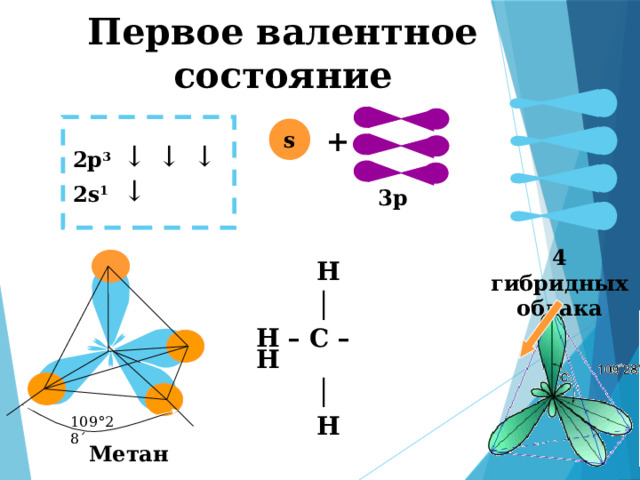
Первое валентное состояние
+
s
↓
↓
↓
2p 3
↓
2s 1
3p
4 гибридных облака
Н
│
Н – С – Н
│
Н
109°28´
Метан
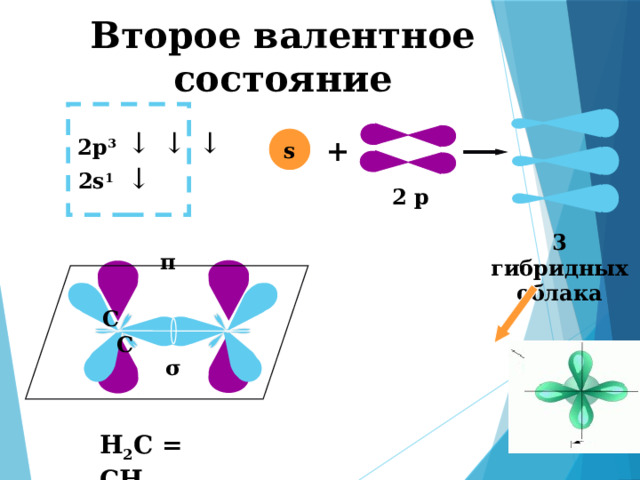
Второе валентное состояние
↓
↓
↓
+
s
2p 3
↓
2s 1
2 p
3 гибридных облака
π
C C
σ
Н 2 С = СН 2
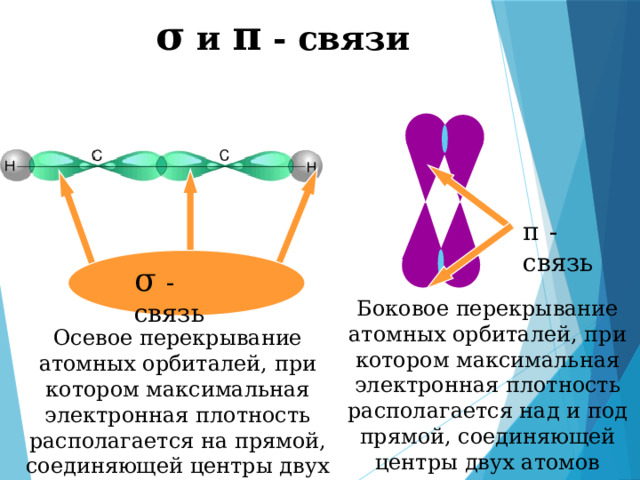
σ и π - связи
π - связь
σ - связь
Боковое перекрывание атомных орбиталей, при котором максимальная электронная плотность располагается над и под прямой, соединяющей центры двух атомов
Осевое перекрывание атомных орбиталей, при котором максимальная электронная плотность располагается на прямой, соединяющей центры двух атомов
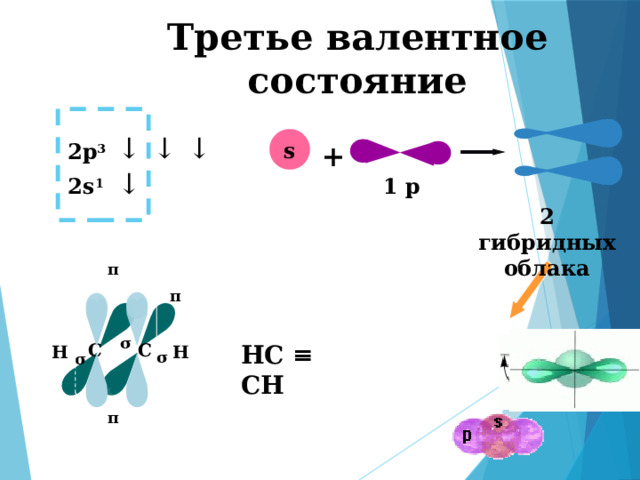
Третье валентное состояние
↓
↓
↓
s
+
2p 3
↓
2s 1
1 p
2 гибридных облака
π
π
σ
С
С
НС ≡ СН
Н
Н
σ
σ
π
π

Изомерия

Перед вами два вещества. Сравните их.Что общего в их строении и составе и что отличает их друг от друга? Сделайте вывод: одно и тоже это вещество или эти вещества разные.
СН3 – СН2 – СН2 – СН2 – О – Н
Бутиловый спирт
СН3 – СН2 – О – СН2 – СН3
Диэтиловый эфир
С 4 Н 10 О

Способность атомов углерода соединяться в различном порядке друг с другом и с атомами других элементов обуславливает явление изомерии
ИЗОМЕРИЯ
греч. isos – одинаковый, meros – часть
одно из важнейших понятий в органической химии

Вещества, имеющие одинаковый количественный и качественный состав молекул, но отличающиеся по своей структуре и свойствам, называются изомерами

Изомерия была впервые обнаружена Ю.Либихом в 1823, который установил, что серебряные соли гремучей и изоциановой кислот: Ag-О-N=C и Ag-N=C=O имеют одинаковый состав, но разные свойства.
Термин «Изомерия» в 1830 ввел И. Берцелиус, предположивший, что различия в свойствах соединений одинакового состава возникают из-за того, что атомы в молекуле расположены в неодинаковом порядке.

Представления об изомерии окончательно сформировались после создания А.М.Бутлеровым теории химического строения (1860-е).
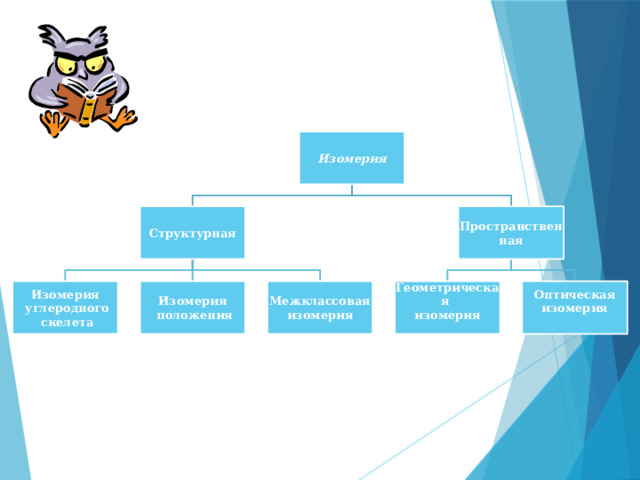
Изомерия
Пространственная
Структурная
Изомерия
Межклассовая
Геометрическая
Оптическая
Изомерия
углеродного
положения
изомерия
изомерия
изомерия
скелета

Изомерия углеродного скелета
СТРУКТУРНАЯ ИЗОМЕРИЯ ИЛИ ИЗОМЕРИЯ ЦЕПИ
Изомерия углеродного скелета обусловлена различным порядком связи между атомами углерода, образующими скелет молекулы.
А
В
Б

Правила построения структурных изомеров
С 6 Н 14 гексан
1.Запишите линейную цепь состоящую из 6-ти атомов углерода
2. Укоротите цепь на один атом углерода и мысленно делите полученную цепь пополам.
3. Проставьте атом углерода к любому атому в цепи кроме крайнего, не заходя за пунктирную линию.
4. Еще раз укоротите цепь, разделите ее пунктирной линией и проставьте атомы углерода к любому из атом углерода в цепи кроме крайних не заходя за пунктирную линию.
5. Просмотрите как еще можно расставить атомы углерода в цепи и расставьте их с учетом пунктирной линии.
6. Осталось расставить атомы водорода с учетом валентности атома углерода.
С – С – С – С – С – С
С – С – С – С – С
С
С – С – С – С – С
С
С – С – С – С
С С
С
С – С – С – С
С

С увеличением числа атомов углерода в молекуле число изомеров быстро растёт .
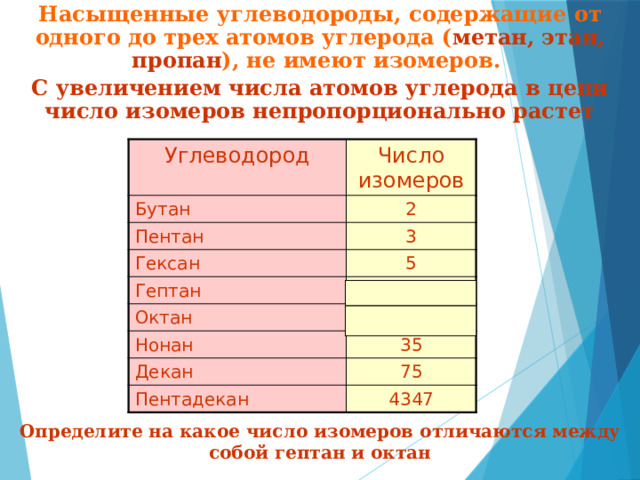
Насыщенные углеводороды, содержащие от одного до трех атомов углерода ( метан, этан, пропан ), не имеют изомеров.
С увеличением числа атомов углерода в цепи число изомеров непропорционально растет
Углеводород
Число изомеров
Бутан
2
Пентан
3
Гексан
5
Гептан
9
Октан
18
Нонан
Декан
35
75
Пентадекан
4347
Определите на какое число изомеров отличаются между собой гептан и октан
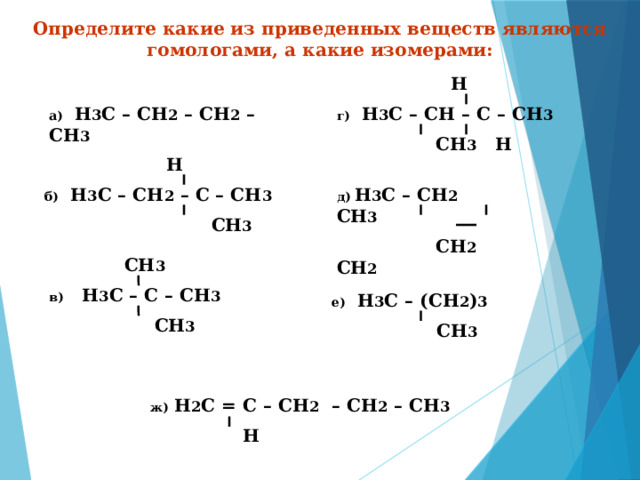
Определите какие из приведенных веществ являются гомологами, а какие изомерами:
Н
г) Н 3 С – СН – С – СН 3
СН 3 Н
а) Н 3 С – СН 2 – СН 2 – СН 3
Н
б) Н 3 С – СН 2 – С – СН 3
СН 3
д) Н 3 С – СН 2 СН 3
СН 2 СН 2
СН 3
в) Н 3 С – С – СН 3
СН 3
е) Н 3 С – (СН 2 ) 3
СН 3
ж) Н 2 С = С – СН 2 – СН 2 – СН 3
Н

Изомерия положения
Изомерия положения возникает в тех случаях, когда функциональные группы, отдельные гетероатомы или кратные связи расположены в различных местах углеводородного скелета.
Н 2 С = СН – СН 2 – СН 2 – СН 3
Н 3 С – СН 2 – СН 2 – СН 2 – СН 2 – СН 2
ОН
Пентен - 1
Гексанол - 1
Н 3 С – СН 2 – СН 2 – СН 2 – СН – СН 3
ОН
Н 3 С – СН = СН – СН 2 – СН 3
Гексанол - 2
Пентен - 2
Н 3 С – СН 2 – СН 2 – СН – СН 2 – СН 3
ОН
Гексанол - 3
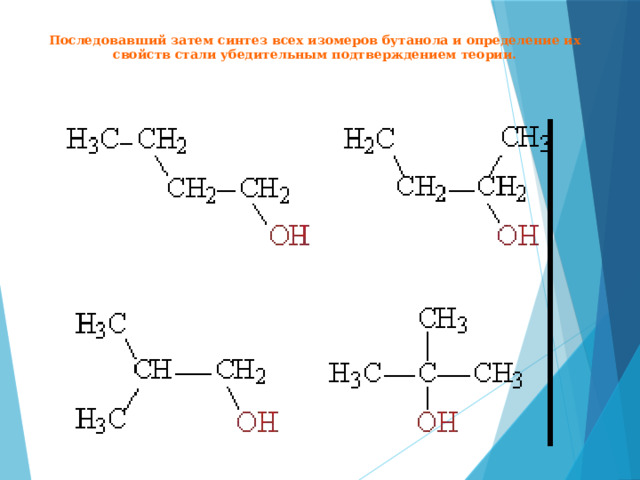
Последовавший затем синтез всех изомеров бутанола и определение их свойств стали убедительным подтверждением теории.
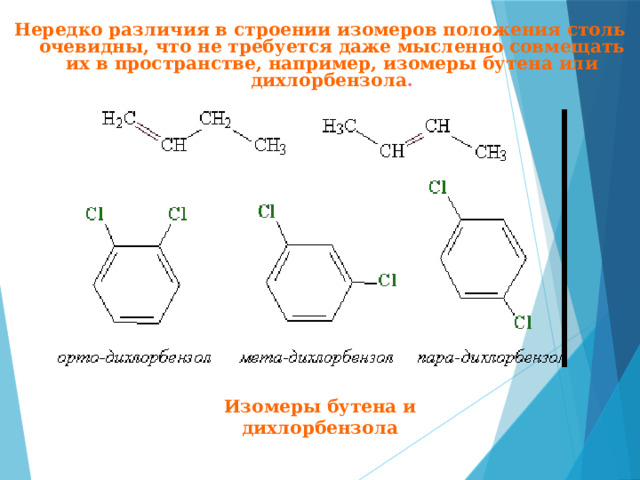
Нередко различия в строении изомеров положения столь очевидны, что не требуется даже мысленно совмещать их в пространстве, например, изомеры бутена или дихлорбензола .
Изомеры бутена и дихлорбензола

Структурные изомеры могут принадлежать к разным классам органических соединений, поэтому они могут различаться не только физическими, но и химическими свойствами .
Примером служат три изомера для соединения С3Н8О, два из них – спирты, а третье – простой эфир
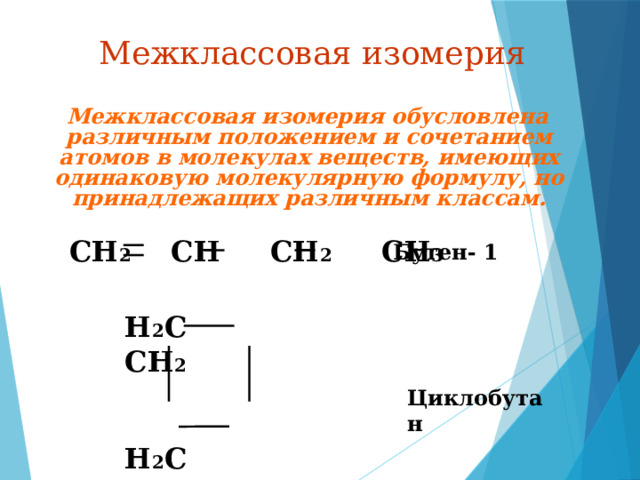
Межклассовая изомерия
Межклассовая изомерия обусловлена различным положением и сочетанием атомов в молекулах веществ, имеющих одинаковую молекулярную формулу, но принадлежащих различным классам.
CH 2 СН CH 2 CH 3
Бутен- 1
H 2 C CH 2
H 2 C CH 2
Циклобутан

Геометрическая изомерия
(цис-транс-изомерия)
Цис-транс-изомерия наблюдается в соединениях, содержащих кратные связи или плоские циклы. В отличие от простой связи, кратная связь не позволяет вращать вокруг нее отдельные фрагменты молекулы.
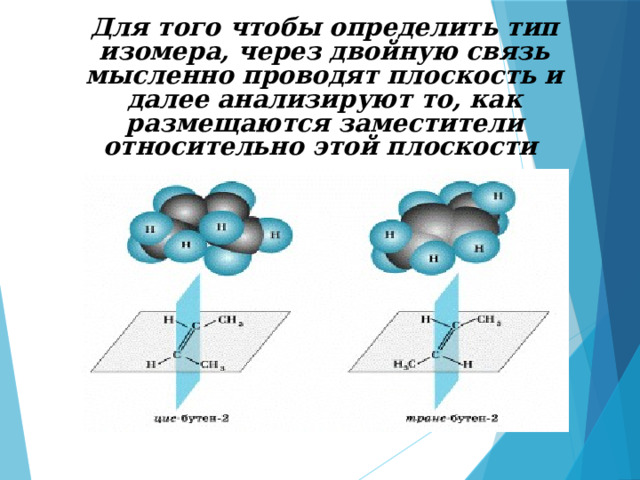
Для того чтобы определить тип изомера, через двойную связь мысленно проводят плоскость и далее анализируют то, как размещаются заместители относительно этой плоскости

Составьте цис – и транс – изомеры для следующих веществ :
1) Н3С – СН = СН – СН2 – СН3
2) Н3С – СН2 – СН = СН – СН – СН3
СН3
3) Н2С = СН –СН2 –СН = СН –СН –СН3
СН3
4)СН3 – СН = СН – С = СН – СН 2 – СН – СН3
СН3 СН3

Оптическая изомерия
Оптическая изомерия возникает в тех случаях, когда два изомера, представляют собой зеркальное отражение друг друга. Таким свойством обладают молекулы, которые могут быть представлены в виде одиночного атома углерода, имеющего четыре различных заместителя
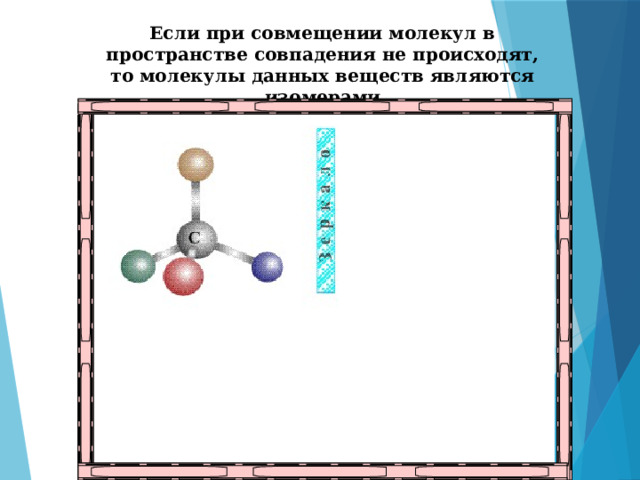
Если при совмещении молекул в пространстве совпадения не происходят, то молекулы данных веществ являются изомерами


давайте обобщим
1. Какие виды изомерии вы знаете?
2. Чем отличается пространственная изомерия от структурной?
3. Какие виды изомерии возможны для соединений, имеющих следующие формулы:
а) C 6 H 14 в)C 4 H 10 O д)C 4 H 9 Cl
б) C 3 H 8 O г)C 4 H 8

СПАСИБО
ЗА ВНИМАНИЕ




















































