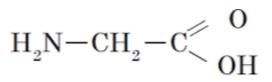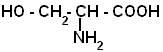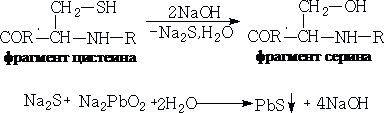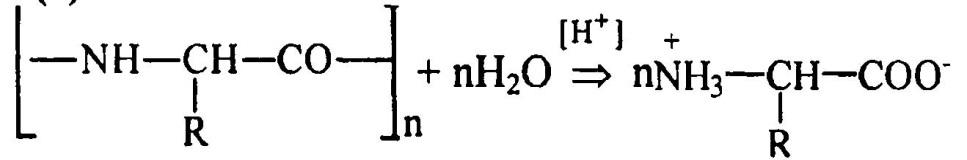| 
| Система менеджмента качества Методическая разработка открытого урока по дисциплине «Химия» |

Министерство здравоохранения Республики Казахстан
ТОО "Республиканский высший медицинский колледж"
«УТВЕРЖДАЮ»
Заместитель директора
по учебно-методической работе
_______________Кожанова Р.Т.
« ______ » ______________ 2017 г.
Методическая разработка открытого урока
по дисциплине «Химия»
Специальность: 0302000«Сестринское дело»
Квалификация: 0302013 «Медицинская сестра»
Семестр II
Курс 1 СД 02-17
Алматы 2018г.
Разработана преподавателем:
_________ Омаровой М.М..
Рассмотрена на заседании ЦМК "Специальные дисциплины №4"
протокол №_____ от "_____" __________ 2018 г.
Председатель ЦМК ____________ Омарова М.М.
Одобрен руководителем НМЦ _____________ Абжановой Ж.С
Выписка из рабочей программы
Тематический план
| № | Наименование разделов и тем | Теоретические занятия |
| 8 | Модуль И 2. Свойства белков
| 2 |
Хронокарта теоретического занятия
|
| Название раздела урока | Теоретическое занятие, 2-часовое-90мин. |
| 1 | Организационный момент | 5 минут |
| 2 | Актуализация опорных знаний | 25 минут по предыдущей теме |
| 3 | Изложение нового материала | 40 минут |
| 4 | Закрепление нового материала | 10 минут |
| 5 | Подведение итогов занятия | 5 минут |
| 6 | Задание на дом | 5 минут |
| 7 | Итого: | 90 минут |
„Повсюду, где мы встречаем жизнь, мы находим,
что она связана с каким-либо белковым телом и повсюду,
где мы встречаем какое-либо белковое тело, которое
не находится в процессе разложения, мы без исключения
встречаем и явления жизни“.
Ф. Энгельс
Тема: «Свойства белков».
Тип занятия: Теоретическое
Метод проведения
по характеру познавательной деятельности: объяснительно - иллюстративный, проблемно - поисковые.
по виду источника знаний: словесно - наглядные
по форме совместной деятельности преподавателя и обучающихся: рассказ, беседа.
Межпредметные связи: «Биохимия», «Органическая химия», «Биология», «Фармацевтическая химия».
Внутрипредметная связь: «Строение и свойства белков», «Аминокислоты», «Нуклеиновые кислоты», «Понятие о ВМС», «Гетероциклические соединения».
Цели занятия
Образовательная:
Создать условия для самостоятельного добывания знаний по теме "Белки, их строение, свойства. Биологические функции белков"; для формирования понятий о их строении и функциях, о значении белков для животных и человека; создать условия для совершенствования умений находить и формулировать правильный ответ на поставленный вопрос, на основе полученных ранее знаний, для изучения химических свойств белков.
Развивающая:
Создать условия для развития: умений выделять главное; устанавливать причинно-следственные связи между составом, строением, свойствами и применением веществ; эрудиции, логического и ассоциативного мышления, критического мышления, способности к рефлексии, коммуникативных навыков, навыков самостоятельного химического эксперимента с соблюдением правил по ТБ; обеспечение системности учения; умения анализировать; способности выражать свои мысли четко и кратко. Создать условия для расширения кругозора и развития интереса к предмету через информационно - коммуникативные и исследовательские технологии.
Воспитательная:
Продолжить: формирование научного мировоззрения; воспитание положительной мотивации учения, уверенности в своих силах; воспитание правильной самооценки и чувства ответственности; воспитание творческой личности, умеющей работать в мини-группе; воспитание культуры поведения, общения и культуры умственного труда.
Время занятия-90 минут.
Оснащение занятия:
Периодическая система Д.И.Менделеева, тестовые задания, мультимедийная технология, видеофильм по теме: «Свойства белков» таблицы, раздаточные карточки.
Организационный момент-5 минут.
Преподаватель проверяет готовность аудитории, кабинет и группы к занятию, отмечает отсутствующих, знакомит с целью занятия.
Актуализация опорных знаний-25 минут
1.Тестовые задания
I Вариант
1. В каком ответе все названные химические соединения относятся к
аминокислотам?
1) тубулин, коллаген, лизоцим
2) лизин, триптофан, аланин
3) валин, мальтаза, кератин
4) сахароза, лактоза, глицин
5) аденин, тимин, гуанин
2.Вторичная структура белка поддерживается
1) Пептидными связями
2) Водородными связями
3) Дисульфидными ковалентными связями
4) кислородными
5) связей не существует
3. Наиболее энергоемкими являются:
1) Жиры
2) Нуклеиновые кислоты
3) Белки
4)углеводы
5) альдегиды и кетоны
4. Первичная структура белка зависит от:
1 ) Количества аминокислотных остатков
2 )Последовательности аминокислотных остатков и их количества
3 )От видов аминокислот и их количества
4) е зависит от ничего
5)зависит от любых выше перечисленных
5. При выработке иммунитета в крови образуются:
1) антитела
2) антигены
3) гемоглобин
4) инсулин
5) сахароза
6. Мономеры белков – это:
1) аминокислоты
2) моносахариды
3) нуклеотиды
4)глицерин и жирные кислоты
5)углерод
7. Какое из соединений построено из аминокислот?
1) целлюлоза
2)гликоген
3) инсулин
4) хитин
5)глюкоза
8. Укажите элементарный состав белков:
1)С, Н;
2)С, Н, О, N, S, P;
3)C, H, N, O;
4)С,О,Н,К
5) вся таблица Менделеева.
2 Вариант
Выбери один ответ:
1. Какие связи стабилизируют первичную структуру?
1) пептидные
2)гидрофобные
3) водородные
4-)дисульфидные
2. При выработке иммунитета в крови образуются:
1) антитела
2) антигены
3) гемоглобин
4) инсулин
5) сахароза
3. Молекулы белков отличаются друг от друга:
1) последовательностью чередования аминокислот
2)количеством аминокислот
3)структурой
4) СООН группами
5)все ответы верны
4. Какое из соединений построено из аминокислот?
1) целлюлоза
2)гликоген
3)инсулин
4)хитин
5) сахароза
5. Изменяемыми частями аминокислот являются:
1)аминогруппа и карбоксильная группа
2) радикал
3)карбоксильная группа
4)радикал и карбоксильная группа.
5)аминогруппа
6.Вторичная структура белка поддерживается
1) Пептидными связями
2) Водородными связями
3) Дисульфидными ковалентными связями
4) кислородными
5) связей не существует
7. Для лечения тяжелых форм сахарного диабета больным необходимо вводить:
1)гемоглобин
2)нсулин
3) антитела
4) гликоген
8. Какая структура белковой молекулы определяет специфическую биологическую активность белка?
1) Четвертичная;
2) третичная;
3) вторичная;
4)первичная.
5) ни какая
Устный опрос
1.Определите структуры белковой молекулы:
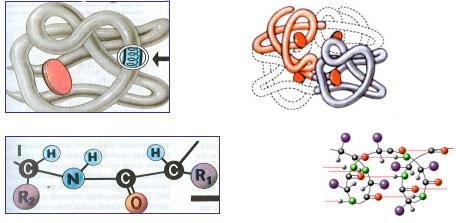
2. Дайте определение первичной структуре белка?
(Ответ: ПЕРВИЧНАЯ структура белка (линейная) - прямая цепочка из аминокислот, между которыми возникают пептидные связи (-CO-NH-). Пример: фиброин шелка)
3.Дайте определение вторичной структуре белка?
( Ответ:ВТОРИЧНАЯ структура белка представлена полностью или частично закрученной в спираль полипептидной цепочкой. Между карбоксильной группой и аминогруппой (- NH2) соседних витков спирали возникают водородные связи. Хотя водородная связь малопрочная, но благодаря значительному количеству в комплексе обеспечивает прочную связь. Такую структуру имеют фибриллярные белки (коллаген, белок кожи; фибриноген, белок крови; миозин, белок мышц).
4. Дайте определение третичной структуре белка?
(Ответ: ТРЕТИЧНАЯ структура белка возникает при плотном укладывании спирали в клубок (глобулу) или фибриллу. Третичная структура поддерживается слабыми дисульфидными связями и ионными. Такую структуру имеют глобулярные белки (альбумины, глобулины).
5.Дайте определение четвертичной структуре белка?
(Ответ: ЧЕТВЕРТИЧНАЯ структура белка характерна для белков имеющих несколько полипептидных цепочек, связанных между собой в единый агрегат, объединение нескольких глобул. Четыре глобулы, связанные атомом железа имеет белок гемоглобин.)
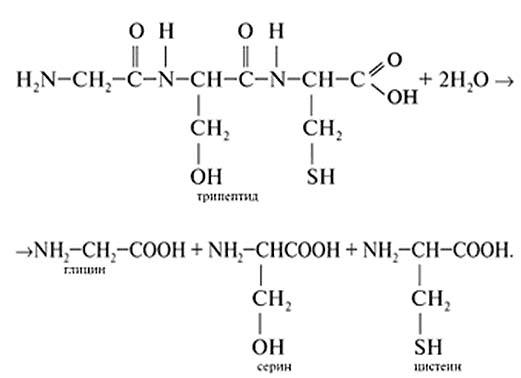
6. Напишите образование дипептида из глицина и серина
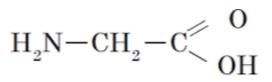
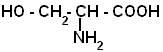
7. Напишите уравнение реакции образования трипептидаиз
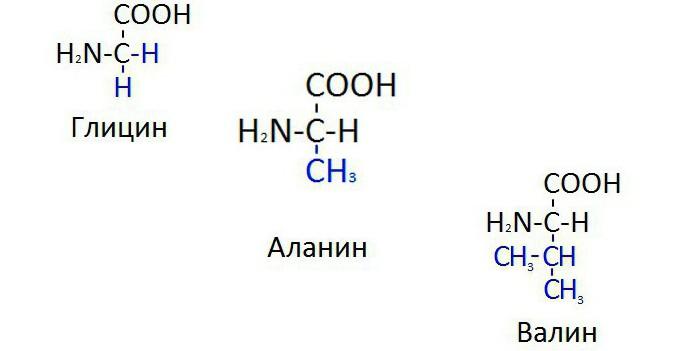
8. Какие вещества входят в состав белков?( аминокислоты)
9.Сколько аминокислот участвуют в образовании белков?( 20)
10. Что такое белки?
Изложение нового материала-40минут.
Физико-химические свойства
Классификация белков
В основу классификации белков положены их физико-химические и химические особенности. Белки делят на простые (протеины) исложные (протеиды). К простым относят белки, которые при гидролизе дают только аминокислоты и аммиак, к сложным – белки, состоящие из простых белков и соединений небелковой группы, называемой простетической.
Простые белки (протеины)
По ряду характерных свойств протеины разделяют на несколько групп.
Альбумины . Они растворимы в воде, свёртываются при нагревании, нейтральны, сравнительно трудно осаждаются растворами солей. Примерами их могут служить: альбумин белка куриного яйца, альбумин кровяной сыворотки, альбумин мускульной ткани, молочный альбумин.
Глобулины. Они нерастворимы в воде, но растворяются в очень слабых растворах солей. Примерами глобулинов могут служить: фибриноген, глобулин кровяной сыворотки, глобулин мускульной ткани, глобулин белка куриного яйца.
Гистоны. Белки основного характера. Находятся в виде нуклеопротеидов в лейкоцитах и красных кровяных шариках.
Протамины. Не содержат серы, обладают сравнительно сильными основными свойствами, дают кристаллические соли; содержатся (в виде нуклеопротеинов) в сперматозоидах рыб.
Проламины. Находятся в зернах различных хлебных злаков. Замечательной их особенностью является растворимость в 80% -ном спирте. Представителем этих бел-ов может служить глиадин, составляющий главную часть клейковины.
Склеропротеины. Нерастворимые белки, которые составляют наружный покров тела животного и находятся в скелете и в соединительной ткани. К ним относятся кератин, коллагены, эластин, фиброин.
Кератин является главной составной частью волос, рогов, копыт, ногтей, перьев и верхнего слоя кожи. По химическому составу кератин богат серой
Коллагены. Чрезвычайно распространены в живых организмах. Из коллагенов состоит соединительная ткань; они находятся в хрящах. Кости позвоночных животных состоят из неорганических веществ (фосфорнокислого и углекислого кальция), жира и коллагенов.
Эластин входит в состав жил и других эластичных веществ соединительной ткани.
Сложные белки (протеиды)
Протеиды являются сложными белками, состоящими из белковой и небелковой частей.Название протеида определяется названием его простетической группы). Так, нуклеиновые кислоты являются небелковой частью нуклеопротеидов, фосфорная к-та входит в состав фосфопротеидов, углеводы – гликопротеидов, а липиды – липопротеидов. Протеиды также можно подразделить на несколько групп.
Нуклеопротеиды. Имеют важное значение, т.к. их небелковая часть представлена ДНК и РНК. Простетическая группа представлена в основном гистонами и протаминами. Такие комплексы ДНК с гистонами обнаружены в сперматозоидах, а с гистонами – в соматических клетках, где молекула ДНК “намотана” вокруг молекул гистонов. Нуклепротеидами по своей природе являются вне клетки вирусы – это комплексы вирусной нуклеиновой к-ты и белковой оболочки – капсида.
Хромопротеиды. Являются сложными белками, простетическая группа которых представлена окрашенными соединениями. К хромопротеидам относятся гемоглобин, миоглобин (бело мышц), ряд ферментов (каталаза, пероксидаза, цитохромы), а также хлорофилл.
Гемоглобин (Hb) состоит из белка глобина и небелковой части гема, включающего атом Fe(II), соединенный с протопорфирином. Молекула гемоглобина состоит из 4-х субъединиц: двух a и двух b и соответственно содержит четыре полипептидные цепочки двух сортов. Каждая a-цепочка содержит 141, а b-цепочка – 146 аминокислотных остатков.
Атом железа может образовать шесть координационных связей. Четыре связи направлены к атомам азота пиррольных колец, оставшееся две связи – перпендикулярно к плоскости порфиринового кольца по обе его стороны. Гемы расположены вблизи поверхности белковой глобулы в специальных карманах, образованных складками полипептидных цепочек глобина. Гемоглобин при нормальном функционировании может находиться в одной из трех форм: феррогемоглобин (обычно называемый дезоксигемоглобином или просто гемоглобином), оксигемоглобин и ферригемоглобин (метгемоглобин). В ферригемоглобине железо находится в закисной форме Fe(II), одна из двух связей, перпендикулярных к плоскости порфиринового кольца, направлена к атому азота гистидинового остатка, называемого проксимальным (соседним), по другую сторону порфиринового кольца и на большем расстоянии от него находится другой гистидиновый остаток – дистальный гистидин, не связанный непосредственно с атомом железа. Взаимодействие молекулярного кислорода сосвободнымгемом приводит к необратимому окислению атома железа гема [Fe(II) Þ Fe(III); гем Þ гемин]. Поэтому в дезоксигемоглобине глобин предохраняет железо от окисления.
Биосинтез белков
Еще раз напомним, что в состав полипептидов живых организмов входит 20 аминокислот, среди которых есть незаменимые. Это лизин, метионин, фенилаланин и т. д. Они поступают в кровь из отделов тонкой кишки после расщепления в ней белковых продуктов. Чтобы синтезировать заменимые аминокислоты (аланин, пролин, серин), грибы и животные используют азотсодержащие соединения. Растения, являясь автотрофами, самостоятельно образуют все необходимые составные мономеры, представляющие сложные белки. Для этого в реакциях ассимиляции у них используются нитраты, аммиак или свободный азот. У микроорганизмов некоторые виды обеспечивают себя полным аминокислотным набором, а у других синтезируются только некоторые мономеры. Этапы биосинтеза белков протекают в клетках всех живых организмов. В ядре происходит транскрипция, а в цитоплазме клетки - трансляция.
Первый этап – синтез предшественника иРНК происходит при участии фермента РНК-полимеразы. Он разрывает водородные связи между цепями ДНК, и на одной из них по принципу комплиментарности собирает молекулу пре-иРНК. Она подвергается слайсингу, то есть созревает, и далее выходит из ядра в цитоплазму, образуя матричную рибонуклеиновую кислоту.
Для осуществления второго этапа необходимо наличие специальных органелл – рибосом, а также молекул информационных и транспортных рибонуклеиновых кислот. Еще одним важным условием является наличие молекул АТФ, так как реакции пластического обмена, к которым принадлежит биосинтез белков, происходят с поглощением энергии.
Функции белков
Работа и функции белков лежат в основе структуры любого организма и всех протекающих в нем жизненных реакций. Любые нарушения этих белков приводят к изменению самочувствия и нашего здоровья. Необходимость изучения строения, свойств и видов белков кроется в многообразии их функций.
| Функция | Примеры и пояснения |
| Строительная | Белки участвуют в образовании клеточных и внеклеточных структур: входят в состав клеточных мембран (липопротеины, гликопротеины), волос (кератин), сухожилий (коллаген) и т.д. |
| Транспортная | Белок крови гемоглобин присоединяет кислород и транспортирует его от легких ко всем тканям и органам, а от них в легкие переносит углекислый газ; в состав клеточных мембран входят особые белки, которые обеспечивают активный и строго избирательный перенос некоторых веществ и ионов из клетки во внешнюю среду и обратно. |
| Регуляторная | Гормоны белковой природы принимают участие в регуляции процессов обмена веществ. Например, гормон инсулин регулирует уровень глюкозы в крови, способствует синтезу гликогена, увеличивает образование жиров из углеводов. |
| Защитная | В ответ на проникновение в организм чужеродных белков или микроорганизмов (антигенов) образуются особые белки — антитела, способные связывать и обезвреживать их. Фибрин, образующийся из фибриногена, способствует остановке кровотечений. |
| Двигательная | Сократительные белки актин и миозин обеспечивают сокращение мышц у многоклеточных животных. |
| Сигнальная | В поверхностную мембрану клетки встроены молекулы белков, способных изменять свою третичную структуру в ответ на действие факторов внешней среды, таким образом осуществляя прием сигналов из внешней среды и передачу команд в клетку. |
| Запасающая | В организме животных белки, как правило, не запасаются, исключение: альбумин яиц, казеин молока. Но благодаря белкам в организме могут откладываться про запас некоторые вещества, например, при распаде гемоглобина железо не выводится из организма, а сохраняется, образуя комплекс с белком ферритином. |
| Энергетическая | При распаде 1 г белка до конечных продуктов выделяется 17,6 кДж. Сначала белки распадаются до аминокислот, а затем до конечных продуктов — воды, углекислого газа и аммиака. Однако в качестве источника энергии белки используются только тогда, когда другие источники (углеводы и жиры) израсходованы. |
| Каталитическая | Одна из важнейших функций белков. Обеспечивается белками — ферментами, которые ускоряют биохимические реакции, происходящие в клетках. Например, рибулезобифосфаткарбоксилаза катализирует фиксацию СО2 при фотосинтезе. |
Денатурация белков. Деструкция белков.
Важное свойство белков - их способность к денатурации. Этим понятием обозначают явления, связанные с необратимым изменением вторичной, третичной и четвертичной структур белка под воздействием нагревания, кислот, щелочей, УФ-лучей, ионизирующей радиации, ультразвука и др.
Иными словами, денатурация - это необратимое нарушение нативной пространственной конфигурации белковой молекулы, сопровождающееся существенными изменениями биологических и физико-химических свойств белков.
Денатурация

Деструкция белка куриного яйца под воздействием высокой температуры
Денатурацией белка называют любые изменения в его биологической активности и/или физико-химических свойствах, связанные с потерей четвертичной, третичной иливторичной структуры (см. раздел «Структура белка»). Как правило, белки достаточно стабильны в тех условиях (температура, pH и др.), в которых они в норме функционируют в организме. Резкое изменение этих условий приводит к денатурации белка. В зависимости от природы денатурирующего агента выделяют механическую (сильное перемешивание или встряхивание), физическую (нагревание, охлаждение, облучение, обработка ультразвуком) и химическую (кислоты и щёлочи, поверхностно-активные вещества, мочевина) денатурацию.
Денатурация белка может быть полной или частичной, обратимой или необратимой. Самый известный случай необратимой денатурации белка в быту — это приготовление куриного яйца, когда под воздействием высокой температуры растворимый в воде прозрачный белок овальбумин становится плотным, нерастворимым и непрозрачным. Денатурация в некоторых случаях обратима, как в случае осаждения водорастворимых белков с помощью солей аммония, и используется как способ их очистки.
Ренатурация белка
Американским химикам удалось обратить процесс температурной денатурации белка. Сваренное вкрутую куриное яйцо химики из Калифорнийского университета вернули в первоначальное состояние. Белки были расщеплены, яйцу вернули жидкую консистенцию.
При варке происходит внутримолекулярная перегруппировка: частицы белка объединяются в более крупные, а аминокислотная последовательность молекулы при этом остается прежней. В ходе эксперимента яйцо 20 минут варилось при температуре 90 градусов. Затем белок был обработан мочевиной (диамидом угольной кислоты). Белок был разжижен, но процесс ренатурации на этом еще не завершился. Чтобы вернуть фрагментам белков прежнюю структуру, их подвергли воздействию вихревого аппарата.

Такие аппараты используются для химического разделения веществ при помощи центробежной силы. Благодаря вихревой обработке структура белка была восстановлена. Но осталось ли яйцо съедобным, ученые предпочли умолчать. Прикладная ценность курьезного, на первый взгляд, эксперимента велика. Исследование процесса ренатурации позволит значительно удешевить и упростить технологию изготовления ряда противораковых лекарств. Изготовителей сыров также может заинтересовать результат этого исследования.
Гидролиз белков
Белки способны частично гидролизоваться. Если представить, что гидролиз протекает до конца, т.е. полностью, то в качестве продуктов реакции получается смесь аминокислот. Кроме этих веществ в растворе после гидролиза были найдены углеводы, пиримидиновые и пуриновые основания, ортофосфорная кислота. Гидролиз белков протекает при определенных условиях: кипячение в растворе кислоты или щелочи.
Если в составе белков имеются амидные связи за счет наличия аминокислот с разветвленными боковыми радикалами, создающими стерические препятствия, как например в лейцине или валине, то гидролиз невозможен.
Если белок распадается на составляющие в щелочной среде, то гидролиз проводят в кислой и наоборот.
Условно уравнение реакции гидролиза белков можно записать как:
“Цветные реакции белка”.
С помощью “цветных реакций” обнаруживают белок в биологических средах и устанавливают их аминокислотный состав. Различаются два типа цветных реакций:
1) Универсальные – биуретовая (на все белки), нингидриновая (на все природные аминокислоты и белки);
2) Специфические – только на определенные аминокислоты как в молекуле белка, так и в растворах аминокислот.
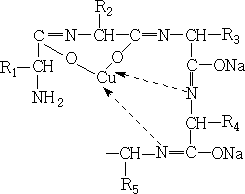
1 Реакция на амидную группировку (биуретовая реакция):
В щелочной среде раствор белка с ионами меди приобретает фиолетовый цвет. Реакция обусловлена образованием биуретового комплекса в результате соединения ионов меди с пептидными группировками белка, переходящими в щелочной среде в енольную форму. Биуретовый медный комплекс можно представить следующим образом:
2 Реакция на аминогруппы аминокислот и белков (нингидриновая реакция):
Эта реакция характерна для аминогрупп, находящихся в 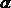 - положении. Аминокислоты, полипептиды и белки при кипячении с водным раствором нингидрина дают синее или сине-фиолетовое окрашивание. Комплекс называется “сине-фиолетовый комплекс Руэмана”, имеет строение:
- положении. Аминокислоты, полипептиды и белки при кипячении с водным раствором нингидрина дают синее или сине-фиолетовое окрашивание. Комплекс называется “сине-фиолетовый комплекс Руэмана”, имеет строение:
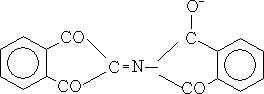
3 Реакция на циклические аминокислоты (ксантопротеиновая реакция):
Реакция открывает наличие в белках циклических аминокислот – триптофана, фенилаланина, тирозина, содержащих в своем составе бензольное кольцо. Цветная реакция обусловлена нитрованием бензольного кольца этих аминокислот с образованием нитросоединения желтого цвета, например:
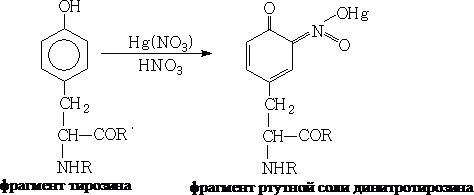
4 Реакция на тирозин (реакция Миллона):
Реакция Миллона открывает в белке тирозин. Аминокислоту тирозин можно рассматривать как производное фенола. Фенолы и их производные образуют ртутные соли красного цвета. Химизм реакции Миллона можно отразить уравнением:
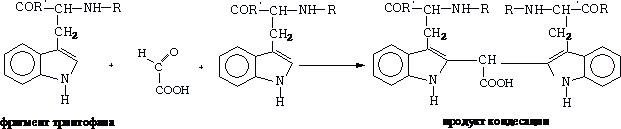
5 Реакция на триптофан (реакция Адамкевича):
Реакция Адамкевича указывает на присутствие в белке аминокислоты триптофана. Реакция заключается в том, что триптофан, реагируя с глиоксилевой кислотой, присутствующей в виде примеси в концентрированной уксусной кислоте, дает окрашенные продукты конденсации.
Концентрированная серная кислота принимает участие в реакции в качестве водоотнимающего средства. Реакция идет по схеме:
6 Реакция на аминокислоты, содержащие слабосвязанную серу (реакция Фоля):
Реакция Фоля указывает на присутствие в белке аминокислот цистеина и цистина, содержащих слабосвязанную серу. Химизм реакции состоит в том, что при кипячении белка со щелочью цистеин и цистин отщепляют серу в виде 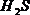 , который с плюмбитом дает черный или бурый осадок сульфида свинца, по схеме:
, который с плюмбитом дает черный или бурый осадок сульфида свинца, по схеме:
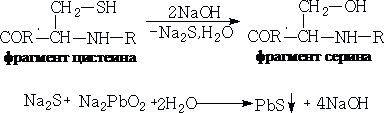
7 Реакция на аргинин:
Аргинин в присутствии 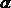 - нафтола окисляется гипобромитом, теряя при этом одну аминогруппу. Окисленный аргинин, соединяясь с
- нафтола окисляется гипобромитом, теряя при этом одну аминогруппу. Окисленный аргинин, соединяясь с
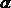 - нафтолом, образует вещество красного цвета, которое предположительно имеет строение:
- нафтолом, образует вещество красного цвета, которое предположительно имеет строение:
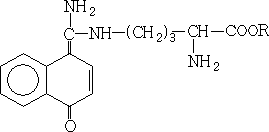
Белки, содержащие в составе аргинин, дают красное окрашивание с гипобромитом или гипохлоридом и 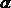 - нафтолом в щелочной среде.
- нафтолом в щелочной среде.
Заключение
Белки по праву можно назвать основой жизни всех организмов. Так как без них нормальное функционирование любого организма невозможно. Все многочисленные функции организма напрямую зависят от них.
Без белков или их составных частей – аминокислот – не может быть обеспечено воспроизводство основных структурных элементов органов и тканей, а также образование ряда важнейших веществ, как, например, ферментов и гормонов.
Белки – основная и необходимая часть всех организмов. Белки осуществляют обмен веществ и энергетические превращения, они неразрывно связаны с активными биологическими функциями. Если исключить из рациона питания белковую пищу, то организм начнет слабеть, и при длительном отсутствии белковой пищи погибнет.
Фридрих Энгельс дал следующее определение жизни : «Жизнь есть способ существования белковых тел, существенным моментом которого является постоянный обмен веществ с окружающей их внешней природой, причем с прекращением этого обмена веществ прекращается и жизнь, что приводит к разложению белка.».
Просмотр видеофильма на тему: «Белки - из чего состоит все живое».
Закрепление нового материала-10 минут
Решение кроссворда на тему: «Белки».
«Проверь себя»
1.Изменение первичной структуры белка
2. Высокомолекулярные соединения.
3.Белки, состоящие только из аминокислот.
4. Соединение, сочетающее в себе признаки кислот и оснований.
5. Пространственная конфигурация представляющая третичную структуру белка.
6. Высокомолекулярные органические непериодические полимеры, состоящие из аминокислот.
7. Химические связи, соединяющие аминокислоты в первичной структуре белка.
8. Форма, образующая вторичную структуру белковой молекулы.
9.Транспортный белок, для которого характерна четвертичная структура.
10.Двигательный белок.
11. Белки, являющиеся биокатализаторами.
12. Белки на поверхности клетки или в растворе, по которым Т-лимфоциты различают свои клетки от чужих.
| 1 |
|
| 4 |
|
|
|
|
|
|
|
|
| |
|
| |
|
|
|
|
|
| 11 |
|
| |
| 3 | |
|
|
|
| 9 |
| |
|
| | 2 | | |
|
| 7 |
| |
| |
|
| | | | |
| 6 | |
|
|
| |
|
| | | | | 5 | | |
| | 10 | |
|
| | | | | | | |
| | | |
|
| А | М | И | Н | О | К | И | 8 С | Л | О | Т | 12 А |
| | | | | | | | | | | | |
| | | | | |
| | | | |
| |
| |
|
|
| |
| | | | |
| |
|
|
|
|
| |
| | | |
|
| |
|
|
|
|
|
|
|
| |
|
|
| |
|
|
|
|
|
|
|
| |
|
|
| |
2. Задание: Напишите уравнение реакции гидролиза белков имеющих общую формулу
(-NH-CH(R)-CO-)n.РешениеУравнение реакции будет выглядеть следующим образом:
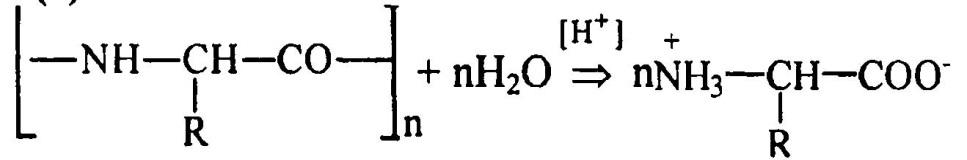
Задачи для логического брифинга :
1. Научное название белков. (протеины)
2. Группы атомов, обслуживающие амфотерные свойства АК. ( амино и карбоксильная группа)
3. Связь, соединяющая аминокислотные остатки и полимерную цепь.(пептидная и амидная связь)
4. Мономеры, составляющие основу первичной структуры белка. (аминокислоты)
5. Структура белка, свёрнутая в спираль. (вторичная)
6. Конфигурация третичной структуры белка. ( глобула, фибрилла)
7. Группа атомов, обусловливающая биологическую активность усложнённых белковых структур. (радикал)
8. Разрушение первичной структуры белка. (гидролиз)
9. Процесс, обратный ренатурации. (денатурация)
10. Реакции, определяющие наличие белка. (биуретовая и ксантопротеиновая)
11. Гормон поджелудочной железы. (инсулин)
12. Пищевые продукты с высоким содержанием белка. (яйца, молоко, рыба, мясо)
(для определения реального уровня полученных знаний проводится тест с самопроверкой)
Подведение итогов- 5 минут.
Домашнее задание: «Свойства белков».
Использованная литература:
Основная:
1. Белки: Справочные материалы. М.: Пищевое производство, 2004.
2. Книга о вкусной и здоровой пище / Под ред. акад. АМН СССР А.А. Поеровского. М.: Агропромиздат, 2015г.
3. Петров А.А., Бальян Х.В., Трощенко А.Т. Органическая химия: Учебник для ВУЗов / Под ред. Петрова А.А. М.: Высшая школа, 2015г.
4. Товароведение / Под ред. И.Ю. Лавровой. М.: Юнити, 2005.
5. Химия: Справочное издание / В. Шретер. М.: Химия, 2014г.
Дополнительная:
1. Петров А.А., Бальян Х.В., Трощенко А.Т. Органическая химия: Учебник для ВУЗов / Под ред. Петрова А.А. М.: Высшая школа, 2012г. С. 495.
2. Химия: Справочное издание / В. Шретер. М.: Химия, 2009г. С. 515.
3. Белки: Справочные материалы. М.: Пищевое производство, 2004. С. 22-29.
4. Книга о вкусной и здоровой пище / Под ред. акад. АМН СССР А,А, Поеровского. М.: Агропромиздат, 2011г. С. 9-12.
5.Белки: Справочные материалы. М.: Пищевое производство, 2004. С. 144.
I Вариант
1. В каком ответе все названные химические соединения относятся к
аминокислотам?
1) тубулин, коллаген, лизоцим
2) лизин, триптофан, аланин
3) валин, мальтаза, кератин
4) сахароза, лактоза, глицин
5) аденин, тимин, гуанин
2.Вторичная структура белка поддерживается
1) Пептидными связями
2) Водородными связями
3) Дисульфидными ковалентными связями
4) кислородными
5) связей не существует
3. Наиболее энергоемкими являются:
1) Жиры
2) Нуклеиновые кислоты
3) Белки
4)углеводы
5) альдегиды и кетоны
4. Первичная структура белка зависит от:
1 ) Количества аминокислотных остатков
2 )Последовательности аминокислотных остатков и их количества
3 )От видов аминокислот и их количества
4) е зависит от ничего
5)зависит от любых выше перечисленных
5. При выработке иммунитета в крови образуются:
1) антитела
2) антигены
3) гемоглобин
4) инсулин
5) сахароза
6. Мономеры белков – это:
1) аминокислоты
2) моносахариды
3) нуклеотиды
4)глицерин и жирные кислоты
5)углерод
7. Какое из соединений построено из аминокислот?
1) целлюлоза
2)гликоген
3) инсулин
4) хитин
5)глюкоза
8. Укажите элементарный состав белков:
1)С, Н;
2)С, Н, О, N, S, P;
3)C, H, N, O;
4)С,О,Н,К
5) вся таблица Менделеева.
2 Вариант
1. Какие связи стабилизируют первичную структуру?
1) пептидные
2)гидрофобные
3) водородные
4-)дисульфидные
2. При выработке иммунитета в крови образуются:
1) антитела
2) антигены
3) гемоглобин
4) инсулин
5) сахароза
3. Молекулы белков отличаются друг от друга:
1) последовательностью чередования аминокислот
2)количеством аминокислот
3)структурой
4) СООН группами
5)все ответы верны
4. Какое из соединений построено из аминокислот?
1) целлюлоза
2)гликоген
3)инсулин
4)хитин
5) сахароза
5. Изменяемыми частями аминокислот являются:
1)аминогруппа и карбоксильная группа
2) радикал
3)карбоксильная группа
4)радикал и карбоксильная группа.
5)аминогруппа
6.Вторичная структура белка поддерживается
1) Пептидными связями
2) Водородными связями
3) Дисульфидными ковалентными связями
4) кислородными
5) связей не существует
7. Для лечения тяжелых форм сахарного диабета больным необходимо вводить:
1)гемоглобин
2)нсулин
3) антитела
4) гликоген
8. Какая структура белковой молекулы определяет специфическую биологическую активность белка?
1) Четвертичная;
2) третичная;
3) вторичная;
4)первичная.
5) ни какая
Карточка № 1
1.Определите структуры белковой молекулы:

Карточка № 2
2. Дайте определение первичной структуре белка?
Карточка № 3
3.Дайте определение вторичной структуре белка?
Карточка № 4
4. Дайте определение третичной структуре белка?
Карточка № 5
5.Дайте определение четвертичной структуре белка?
Карточка № 6
6. Напишите образование дипептида из глицина и серина
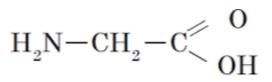
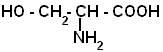
Карточка № 7
7. Напишите уравнение реакции образования трипептидаиз

Карточка № 8
Какие вещества входят в состав белков?( аминокислоты)
Карточка № 9
9.Сколько аминокислот участвуют в образовании белков?( 20)
Карточка № 10
10. Что такое белки?
Эталон ответов по тестовым заданиям
|
| 1вариант | 2 вариант |
-
| 5 | 1 |
-
| 2 | 1 |
-
| 3 | 2 |
-
| 2 | 3 |
-
| 1 | 1 |
-
| 1 | 2 |
-
| 3 | 2 |
-
| 2 | 1 |
Критерий оценивания обучающихся
Тестовые задания:
7-8 правильных ответов- «5»
6 правильных ответов- «4»
5 правильных ответов – «3»
Ниже 4 правильных ответов – «2»
Устный опрос:
Правильный полный ответ-«5»
Правильный, но не полный ответ- «4»
Не полный ответ- «3»
Нет ответа- «2»
Ответы на кроссворд:
| Д |
|
| А |
|
|
|
|
|
|
|
|
| Е |
|
| М |
|
|
|
|
|
| Ф |
|
| Н |
| П | Ф |
|
|
|
| Г |
| Е |
|
| А | П | Р | О |
|
| П |
| Е |
| Р |
|
| Т | О | О | Т |
| Б | Е |
| М |
| М |
|
| У | Л | Т | Е | Г | Е | П |
| О | М | Е |
|
| Р | И | Е | Р | Л | Л | Т |
| Г | И | Н |
|
| А | М | И | Н | О | К | И | С | Л | О | Т | А |
| Ц | Е | Н | О | Б | И | Д | П | О | З | Ы | Н |
| И | Р | Ы | Е | У |
| Н | И | Б | И |
| Т |
| Я |
|
|
| Л |
| Ы | Р | И | Н |
| И |
|
|
|
|
| А |
| Е | А | Н |
|
| Г |
|
|
|
|
|
|
|
| Л |
|
|
| Е |
|
|
|
|
|
|
|
| Ь |
|
|
| Н |