
Относительная плотность паров предельного ____________ по воздуху равна 2. Выведите молекулярную формулу (СnH2nO)__________.


Альдегиды

Альдегиды - органические вещества, молекулы которых содержат карбонильную группу , связанную с атомом водорода и углеводородным радикалом. Общая формула альдегидов или R—CHO. Функциональная группа альдегидов
(—CHO) называется альдегидной группой.
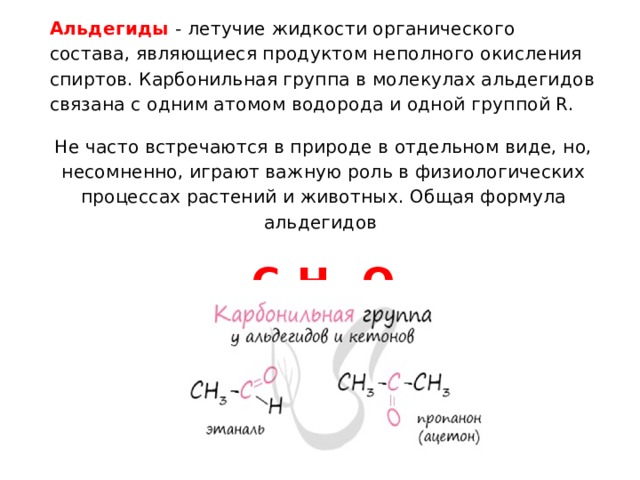
Альдегиды - летучие жидкости органического состава, являющиеся продуктом неполного окисления спиртов. Карбонильная группа в молекулах альдегидов связана с одним атомом водорода и одной группой R.
Не часто встречаются в природе в отдельном виде, но, несомненно, играют важную роль в физиологических процессах растений и животных. Общая формула альдегидов
C n H 2n O
Многие альдегиды имеют специфический запах. Высшие альдегиды, в особенности непредельные, используются в пищевой промышленности и парфюмерии.

Физические свойства
Физическое состояние альдегидов зависит от количества атомов углерода:
формальдегид – газообразное вещество;
альдегиды, содержащие от двух до 12 атомов углерода, – жидкости;
альдегиды с 13 и более атомами углерода – твёрдые вещества.
Температуры кипения альдегидов, имеющих линейное строение, выше, чем у разветвлённых изомеров. Плотность, вязкость, показатель преломления при нормальных условиях увеличиваются с возрастанием молекулярной массы.
Два первых альдегида в гомологическом ряду – формальдегид и этаналь – неограниченно смешиваются с водой. Далее в гомологическом ряду растворимость уменьшается с увеличением углеродного скелета. Альдегиды хорошо растворяются в спиртах, эфирах и других органических растворителях.

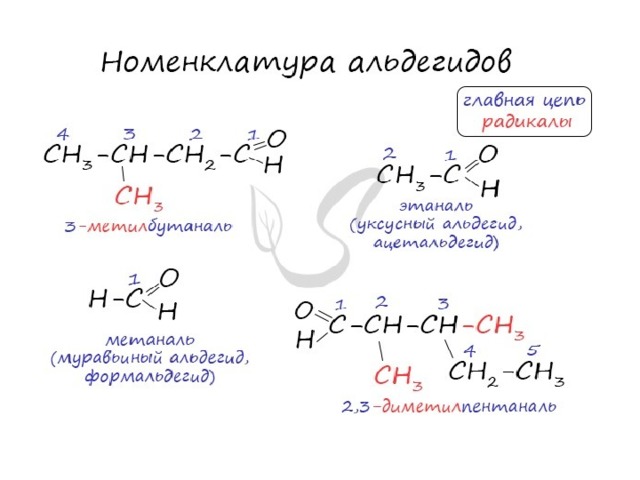
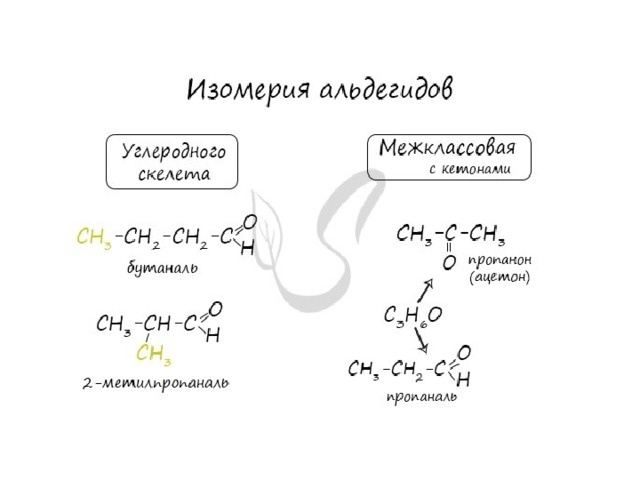
Номенклатура и изомерия альдегидов
- Названия альдегидов формируются путем добавления суффикса "аль" к названию алкана с соответствующим числом атомов углерода: метаналь, этаналь, пропаналь, бутаналь, пентаналь и т.д.
- Вы можете встретить их молекулярные формулы, где группа OH записана наоборот - HO. Например: метаналь - HCHO, этаналь - CH 3 CHO, пропаналь - C 2 H 5 CHO. Это делают специально для того, чтобы их было легче отличить от спиртов.
- Многие альдегиды имеют тривиальные названия. Наиболее известные: метаналь - формальдегид , этаналь - ацетальдегид. Замечу, что формалином называется 40% раствор формальдегида.
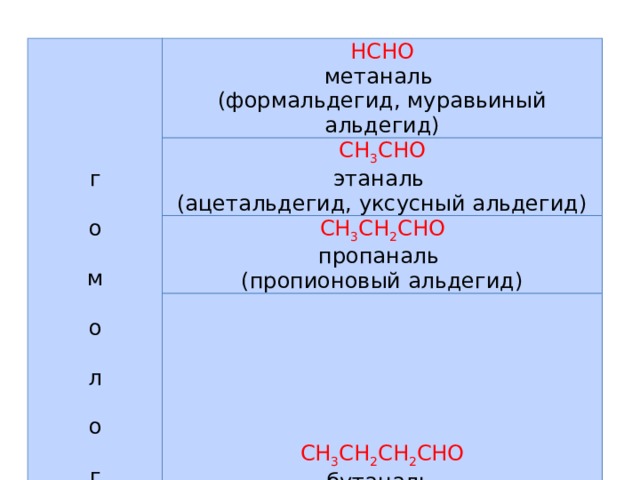
г о м о л о г и
HCHO метаналь
(формальдегид, муравьиный альдегид)
CH 3 CHO этаналь
(ацетальдегид, уксусный альдегид)
CH 3 CH 2 CHO пропаналь
(пропионовый альдегид)
CH 3 CH 2 CH 2 CHO бутаналь
(масляный альдегид)

Гомологический ряд
- метаналь или формальдегид ( CH2O);
- этаналь или ацетальдегид ( C2H4O);
- пропаналь ( C3H6O);
- бутаналь ( C4H8O);
- пентаналь ( C5H10O);
- гексаналь ( C6H12O);
- гептаналь ( C7H14O);
- октаналь ( C8H16O);
- нонаналь ( C9H18O);
- деканаль ( C10H20O)

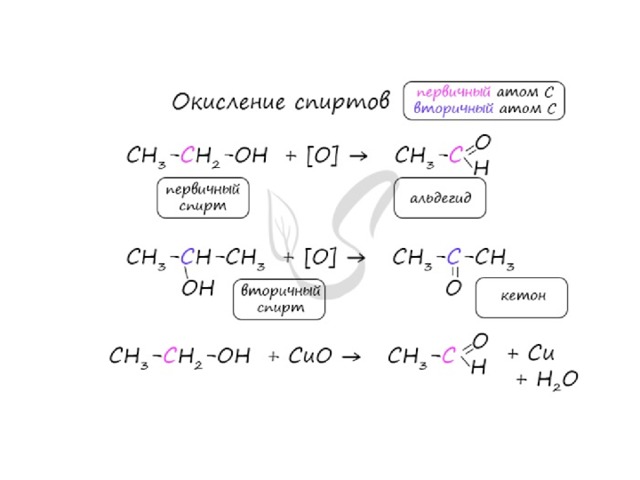
Получение альдегидов и кетонов
Важно заметить, что при окислении первичных спиртов образуются альдегиды ,
при окислении вторичных спиртов - кетоны.
Окисление с помощью оксида меди относится к лабораторным способам получения альдегидов.
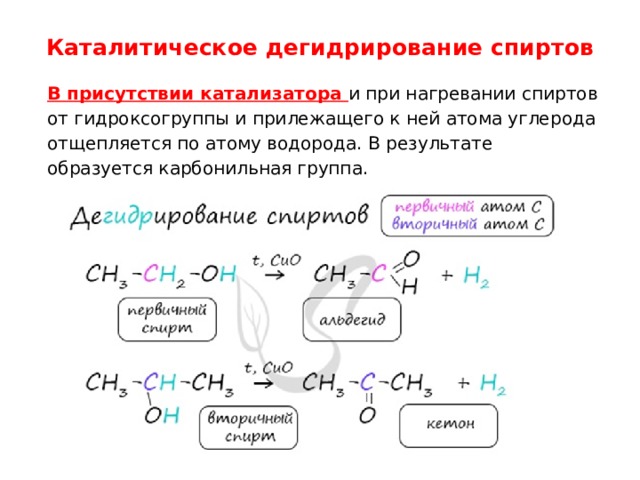
Каталитическое дегидрирование спиртов
В присутствии катализатора и при нагревании спиртов от гидроксогруппы и прилежащего к ней атома углерода отщепляется по атому водорода. В результате образуется карбонильная группа.

Реакция Кучерова
Реакцией Кучерова называют гидратацию алкинов в присутствии солей двухвалентной ртути .
В результате такой реакции ацетилен превращается в уксусный альдегид. Все остальные его гомологи: пропин, бутин, пентин и т.д. превращаются в соответствующие кетоны.
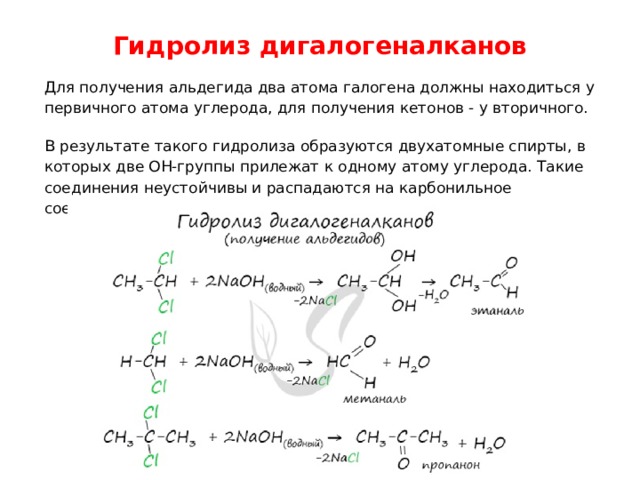
Гидролиз дигалогеналканов
Для получения альдегида два атома галогена должны находиться у первичного атома углерода, для получения кетонов - у вторичного.
В результате такого гидролиза образуются двухатомные спирты, в которых две OH-группы прилежат к одному атому углерода. Такие соединения неустойчивы и распадаются на карбонильное соединение (альдегид или кетон) и воду.
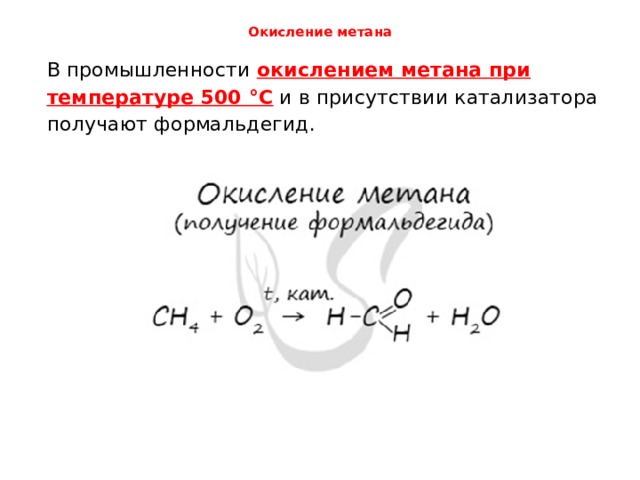
Окисление метана
В промышленности окислением метана при температуре 500 °C и в присутствии катализатора получают формальдегид.
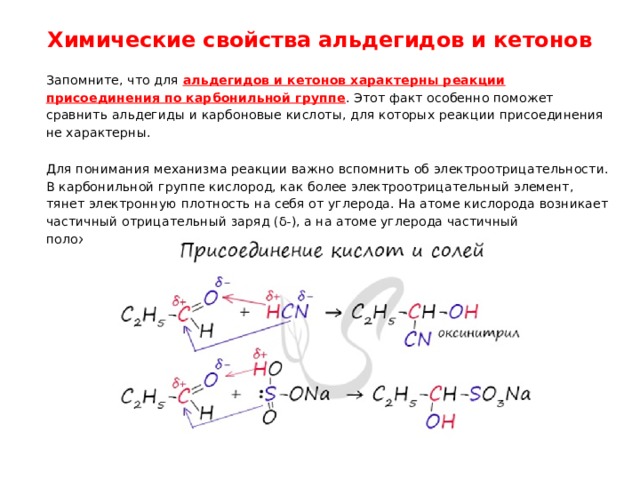
Химические свойства альдегидов и кетонов
Запомните, что для альдегидов и кетонов характерны реакции присоединения по карбонильной группе . Этот факт особенно поможет сравнить альдегиды и карбоновые кислоты, для которых реакции присоединения не характерны.
Для понимания механизма реакции важно вспомнить об электроотрицательности. В карбонильной группе кислород, как более электроотрицательный элемент, тянет электронную плотность на себя от углерода. На атоме кислорода возникает частичный отрицательный заряд (δ-), а на атоме углерода частичный положительный (δ+).
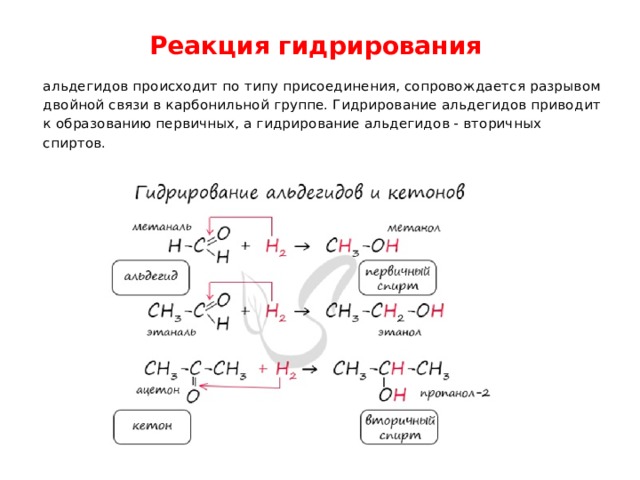
Реакция гидрирования
альдегидов происходит по типу присоединения, сопровождается разрывом двойной связи в карбонильной группе. Гидрирование альдегидов приводит к образованию первичных, а гидрирование альдегидов - вторичных спиртов.

Окисление альдегидов
В результате полного окисления, горения, образуется углекислый газ и вода.
2CH 3 CHO + 5O 2 → 4CO 2 + 4H 2 O
Альдегиды легко окисляются до карбоновых кислот в лабораторных условиях. Это осуществляется с помощью известной реакции серебряного зеркала. Данная реакция является качественной для альдегидов.
Кетоны, в отличие от альдегидов, в реакции окисления не вступают.
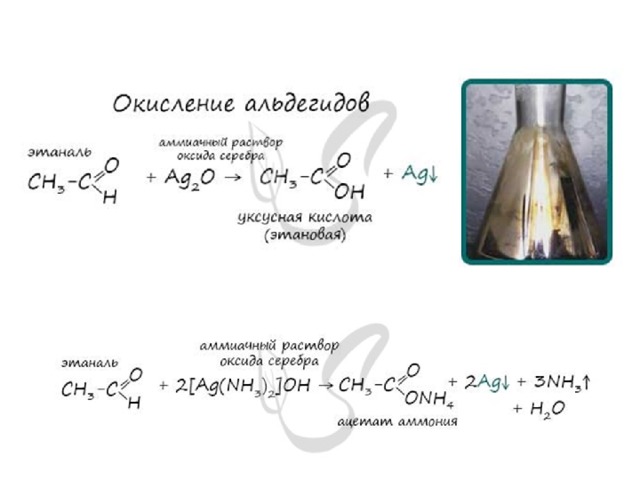

Важно заметить, что при окислении метаналя, образовавшаяся муравьиная кислота тут же окисляется до угольной кислоты, которая распадается на углекислый газ и воду. Это связано с интересным фактом - наличием альдегидной группы у муравьиной кислоты.
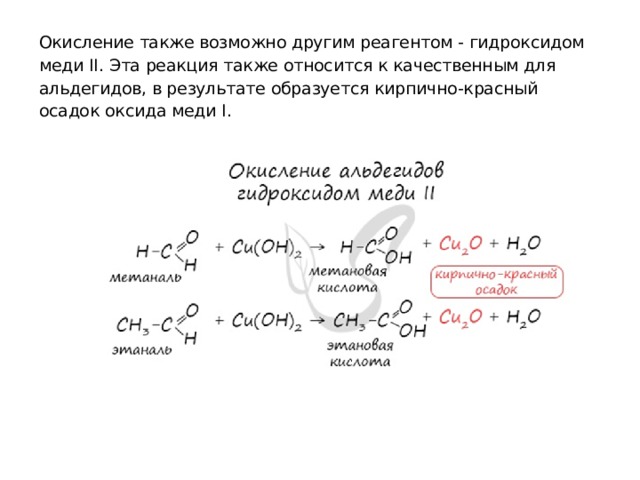
Окисление также возможно другим реагентом - гидроксидом меди II. Эта реакция также относится к качественным для альдегидов, в результате образуется кирпично-красный осадок оксида меди I.
















































