
Цели занятия
- 1. Закрепить понятие «химическая реакция», повторить признаки и условия протекания различных химических реакций.
- 2. Обобщить знания о классификации химических реакций по составу и количеству исходных веществ и продуктов реакции.
- 3. Продолжить формирование умения записывать уравнения химических реакций.

Химические реакции – это…
это явления, сопровождающиеся образованием новых веществ
По каким признакам можно
определить, что у вещества
изменились свойства ?
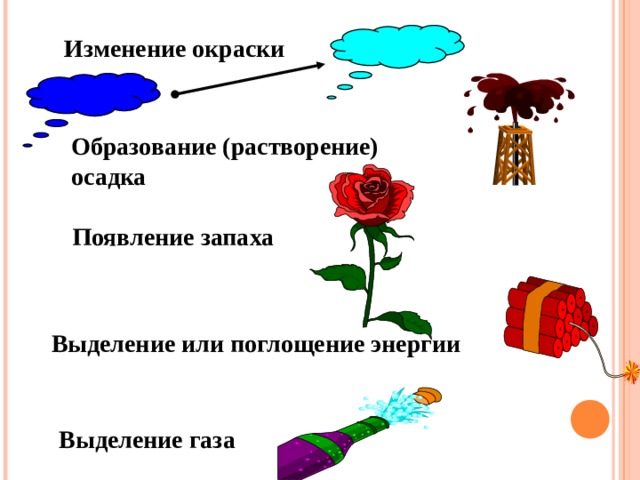
Изменение окраски
Образование (растворение)
осадка
Появление запаха
Выделение или поглощение энергии
Выделение газа
РЕАКЦИИ ВОКРУГ НАС
Ежесекундно в организме человека происходят сотни и тысячи всевозможных реакций.

Как с помощью химического языка описать происходящие явления?
Химическое уравнение – это условная запись химической реакции с помощью химических формул и математических знаков .

Правила составления уравнений химических реакций.
Уравнения химических реакций составляют на основании Закона сохранения массы веществ.
Число атомов химических элементов до реакции и после неё, остаётся неизменным, а значит, их общая масса тоже не изменяется.
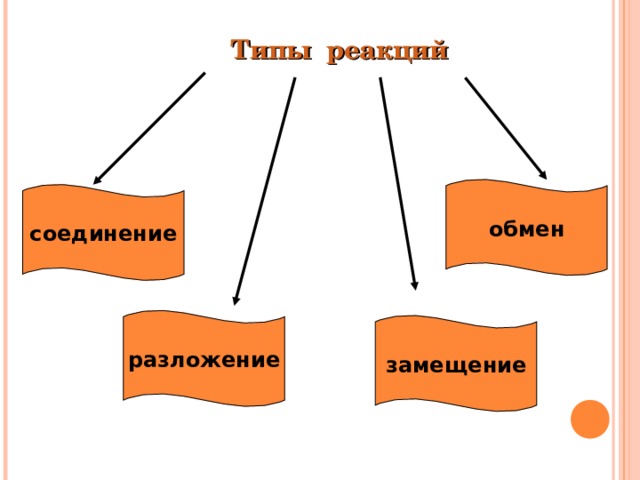
Типы реакций
обмен
соединение
разложение
замещение

Типы химических реакций.
По изменению числа исходных веществ и конечных продуктов реакции делят на:
- Реакции соединения.
- Реакции разложения.
- Реакции замещения.
- Реакции обмена.

Примеры реакций соединения
А + В = АВ
2 Al + 3Br 2 = 2 Al Br 3
CaO + H 2 O = Ca(OH) 2

Реакции между двумя или несколькими простыми или сложными веществами в результате которых образуется только одно сложное вещество

Примеры реакций разложения
АВ = А + В
Cu (OH) 2 = Cu O + H 2 O
2 HgO = 2 Hg + O 2

Реакции в результате которых из одного сложного вещества получается несколько простых или сложных веществ

Примеры реакций замещения
АВ + С = А + СВ
CuS О 4 + Zn = Cu + ZnS О 4
Cu S О 4 + Fe = Cu + FeS О 4
это реакции, в результате которых атомы простого вещества замещают атомы какого-нибудь элемента в сложном веществе.

Примеры реакций обмена
АВ + СД = АД + СВ
C u CI 2 + 2 NaOH = C u(OH) 2 +2NaCl
KOH + HCI = KCI + H 2 O

Это реакции, при которых два сложных вещества обмениваются своими составными частями.

Закрепление
1 . Расставьте коэффициенты в следующих уравнениях реакций. Определите типы реакций:

Закрепление
2. Напишите уравнения реакций по названиям исходных веществ и продуктов реакций. Определите типы реакций.
а) Оксид натрия + оксид азота ( V ) →
→ нитрат натрия
б) Железо + соляная кислота →
→ хлорид железа ( II ) + водород
в) Хлорид калия + нитрат серебра →
→ нитрат калия + хлорид серебра
г) Железо + сера → сульфид железа ( II )
д) Сульфат магния + гидроксид натрия →
→ гидроксид магния + сульфат натрия

По тепловому эффекту реакции делятся
Эндотермические
протекают с поглощением энергии
Экзотермические
протекают с выделением энергии

Домашнее задание
- Упражнение №3, стр. 145
- Упражнение №7, стр. 128


Примеры экзотермимеских реакций
CH 4 +2O 2 = CO 2 +2H 2 O +Q
Примеры эндотермимеских реакций
Mg(OH) 2 =MgO+H 2 O -Q