Разработка урока в 8 классе .
ТЕМА: «Типы химических связей».
Цель урока: Обобщить, систематизировать знания о химической связи, её видах и схемах образования; создать на уроке атмосферу поиска и сотрудничества.
Задачи:
Образовательные: актуализировать имеющиеся знания, связанные с понятиями «металлы», «неметаллы», ионная связь, ковалентная неполярная связь, металлическая связь, ион, катион, анион, электроотрицательность;
Мотивировать обучающихся к изучению темы, определить на сколько хорошо дети умеют выполнять олимпиадные задания.
Развивающие: развивать познавательную активность учащихся к предмету - продолжить формирование идеи познаваемости мира; совершенствовать умение определять тип химической связи в соединении; развитие творческого химического мышления.
Воспитательные: развивать познавательный интерес учащихся; способствовать росту инициативы и самостоятельности; научить работать сообща, в группе;
Тип урока: обобщение изученного материала
Методы и методические приемы: лекция, беседа, формулирование проблемы, работа с учебником, работа с тетрадью, демонстрация образцов веществ с различными типами связи, демонстрация компьютерной презентации, работа с тестированными заданиями по изученным темам из материалов ГИА прошлых лет.
Формы организации познавательной деятельности обучающихся: коллективная, индивидуальная, групповая.
Ход урока
I этап. Самоопределение к деятельности (целеполагание)
1.Организационный момент.
Приветствие. Проверка отсутствующих. Проверка готовности учащихся к занятию.
2. Сообщение темы и задач урока. Мотивация учебной деятельности учащихся.
Здравствуйте ребята! Мне хотелось бы начать урок со слов Нансена, известного педагога-психолога «Жизненные позиции заразительны… А ваша позиция может кого то увлечь?». Свою жизненную позицию я вижу в том, чтобы помочь вам овладеть компетенциями, которые в дальнейшем помогут вам успешно сдать ГИА по химии, что позволит вам поступить в выбранные вами учебные заведения.
Тема нашего урока «Типы химических связей», цель урока – повторить, закрепить и углубить знания о типах химических связей, структуре кристаллической решетки и характерных свойствах веществ.
3. Актуализация знаний. Воспроизведение и коррекция опорных знаний учащихся
На экране высвечиваются слова: электроотрицательность.
«Что вам известно об этом понятии?»
На какие группы условно можно разделить химические элементы ПСХЭ? Приведите примеры какие слова – ассоциации приходят вам на ум, когда вы слышите эти понятия?»
Учение о химической связи составляет основу всей теоретической химии.
-Что называется химической связью?
-Все ли химические элементы образуют химические связи?
- Какие элементы не образуют химические связи? Почему?
Какие частицы могут принимать участие в образовании химической связи? (неспаренные валентные электроны, пара валентных электронов, находящихся на одной орбитали, вакантная орбиталь).
1.По данным о распределении валентных электронов назовите элемент:
а) 2s1
б) 2s22p4
в) 3s23p6
г) 3d104s1
2.определите какой химический элемент имеет более выраженные металлические и неметаллические свойства в парах:
Li и Cs, Na и Al, P и Cl, В и F.
II этап. Учебно-познавательная деятельность (изучение нового содержания)
Обобщая высказывания ребят предлагаю сформулировать проблему наиболее подготовленным ученикам.
ПРОБЛЕМА: Механизм химической связи в разных веществах различен. Каков же он?
4.Обобщение и систематизация
Сегодня на уроке мы продолжаем изучение строение веществ, мы с вами должны расширить знаний о химических связях и их типах.
Различают четыре типа химической связи. Какие?
Чтобы ответить на этот вопрос я предлагаю вам составить таблицу «Типы химической связи».
-Какая связь называется ионной?
-Как заряжены катионы и анионы, из каких элементов и как они образовались?
(Записывают виды химической связи в листах индивидуальной работы; проверяют по слайду-1 ученик у доски пишет схему образования NaCl,остальные устно отвечают на вопросы. После проверки учащиеся записывают схему образования NaCl в таблицу.
-Устно выполняют задание1 ;2-е задание «крестики-нолики» -отмечают вещества с ионной связью в листе индивидуальной работы; правильность выполнения проверяют по слайду).

2) Какая связь называется ковалентной?
-Какие два вида ковалентной связи вам известны?
-Дайте определение ковалентной неполярной связи. Примеры веществ.
Какая связь называется ковалентной полярной? Примеры веществ.
(У доски 1 ученик пишет схему образования F2 , остальные устно отвечают на вопросы;После проверки схему записывают в таблицу. Задание 3- устно. Задание 4 – в листах индивидуальной работы; правильность выполнения проверяют по слайду №10
У доски 1 ученик пишет схему образования HCl; остальные устно отвечают на вопросы;
После проверки схему записывают в таблицу.Задание 5- устно. Задание 6 – в листах индивидуальной работы; ответы проверяют по слайду №13)

3) Металлическая связь
-Какая связь называется металлической?
- Какие металлы вам известны?
-Приведите примеры сплавов.
(1 ученик у доски пишет схему металлической связи у Al и Zn; остальные отвечают устно после проверки, схему записывают в таблицу)
4) Водородная связь.
-Какая связь называется водородной?
-Каких видов она бывает? Примеры веществ.
(1 ученик у доски записывает схему водородной связи между молекулами воды; остальные отвечают устно; После проверки схему записывают в таблицу. Учащиеся отвечают устно.)
О - - Н + … О - - Н + …
| |
H + H + вода
Анализируем по схеме «Типы химических связей» и делаем выводы.
1Ṿ Применение полученных знаний, умений и навыков.
Прочность ионной и ковалентной связи
Ситуация: Предположим, что мы готовим примерно ведро вареной картошки (супа). Бросаем в него столовую ложку (58,5 г) поваренной соли. Давайте попробуем вычислить, с каким усилием надо «размешивать» соль, чтобы она растворилась и распалась на ионы, т.е. чтобы разрушилась кристаллическая решетка хлорида натрия.
На доске (экране): NaCl 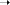 Na + + Cl-
Na + + Cl-
Вопросы классу: Как образуется ионная связь? Что такое "правило 8-ми электронов"?
Вопрос классу: А почему соль сама распадается на ионы при растворении в воде? (вспомним про диполи воды)
Вывод: ионная связь прочная, и ее рвут тоже ионные силы. Поэтому в бензине соль почти не растворяется.
2) Работа в паре. Учащиеся получают карточки с заданием, которое выполняют совместно: «найдите ошибку в высказываниях и исправьте ее:
а) атомы неметаллов не взаимодействуют друг с другом, а если взаимодействуют, то между ними образуется ионная связь;
б) ковалентная полярная и ковалентная неполярная связь образуется между атомами металлов.
3) Ребята, какое свойство атома мы называем электроотрицательностью?
Какие кристаллические решетки образуют вещества с ковалентной связью в твердом состоянии?
Какова же причина образования химической связи? Почему атомы образуют химические связи?
Причина в стремлении атомов к стабильной электронной конфигурации.
4) Индивидуальная работа. Предлагаю составить формулы веществ, образованных частицами X и Y, укажите вид связи:
1) X (1e) и Y (2e, 6e); H2O
2) X (1s2 2s2 p 6 3s1) и Y (1s22s2p 63s2p 4 ) Na2S
3) +12X и +7Y; Mg3N2
4) X (Ba2+) Y (Cl- ); BaCl2
5) X (гл. п/гр. IV группы,2-й период) и Y (гл. п/гр. VI группы, 2-й период) CO2
111. этап. Закрепление. Диагностика качества освоения темы.
Выполнить задания разного уровня. Каждый учащийся выбирает уровень сложности, опираясь на свои знания:
1 уровень на оценку «3»
Даны формулы веществ: Н2, HCl, Mg, KCl, O2, CaCl2, H2O. Определите тип связи в веществах. Ответ обоснуйте.
11 уровень на оценку «4»
Тестовые задания.
1. В аммиаке и хлориде бария химическая связь соответственно
а) ионная и ковалентная полярная
б) ковалентная полярная и ионная
в) ковалентная неполярная и металлическая
г) ковалентная неполярная и ионная
2. Вещества только с ионной связью приведены в ряду:
а) F2, ССl4, КС1
б) NaBr, Na2O, KI
в) SO2, P4, CaF2
г) H2S, Br2, K2S
3. В каком ряду все вещества имеют ковалентную полярную связь?
а) HCl, NaCl, Cl2
б) O2, H2O, CO2
в) H2O, NH3, CH4
г) NaBr, HBr, CO
4.Веществом с ковалентной неполярной связью является
а) С12 б) NaBr в) H2S г) MgCl2
5. Металлическая связь характерна для
а) С12 б) SO3 в) СО г) Fe
3 уровень на оценку «5»
Варианты заданий:
Задание 1. Определите химическую связь у HCL, F2O, CL2 по предложенному алгоритму.
Задание 2. Зная, что в растворах попарно присутствуют ионы водорода и хлора, водорода и серы, кислорода и углерода, составьте схемы химической связи данных веществ.
Задание 3. В растворе несколько неизвестных веществ. В результате анализа, выяснили, что в растворе присутствуют: ионы хлора, водорода, кислорода, фосфора, натрия, магния. Предложите возможные варианты образования химической связи. Ответьте на вопрос: Какие виды химической связи можно образовать?
8. Итог урока
Ребята, какие выводы мы можем сделать?
Чтобы определиться со свойствами вещества, необходимо знать тип химической связи и особенности его строения и наоборот.
IV этап. Рефлексивная деятельность
Что для вас оказалось самым сложным? Что понравилось? Что не понравилось? Давайте оценим работу друг друга.
Задание на самоанализ.
Составьте синквейн на тему «Виды химической связи».
9. Домашнее задание
Изучить § 56, задание № 2,3 решить в тетради.
Выставление отметок за урок.









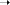 Na + + Cl-
Na + + Cl-









