Просмотр содержимого документа
«Типы химических связей»

Проверочная работа
1 вариант
2 вариант
- Электронное строение атомов бора и фосфора
- Укажите число электронов на внешнем энергетическом уровне атома серы
- Укажите число электронных уровней у атома бария
- Наиболее выраженными металлическими свойствами обладает: магний или стронций
- Наиболее выраженными неметаллическими свойствами обладает: углерод или фтор
- Электронное строение атомов азота и алюминия
- Укажите число электронов на внешнем энергетическом уровне атома хлора
- Укажите число электронных уровней у атома лития
- Наименее выраженными неметаллическими свойствами обладает: азот или мышьяк
- Наименее выраженными металлическими свойствами обладает: натрий или алюминий
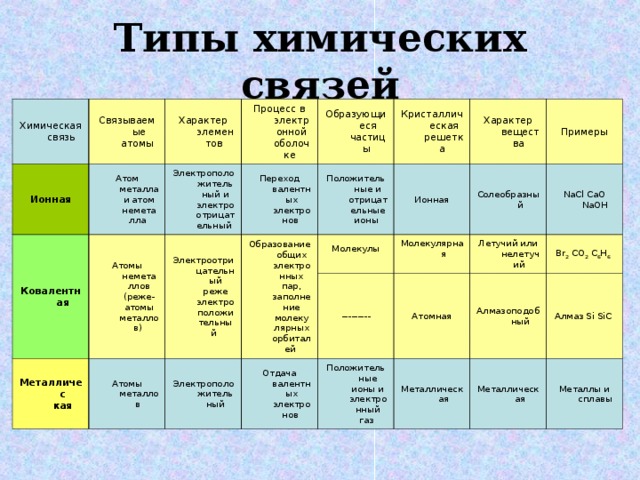
Типы химических связей
Химическая связь
Ионная
Связываемые атомы
Характер элементов
Атом металла и атом неметалла
Ковалентная
Процесс в электронной оболочке
Электроположительный и электро отрицательный
Атомы неметаллов (реже-атомы металлов)
Образующиеся частицы
Переход валентных электронов
Электроотрицательный реже электроположительный
Металличес кая
Кристаллическая решетка
Положительные и отрицательные ионы
Образование общих электронных пар, заполнение молекулярных орбиталей
Атомы металлов
Ионная
Характер вещества
Молекулы
Электроположительный
Солеобразный
Примеры
Молекулярная
---------
Отдача валентных электронов
NaCl CaO NaOH
Положительные ионы и электронный газ
Летучий или нелетучий
Атомная
Алмазоподоб ный
Br 2 CO 2 C 6 H 6
Металлическая
Алмаз Si SiC
Металлическая
Металлы и сплавы

Ковалентная связь
Ковалентная связь образуется за счёт общих электронных пар, возникающих в оболочках связываемых атомов.
Она может быть образована атомами одного итого же элемента и тогда она неполярная; например, такая ковалентная связь существует в молекулах одноэлементных газов H2, O2, N2, Cl2
Ковалентная связь может быть образована атомами разных элементов, сходных по химическому характеру, и тогда она полярная; например, такая ковалентная связь существует в молекулах H2O, NF3, CO2.
Ковалентная связь образуется между атомами элементов, обладающих электроотрицательным характером.
Электроотрицательность - это способность атомов химического элемента оттягивать к себе общие электронные пары, участвующие в образовании химической связи.
Ряд электроотрицательностей

Ионная связь
Чисто ионной связью называется химически связанное состояние атомов, при котором устойчивое электронное окружение достигается путём полного перехода общей электронной плотности к атому более электроотрицательного элемента. Ионы - это электрически заряженные частицы, образующиеся из нейтральных атомов или молекул путем отдачи или присоединени электронов.
При отдаче электронов образуется положительно заряженный ион- катион , при присоединении-отрицательный- анион .
Схема образования ионной связи.
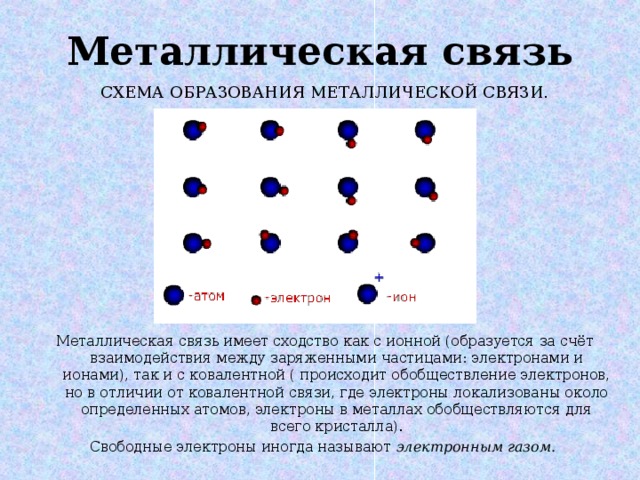
Металлическая связь
СХЕМА ОБРАЗОВАНИЯ МЕТАЛЛИЧЕСКОЙ СВЯЗИ.
Металлическая связь имеет сходство как с ионной (образуется за счёт взаимодействия между заряженными частицами: электронами и ионами), так и с ковалентной ( происходит обобществление электронов, но в отличии от ковалентной связи, где электроны локализованы около определенных атомов, электроны в металлах обобществляются для всего кристалла).
Свободные электроны иногда называют электронным газом.





















