
Типы реакций и реагентов в органической химии
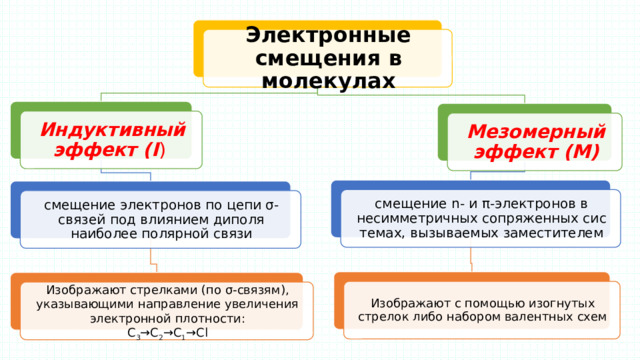
Электронные смещения в молекулах
Индуктивный эффект (I )
Мезомерный эффект (М)
смещение n- и π-электронов в несимметричных сопряженных системах, вызываемых заместителем
смещение электронов по цепи σ-связей под влиянием диполя наиболее полярной связи
Изображают с помощью изогнутых стрелок либо набором валентных схем
Изображают стрелками (по σ-связям), указывающими направление увеличения электронной плотности:
С 3 →С 2 →C 1 →Cl

Важнейшие особенности I-эффекта:
- I-эффект описывает смещение σ-электронов по цепи σ-связей в одном направлении;
- это смещение не сопровождается переходом электронов из оболочки одного атома в оболочку другого, т. е. происходит в пределах связи;
- электронные смещения вдоль цепи σ-связей неодинаковы, они быстро уменьшаются по мере удаления от источника возмущения (ключевого атома).
σσσ + σσ + σ + σ − С 3 С 2 С 1 Сl
- I-эффект может иметь знак «+» или «-». Если атом или группа атомов притягивает электроны сильнее водорода в алифатической связи С—Н, то принято считать, что они обладают - I-эффектом, если притягивают слабее, то считается, что эти группы обладают + I-эффектом и отталкивают электроны.
δ− .δ+ δ-
R 3 С ←A R 3 C—Н R 3 C→В
+ I-эффект Стандарт - I-эффект
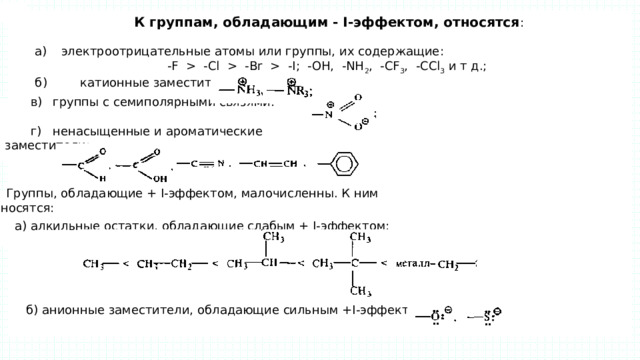 -Сl -Вr -I; -ОН, -NH 2 , -CF 3 , -ССl 3 и т д.; б) катионные заместители: в) группы с семиполярными связями: г) ненасыщенные и ароматические заместители: Группы, обладающие + I-эффектом, малочисленны. К ним относятся: а) алкильные остатки, обладающие слабым + I-эффектом: б) анионные заместители, обладающие сильным +I-эффектом : " width="640"
-Сl -Вr -I; -ОН, -NH 2 , -CF 3 , -ССl 3 и т д.; б) катионные заместители: в) группы с семиполярными связями: г) ненасыщенные и ароматические заместители: Группы, обладающие + I-эффектом, малочисленны. К ним относятся: а) алкильные остатки, обладающие слабым + I-эффектом: б) анионные заместители, обладающие сильным +I-эффектом : " width="640"
К группам, обладающим - I-эффектом, относятся :
а) электроотрицательные атомы или группы, их содержащие:
-F -Сl -Вr -I; -ОН, -NH 2 , -CF 3 , -ССl 3 и т д.;
б) катионные заместители:
в) группы с семиполярными связями:
г) ненасыщенные и ароматические заместители:
Группы, обладающие + I-эффектом, малочисленны. К ним относятся:
а) алкильные остатки, обладающие слабым + I-эффектом:
б) анионные заместители, обладающие сильным +I-эффектом :

В отличие от индуктивного мезомерный эффект передается по цепи сопряжения без затухания и сопровождается перераспределением электронов между связями.
Обозначают знаком «+» или «-», Знак М-эффекета определяется способностью заместителя притягивать или подавать электроны в сопряженной системе связей.
Группа, подающая электроны в направлении двойной связи, обладает +М-эффектом, Такое смещение электронов возникает в случае n, π-сопряженных систем:
Группа, оттягивающая электроны от двойной связи, обладает -М-эффектом. Такие электронные смещения характерны для несимметричных n, π -сопряженных систем :
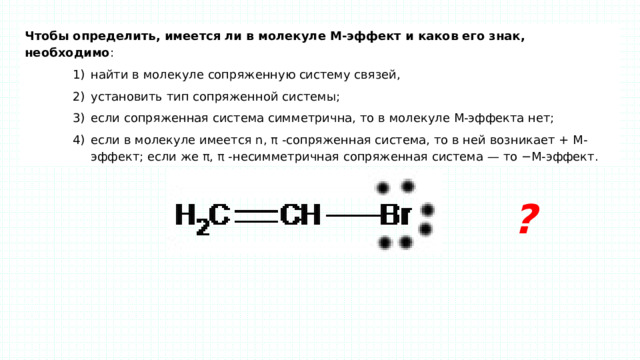
Чтобы определить, имеется ли в молекуле М-эффект и каков его знак, необходимо :
- найти в молекуле сопряженную систему связей, установить тип сопряженной системы; если сопряженная система симметрична, то в молекуле М-эффекта нет; если в молекуле имеется n, π -сопряженная система, то в ней возникает + М-эффект; если же π, π -несимметричная сопряженная система — то −М-эффект.
- найти в молекуле сопряженную систему связей, установить тип сопряженной системы; если сопряженная система симметрична, то в молекуле М-эффекта нет; если в молекуле имеется n, π -сопряженная система, то в ней возникает + М-эффект; если же π, π -несимметричная сопряженная система — то −М-эффект.
- найти в молекуле сопряженную систему связей,
- установить тип сопряженной системы;
- если сопряженная система симметрична, то в молекуле М-эффекта нет;
- если в молекуле имеется n, π -сопряженная система, то в ней возникает + М-эффект; если же π, π -несимметричная сопряженная система — то −М-эффект.
?
4
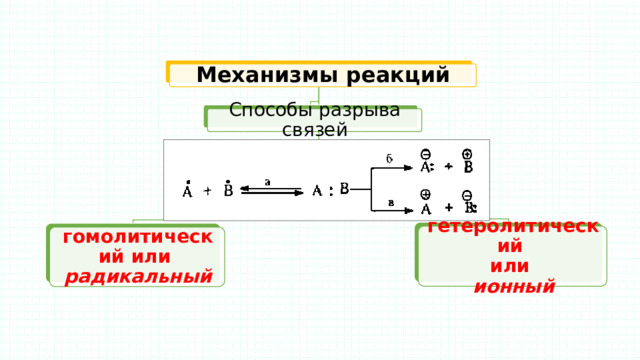
Механизмы реакций
Способы разрыва связей
гетеролитический
или
ионный
гомолитический или
радикальный
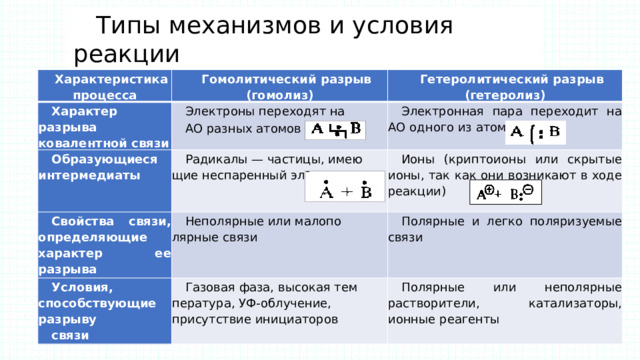
Типы механизмов и условия реакции
Характеристика процесса
Характер разрыва ковалентной связи
Гомолитический разрыв (гомолиз)
Гетеролитический разрыв (гетеролиз)
Электроны переходят на
Образующиеся интермедиаты
АО разных атомов
Электронная пара переходит на АО одного из атомов
Радикалы — частицы, имеющие неспаренный электрон
Свойства связи, определяющие характер ее разрыва
Условия, способствующие разрыву
Неполярные или малополярные связи
Ионы (криптоионы или скрытые ионы, так как они возникают в ходе реакции)
Полярные и легко поляризуемые связи
связи
Газовая фаза, высокая температура, УФ-облучение, присутствие инициаторов
Полярные или неполярные растворители, катализаторы, ионные реагенты

Классификация реагентов.
Из участвующих в реакции нескольких веществ одно часто рассматривается в качестве субстрата, а другое — в качестве реагента.
Субстрат — это объект превращения (атакуемое вещество),
реагент — атакующее вещество.
При выборе реагента и субстрата полезно руководствоваться следующими правилами.
а) в качестве субстрата обычно выбирается соединение, один из атомов углерода которого является реакционным центром; тогда реагентом будет вещество, атакующее С-атом субстрата;
б) если в результате реакции образуется новая С — С-связь, то в качестве реагента рассматривается соединение, у которого в реакции участвует более полярная связь.
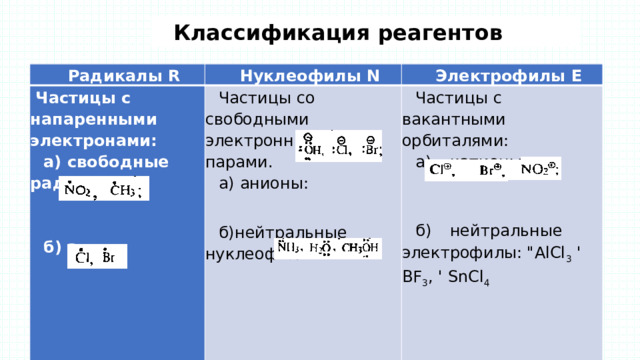
Классификация реагентов
Радикалы R
Частицы с напаренными электронами:
Нуклеофилы N
Электрофилы Е
а) свободные радикалы
Частицы со свободными электронными парами.
а) анионы:
Частицы с вакантными орбиталями:
а) катионы:
б) атомы
б)нейтральные нуклеофилы:
б) нейтральные электрофилы: "АlСl 3 ' ВF 3 , ' SnCl 4
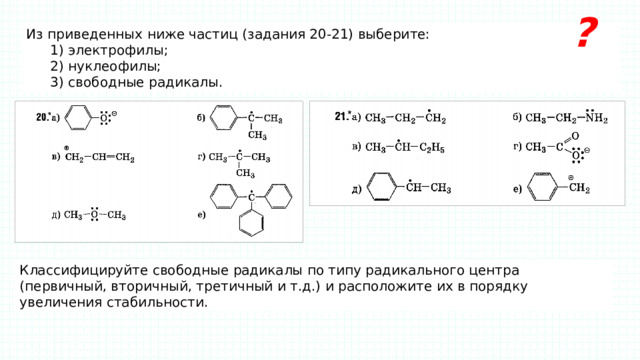
?
Из приведенных ниже частиц (задания 20-21) выберите:
1) электрофилы;
2) нуклеофилы;
3) свободные радикалы.
Классифицируйте свободные радикалы по типу радикального центра (первичный, вторичный, третичный и т.д.) и расположите их в порядку увеличения стабильности.

?
Назовите углеводород состава С 6 Н 14 , из которого нельзя образовать вторичный алкил.
Назовите углеводород состава С 7 Н 16 , из которого можно образовать один третичный алкил, но нельзя образовать вторичный алкил.

Классификация реакций по направлению в соответствии с результатам химического превращения.
Используемые при этом наименования реакций отражают изменения в исходных соединениях, затрагивающие реакционный центр:
а) реакции замещения S (от лат. Substitutio — замещение) — это реакции, в которых происходит замещение какой-либо группы или атома в молекуле на другую группу, при этом замещающая группа обычно связывается с тем же атомом углерода, с которым была связана уходящая группа или атом: CH 3 −H + Cl 2 CH 3 −Cl + HCl
б) реакции присоединения A (от англ. Аddition - присоединение) – это реакции, в результате которых происходит присоединение молекул или частиц по месту разрыва кратных связей в исходной молекуле: СН 2 = СН 2 + НВr → CH 3 − CH 2 Br
в) реакции элиминирования или отщепления Е (от англ. Elimination — удаление, отщепление) это реакции, протекающие с удалением двух групп или атомов из одного и того же вещества:
г) внутримолекулярные перегруппировки — реакции, сопровождающиеся изменением порядка связей атомов в молекуле;

Если объединить классификации типа А и Б, то все многообразие органических реакций можно свести к нескольким категориям:
а) A r и S r —реакции радикального присоединения и замещения;
б) А Е и S e − реакции электрофильного присоединения и замещения;
в) A n и S n — реакции нуклеофильного присоединения и замещения;
г) синхронные или перициклические реакции присоединения;
д) элиминирование ( Е ). протекающее преимущественно по гетеролитическому или синхронному механизмам;
е) перегруппировки различного типа, протекающие с миграцией электронной пары (нуклеофильные), одного электрона (свободнорадикальные), без миграции электронов (электрофильные) или синхронно;
ж) реакции окисления и восстановления, которые могут протекать по различным механизмам.
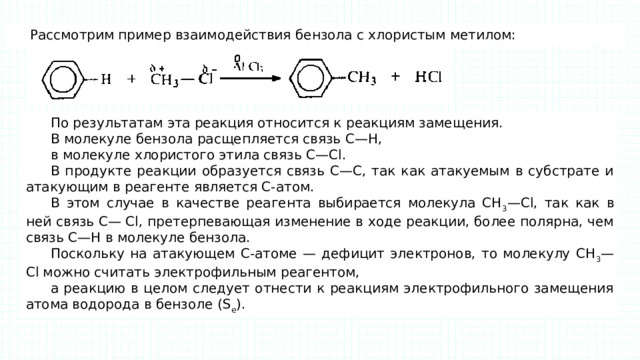
Рассмотрим пример взаимодействия бензола с хлористым метилом:
По результатам эта реакция относится к реакциям замещения.
В молекуле бензола расщепляется связь С—Н,
в молекуле хлористого этила связь С—Сl.
В продукте реакции образуется связь С—С, так как атакуемым в субстрате и атакующим в реагенте является С-атом.
В этом случае в качестве реагента выбирается молекула СН 3 —Сl, так как в ней связь С— Сl, претерпевающая изменение в ходе реакции, более полярна, чем связь С—Н в молекуле бензола.
Поскольку на атакующем С-атоме — дефицит электронов, то молекулу СН 3 — Сl можно считать электрофильным реагентом,
а реакцию в целом следует отнести к реакциям электрофильного замещения атома водорода в бензоле (S e ).
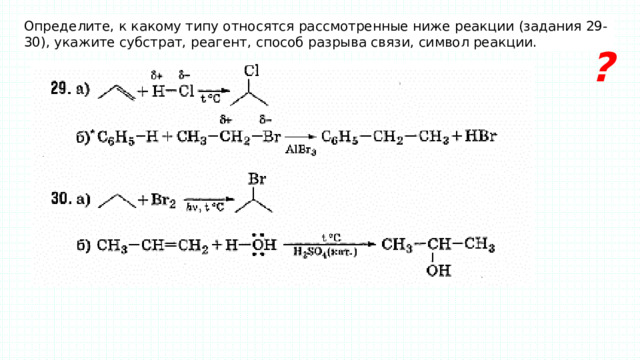
Определите, к какому типу относятся рассмотренные ниже реакции (задания 29-30), укажите субстрат, реагент, способ разрыва связи, символ реакции.
?
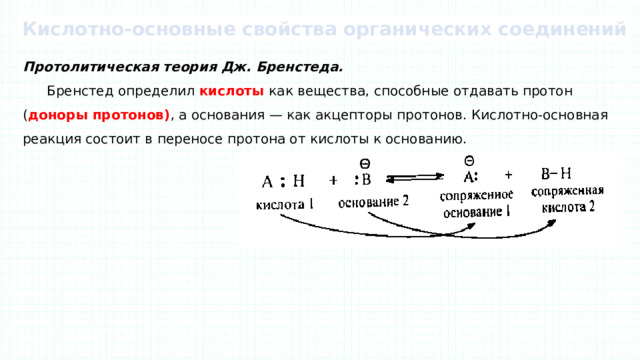
Кислотно-основные свойства органических соединений
Протолитическая теория Дж. Бренстеда.
Бренстед определил кислоты как вещества, способные отдавать протон ( доноры протонов) , а основания — как акцепторы протонов. Кислотно-основная реакция состоит в переносе протона от кислоты к основанию.

Теория Т Н. Льюиса .
Кислота по Льюису является акцептором, а основание — донором электронной пары . Эта пара электронов может быть либо неподеленной, либо находящейся на π-орбитали.
Кислотой Льюиса считается соединение или частица с вакантной орбиталью, которые могут принять электронную пару с образованием ковалентной связи − электрофил. Преимущество теории Льюиса состоит в том, что с ее помощью можно объяснить кислотно-основные свойства гораздо большего числа органических соединений,
К кислотам Льюиса относятся все электронодефицитные соединения, содержащие низкие по энергии вакантные орбитали и все катионы, включая протон. Например, такие соединения, как AlCl 3 и BF 3 , являются кислотами Льюиса, поскольку, имея шесть электронов на внешней оболочке, они способны принять электронную пару и образовать ковалентную связь.
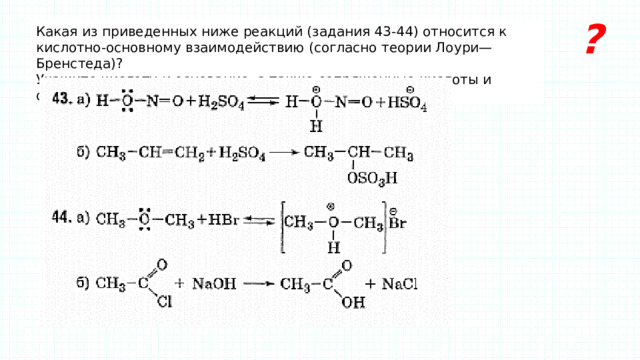
?
Какая из приведенных ниже реакций (задания 43-44) относится к кислотно-основному взаимодействию (согласно теории Лоури— Бренстеда)?
Укажите кислоту и основание, а также сопряженные кислоты и основания.

Тип гибридизациии . Известно, что относительная кислотность углеводородов снижается в следующем ряду: sp – sp 2 – sp 3
В этом ряду снижается вклад s-электронов в гибридную орбиталь от 1/2 до 1/4. Поскольку энергия s-орбитали ниже энергии р-орбитали, то чем больший s-характер будет иметь гибридная орбиталь, тем ниже будет ее энергия. Отсюда следует, что карбанион при sp-углеродном атоме должен быть более стабилен, чем карбанионы при sp 2 - и sр 3 -гибридном углероде
Водородные связи . На силу кислот и оснований могут оказывать большое влияние как межмолекулярные, так и внутримолекулярные водородные связи. Например, величина рК а для пара- и орто- гидроксибензойных кислот составляет 4,58 и 2,98 соответственно Это различие объясняется тем, что у орто-изомера возникает внутримолекулярная
внутримолекулярная водородная связь между группами О−Н и СОО − сопряженного основания.
Пространственные эффекты
На реакционную способность молекул могут оказывать влияние пространственные (стерические) эффекты, обусловленные определенным расположением групп атомов в пространстве.










 -Сl -Вr -I; -ОН, -NH 2 , -CF 3 , -ССl 3 и т д.; б) катионные заместители: в) группы с семиполярными связями: г) ненасыщенные и ароматические заместители: Группы, обладающие + I-эффектом, малочисленны. К ним относятся: а) алкильные остатки, обладающие слабым + I-эффектом: б) анионные заместители, обладающие сильным +I-эффектом : " width="640"
-Сl -Вr -I; -ОН, -NH 2 , -CF 3 , -ССl 3 и т д.; б) катионные заместители: в) группы с семиполярными связями: г) ненасыщенные и ароматические заместители: Группы, обладающие + I-эффектом, малочисленны. К ним относятся: а) алкильные остатки, обладающие слабым + I-эффектом: б) анионные заместители, обладающие сильным +I-эффектом : " width="640"


































