ЦИКЛОАЛКАНЫ
ЦИКЛОАЛКАНЫ
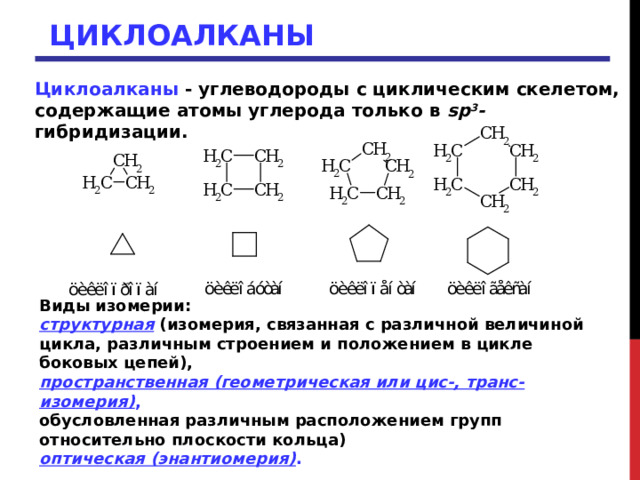
Циклоалканы - углеводороды с циклическим скелетом, содержащие атомы углерода только в sp 3 - гибридизации.
Виды изомерии:
структурная (изомерия, связанная с различной величиной цикла, различным строением и положением в цикле боковых цепей),
пространственная (геометрическая или цис-, транс-изомерия) ,
обусловленная различным расположением групп относительно плоскости кольца)
оптическая (энантиомерия) .
ЦИКЛОАЛКАНЫ
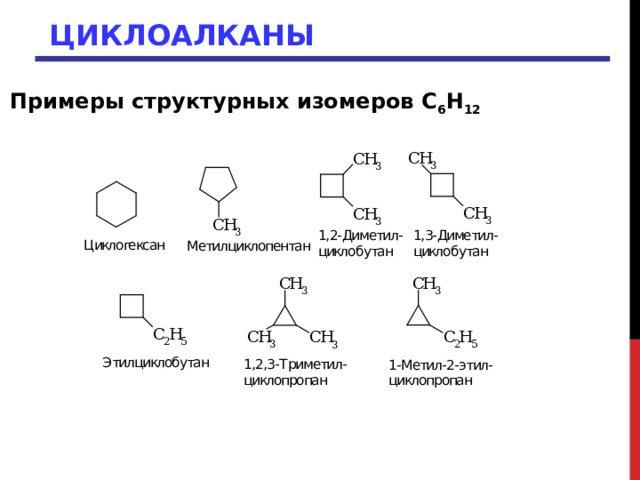
Примеры структурных изомеров C 6 H 12
ЦИКЛОАЛКАНЫ
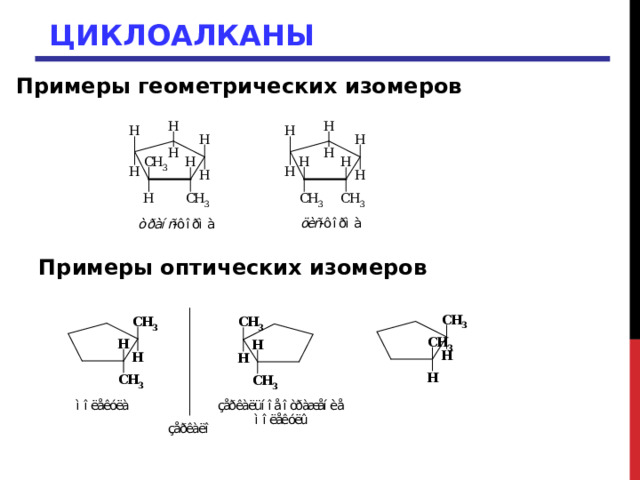
Примеры геометрических изомеров
Примеры оптических изомеров
ЦИКЛОАЛКАНЫ
Теория напряжения А. Байера
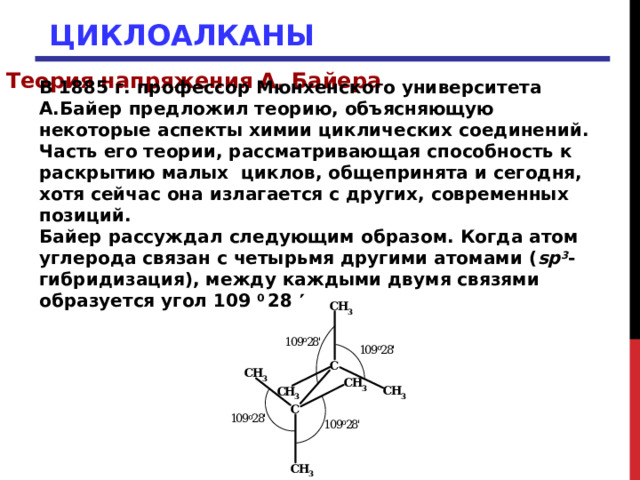
В 1885 г. профессор Мюнхенского университета А.Байер предложил теорию, объясняющую некоторые аспекты химии циклических соединений. Часть его теории, рассматривающая способность к раскрытию малых циклов, общепринята и сегодня, хотя сейчас она излагается с других, современных позиций.
Байер рассуждал следующим образом. Когда атом углерода связан с четырьмя другими атомами ( sp 3 -гибридизация), между каждыми двумя связями образуется угол 109 0 28
ЦИКЛОАЛКАНЫ
Теория напряжения А. Байера
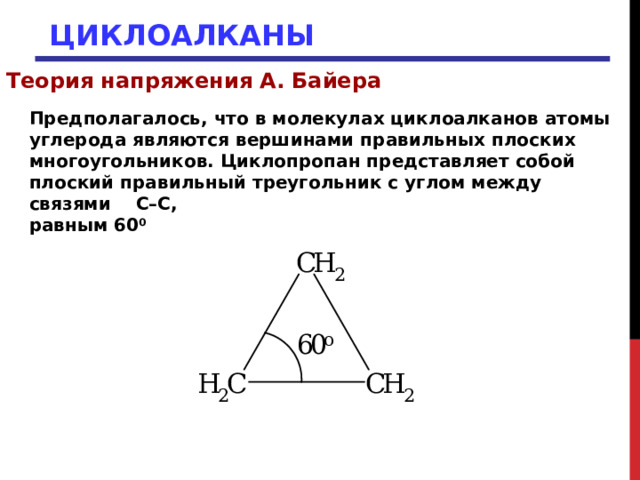
Предполагалось, что в молекулах циклоалканов атомы углерода являются вершинами правильных плоских многоугольников. Циклопропан представляет собой плоский правильный треугольник с углом между связями С–С,
равным 60 0
ЦИКЛОАЛКАНЫ
Теория напряжения А. Байера
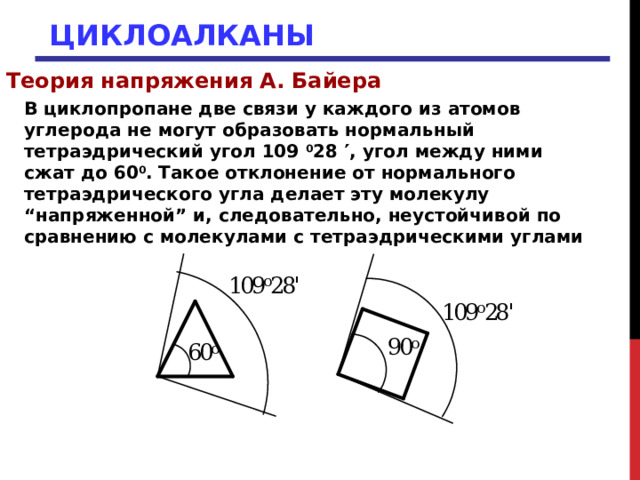
В циклопропане две связи у каждого из атомов углерода не могут образовать нормальный тетраэдрический угол 109 0 28 , угол между ними сжат до 60 0 . Такое отклонение от нормального тетраэдрического угла делает эту молекулу “напряженной” и, следовательно, неустойчивой по сравнению с молекулами с тетраэдрическими углами

ЦИКЛОАЛКАНЫ
Теория напряжения А. Байера
Циклоропан вступает в реакции с раскрытием кольца, поскольку при этом снимается угловое напряжение и образуются более устойчивые ациклические соединения. Чем больше отклонение от нормального угла 109 0 28 , тем более “напряженной” является молекула: для циклопропана отклонение составляет 1/2(109 0 28 - 60 0 )= 24 0 44 , а для плоского циклобутана -1/2(109 0 28 - 90 0 )= 9 0 44 .

ЦИКЛОАЛКАНЫ
Теория напряжения А. Байера
Поскольку искажение углов наиболее значительно в циклопропане, то он является более “напряженным”, более неустойчивым, более склонным к реакциям, протекающим с раскрытием кольца. Углы в правильном плоском пятиугольнике весьма близки к тетраэдрическим (108 о ), и поэтому циклопентан практически свободен от углового напряжения.
Углы в правильном плоском шестиугольнике (120 0 ) несколько превышают тетраэдрические, на основании чего Байер предположил (ошибочно), что в циклогексане должно быть некоторое напряжение, а при переходе к циклогептану, циклооктану и т. д. отклонения от угла 109 0 28 будут увеличиваться, вследствие этого молекулы будут становиться все более напряженными
ЦИКЛОАЛКАНЫ
Теория напряжения А. Байера
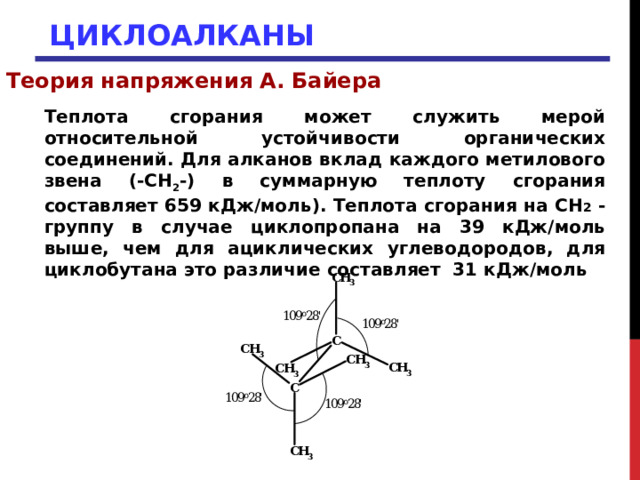
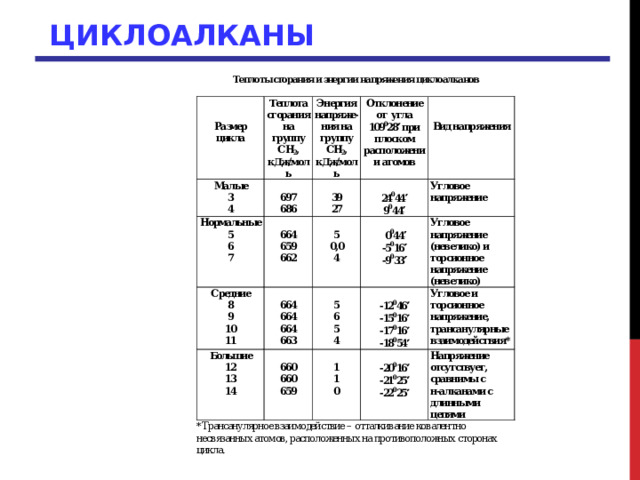
Теплота сгорания может служить мерой относительной устойчивости органических соединений. Для алканов вклад каждого метилового звена (-СН 2 -) в суммарную теплоту сгорания составляет 659 кДж/моль). Теплота сгорания на СН 2 - группу в случае циклопропана на 39 кДж/моль выше, чем для ациклических углеводородов, для циклобутана это различие составляет 31 кДж/моль
ЦИКЛОАЛКАНЫ
Теплота сгорания на группу СН 2 ,
Энергия напряже-ния на группу СН 2 ,
Отклонение от угла 109 0 28 при плоском расположении атомов
24 0 44
9 0 44
0 0 44
-5 0 16
-12 0 46
-15 0 16
-9 0 33
-20 0 16
-21 0 25
-17 0 16
-18 0 54
-22 0 25

ЦИКЛОАЛКАНЫ
Теория напряжения А. Байера
Что же неверно в теории Байера? Только одно: Байер считал, что кольцо является плоским, но только трехчленный цикл должен быть плоским. Циклы, содержащие большее число атомов углерода, не обладают плоской конфигурацией.
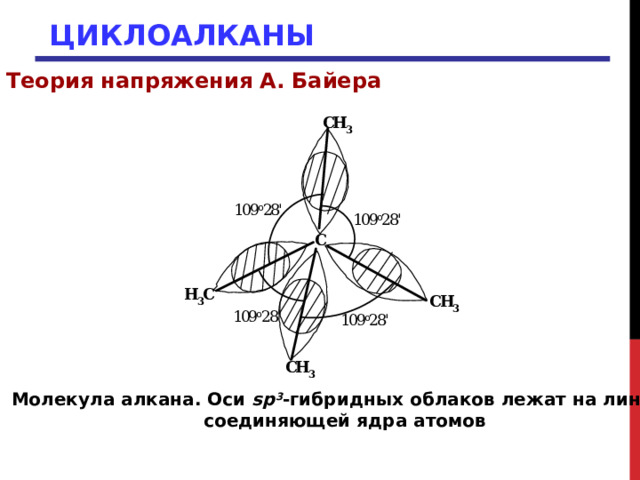
Что же означает угловое напряжение с позиций современной теории? Для образования связей необходимо такое расположение атомов, при котором орбитали одного атома перекрывались бы с орбиталями другого атома. Чем больше такое перекрывание, тем прочнее связь. Когда углерод связан с четырьмя другими одинаковыми атомами, его sp 3 -гибридные орбитали направлены к углам тетраэдра. Образование связи происходит в результате перекрывания его sp 3 -орбитали с аналогичной sp 3 -орбиталью другого атома. Такое перекрывание наиболее эффективно и связь наиболее прочна, если два атома расположены так, что оси этих sp 3 -гибридных орбиталей лежат на прямой, соединяющей ядра атомов. В этом случае угол между углерод-углеродными связями С-С-С должен составлять 109 0 28
ЦИКЛОАЛКАНЫ
Теория напряжения А. Байера
Молекула алкана. Оси sp 3 -гибридных облаков лежат на линии,
соединяющей ядра атомов

ЦИКЛОАЛКАНЫ
Теория напряжения А. Байера
С позиций современной теории следует, что на устойчивость конформации влияют следующие факторы:
- Отклонение от нормального угла сопровождается возникновением углового напряжения;
2) Любое этановое звено циклической молекулы стремиться принять заторможенную конформацию, отклонение от этого расположения сопровождается возникновением торсионного напряжения (напряжение Питцера, напряжение заслоненных связей);
3) Если атомы сближаются на расстояние, меньшее суммы их вандерваальсовых радиусов, то они отталкиваются друг от друга, появляется трансаннулярное напряжение (напряжение Прелога)
ЦИКЛОАЛКАНЫ
Циклопропан
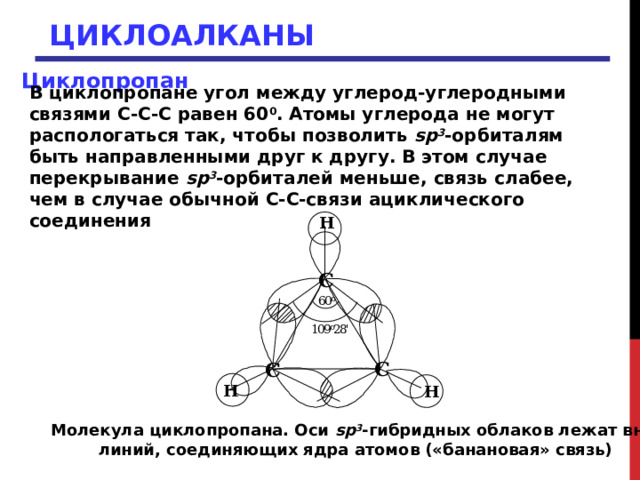
В циклопропане угол между углерод-углеродными связями С-С-С равен 60 0 . Атомы углерода не могут распологаться так, чтобы позволить sp 3 -орбиталям быть направленными друг к другу. В этом случае перекрывание sp 3 -орбиталей меньше, связь слабее, чем в случае обычной С-С-связи ациклического соединения
Молекула циклопропана. Оси sp 3 -гибридных облаков лежат вне
линий, соединяющих ядра атомов («банановая» связь)
ЦИКЛОАЛКАНЫ
Циклобутан
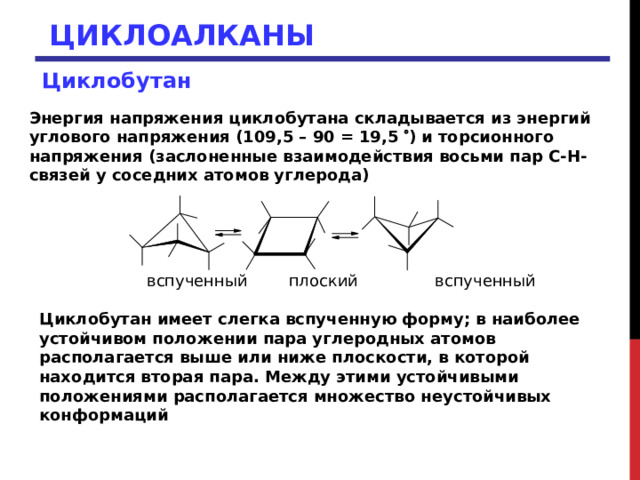
Энергия напряжения циклобутана складывается из энергий углового напряжения (109,5 – 90 = 19,5 ) и торсионного напряжения (заслоненные взаимодействия восьми пар С-Н-связей у соседних атомов углерода)
вспученный плоский вспученный
Циклобутан имеет слегка вспученную форму; в наиболее устойчивом положении пара углеродных атомов располагается выше или ниже плоскости, в которой находится вторая пара. Между этими устойчивыми положениями располагается множество неустойчивых конформаций

ЦИКЛОАЛКАНЫ
Циклопентан
В отличие от циклопропана и циклобутана в циклопентане почти нет угловых искажений. В плоском циклопентане все углы должны быть равны 108 º, что очень близко к нормальному значению. Таким образом, в плоской молекуле циклопентана не должно быть байеровского напряжения. Однако в молекуле должно быть не менее пяти взаимодействий за счет этановых фрагментов, находящихся в положении заслонения.
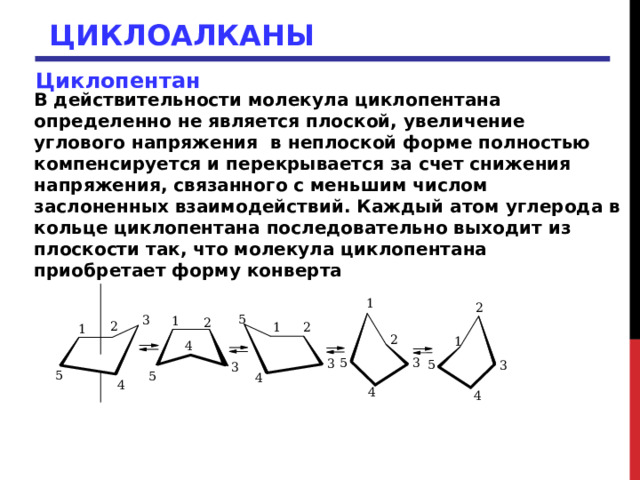
ЦИКЛОАЛКАНЫ
Циклопентан
В действительности молекула циклопентана определенно не является плоской, увеличение углового напряжения в неплоской форме полностью компенсируется и перекрывается за счет снижения напряжения, связанного с меньшим числом заслоненных взаимодействий. Каждый атом углерода в кольце циклопентана последовательно выходит из плоскости так, что молекула циклопентана приобретает форму конверта
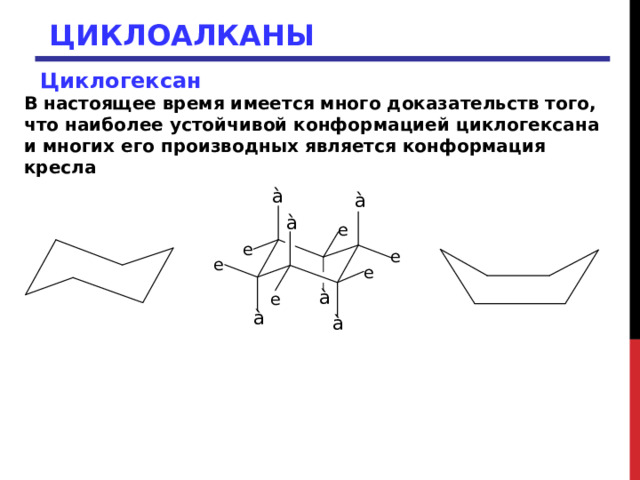
ЦИКЛОАЛКАНЫ
Циклогексан
В настоящее время имеется много доказательств того, что наиболее устойчивой конформацией циклогексана и многих его производных является конформация кресла
ЦИКЛОАЛКАНЫ
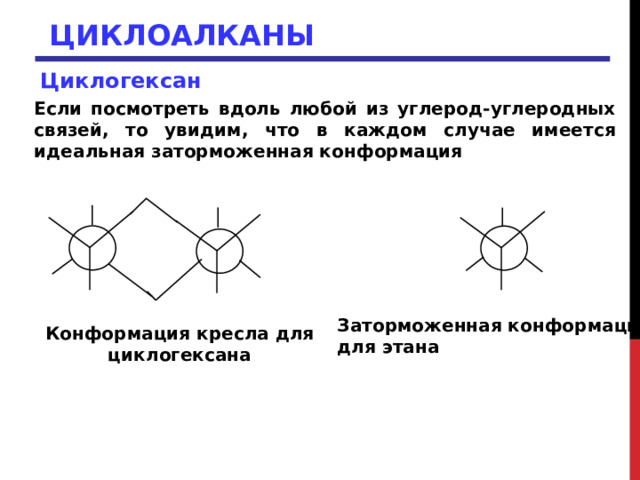
Циклогексан
Если посмотреть вдоль любой из углерод-углеродных связей, то увидим, что в каждом случае имеется идеальная заторможенная конформация
Заторможенная конформация
для этана
Конформация кресла для
циклогексана

ЦИКЛОАЛКАНЫ
Циклогексан
Таким образом, эта конформация свободна не только от углового, но также и от торсионного напряжения. Она имеет минимальный запас энергии и поэтому является конформационным изомером. Форма кресла – наиболее устойчивая конформация для циклогексана и почти всех его производных. Из этой конформации вытекает существование двух типов связей углерод-водород. Конформация кресла имеет простую ось симметрии третьего порядка. Шесть связей С-Н примерно параллельны этой оси: три направлены вверх, а три вниз. Эти связи называют аксиальными. Остальные шесть С-Н связей почти перпендикулярны оси симметрии, их называют экваториальными.
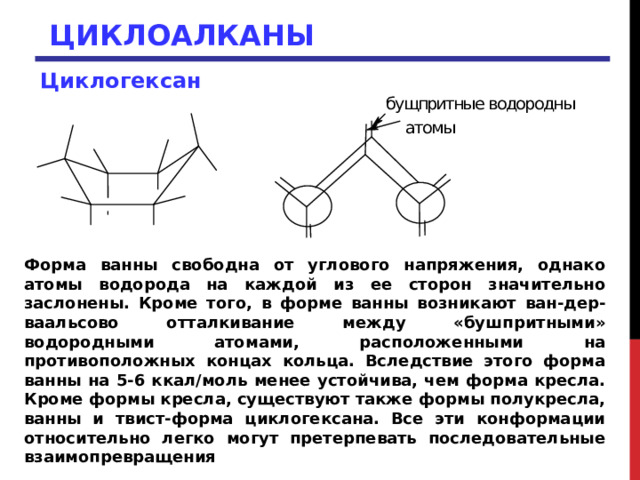
ЦИКЛОАЛКАНЫ
Циклогексан
Форма ванны свободна от углового напряжения, однако атомы водорода на каждой из ее сторон значительно заслонены. Кроме того, в форме ванны возникают ван-дер-ваальсово отталкивание между «бушпритными» водородными атомами, расположенными на противоположных концах кольца. Вследствие этого форма ванны на 5-6 ккал/моль менее устойчива, чем форма кресла. Кроме формы кресла, существуют также формы полукресла, ванны и твист-форма циклогексана. Все эти конформации относительно легко могут претерпевать последовательные взаимопревращения
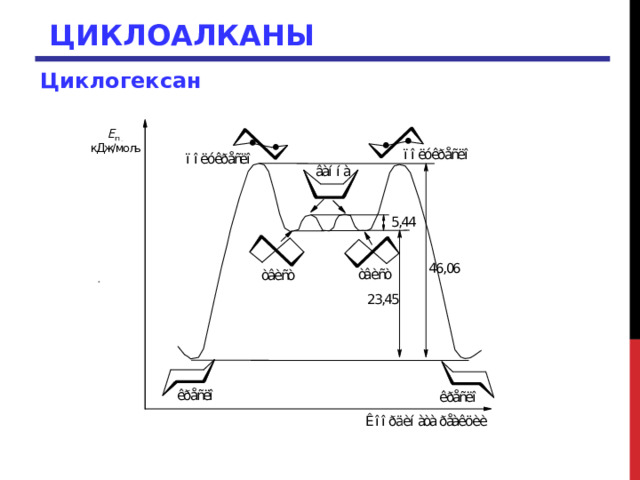
ЦИКЛОАЛКАНЫ
Циклогексан

ЦИКЛОАЛКАНЫ
Химические свойства
Химические свойства циклоалканов во многом совпадают со свойствами алканов. Для них характерны, прежде всего, реакции радикального замещения.
Помимо реакций свободнорадикального замещения, характерных для циклоалканов, циклопропан и циклобутан вступают в некоторые реакции присоединения с раскрытием кольца
ЦИКЛОАЛКАНЫ
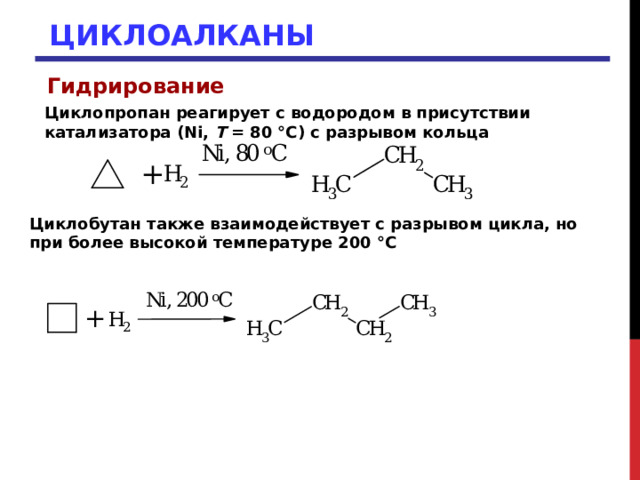
Гидрирование
Циклопропан реагирует с водородом в присутствии катализатора (Ni, T = 80 °С) с разрывом кольца
Циклобутан также взаимодействует с разрывом цикла, но при более высокой температуре 200 °С
ЦИКЛОАЛКАНЫ
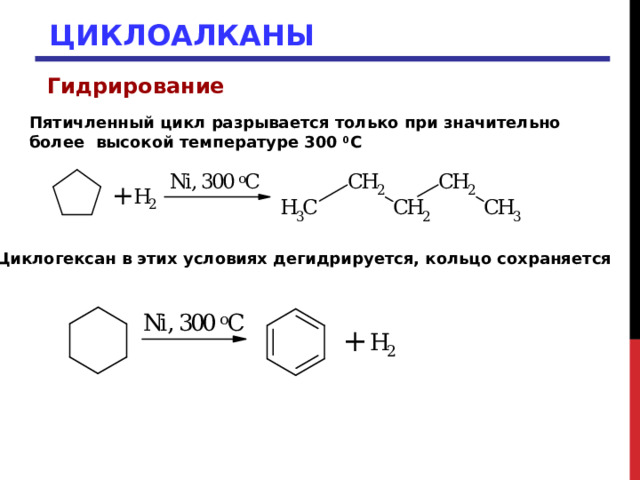
Гидрирование
Пятичленный цикл разрывается только при значительно более высокой температуре 300 0 С
Циклогексан в этих условиях дегидрируется, кольцо сохраняется
ЦИКЛОАЛКАНЫ
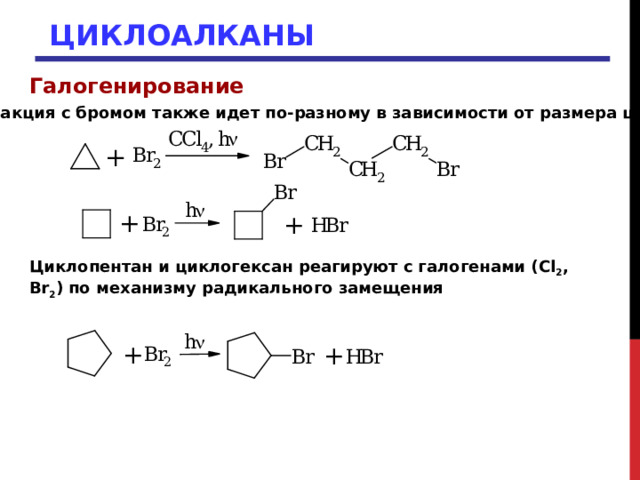
Галогенирование
Реакция с бромом также идет по-разному в зависимости от размера цикла
Циклопентан и циклогексан реагируют с галогенами ( Cl 2 , Br 2 ) по механизму радикального замещения

ЦИКЛОАЛКАНЫ
Гидрогалогенирование
Циклопропан взаимодействует с иодоводородом, как ненасыщенное соединение - просоединяет галогеноводород, при этом происходит раскрытие цикла
Остальные циклопарафины с галогеноводородами не реагируют .
В реакциях циклоалканов проявляется различие в свойствах малых циклов и пяти-, шестичленных циклов. Циклопропан, а также циклобутан (в меньшей степени) вступают в реакции присоединения , проявляя свойства ненасыщенных соединений

ЦИКЛОАЛКАНЫ
Методы синтеза
Процесс получения циклических алифатических углеводородов из других алифатических соединений в общем виде состоит из двух стадий: а) превращение какого-либо соединения, содержащего открытую цепь, в циклическое соединение – реакция циклизации, б) превращение циклического соединения в требуемый продукт, например циклического спирта в циклоалкан или циклоалкена в циклоалкан
ЦИКЛОАЛКАНЫ
Методы синтеза
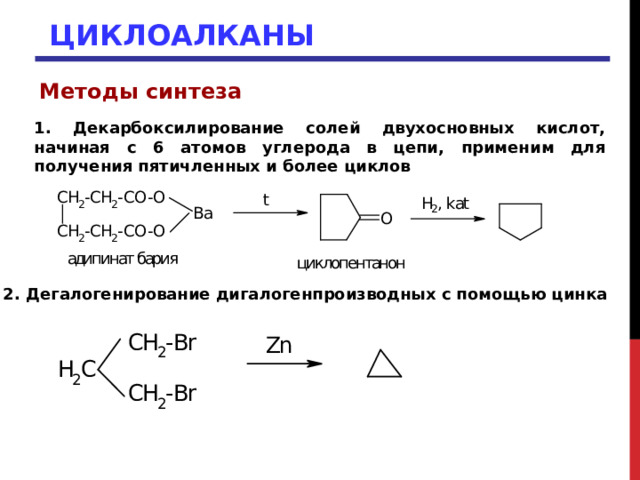
1. Декарбоксилирование солей двухосновных кислот, начиная с 6 атомов углерода в цепи, применим для получения пятичленных и более циклов
2. Дегалогенирование дигалогенпроизводных с помощью цинка
ЦИКЛОАЛКАНЫ
Методы синтеза
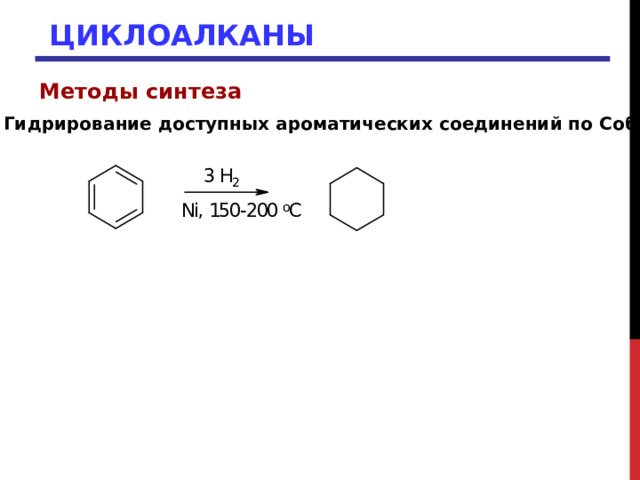
3. Гидрирование доступных ароматических соединений по Собатье
ЦИКЛОАЛКАНЫ
Методы синтеза
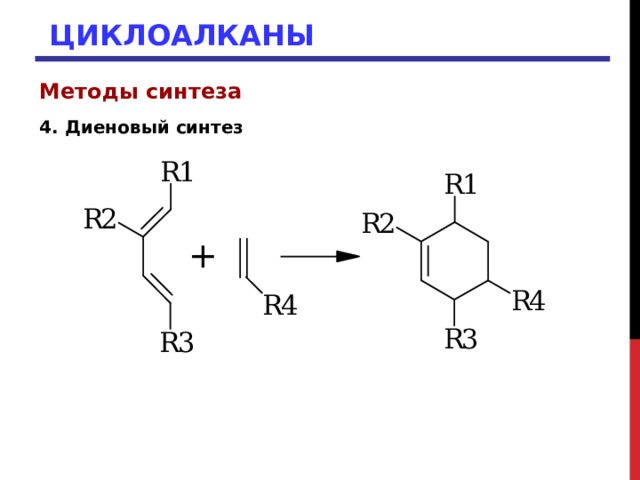
4. Диеновый синтез















































