Урок изучения новых знаний
Тема: «ОКСИДЫ и их классификация»
Химия 8 класс
Физика МКОУ «Уралинская СОШ»
Математика
Информатика 11.02.2021г.

Химия как наука – 8 кл. должны знать и уметь:
Мы уже должны знать:
Что изучает химия ?
Что такое вещество ?
Что такое тело ?
Что такое химический элемент?
Химический знак?
Химическая формула?
Химическое явление?
Химическое уравнение?
Мы должны уметь:
Написать химические знаки, формулы, уравнения, найти атомную, молекулярную массу веществ.
Найти массовую долю элемента в веществе, массовую доли вещества в растворе.
Что такое раствор?
Что такое смесь?
Какие бывают разделение смесей?
Приготовить смесь или раствор по заданной концентрации.
Дать определение понятий:
количество вещества, моль,
молярная масса,
число Авогадро,
молярный объем,
закон Авогадро;
вычисления задач
с данными величинами

Массовая доля вещества в растворе (процентная концентрация)

Концентрация растворов

Массовая доля вещества в растворе:
- - массовая доля вещества в растворе

Количество вещества
Каждый день мы употребляем сахар, например, когда пьем чай. Но вы когда – нибудь задумывались:
Какое количество сахарозы вы получаете вместе с чаем?

Приготовление раствора
Рассчитайте массу твёрдого вещества и воды, необходимых для приготовления раствора.
Зная, что плотность воды равна 1 г/мл, рассчитайте объём воды, необходимый для приготовления раствора.
Взвесьте твёрдое вещество в соответствии с рассчитанной массой и перенесите в химический стакан.
Мерным цилиндром отмерьте вычисленный объём воды и прилейте его к веществу в химическом стакане.
Перемешивая содержимое стакана стеклянной палочкой, добейтесь полного растворения вещества в воде.



Давайте напишем уравнение реакции
1; 4 P + 5O 2 → 2P 2 O 5
2;
O
Тема нашего урока: «ОКСИДЫ»
Классификация оксидов основывается на их химических свойствах и агрегатном состоянии.
Оксиды — это?

O
Оксиды — это сложные вещества, состоящие из двух химических элементов, один из которых кислород в степени окисления –2.

Оксид кремния( IV )
SiO 2
- Горный хрусталь, кварц, аметист, яшма, агат, авантюрин, халцедон, цитрин, сердолик — всё это оксид кремния ( IV ).
Горный хрусталь
Агат
Сердолик

Оксид алюминия
Al 2 O 3
Рубин
- Корунд (глинозем) – по твердости не уступает алмазу
- Чистый корунд – бесцветен
- Рубин, сапфир, корунд – всё это оксид алюминия.
Рубин
Сапфир

Оксид алюминия Al 2 O 3 + оксид кремния SiO 2
- Глина – это мельчайшие кристаллы минерала каолинита
- Состав:
оксид кремния ( IV ) – 47%
оксид алюминия – 39%
вода (оксид водорода) – 14%
- В зависимости от состава и добавок, глина имеет разный цвет.

Физические свойства оксидов
Цвет
Бесцветный
Чёрный
Красный
Белый
Зеленый

Оксиды в природе:
SiO 2 – кварцевый песок, кремнезём
горный хрусталь
Окрашенный различными примесями, образует драгоценные и полудрагоценные камни :
яшма
аметист
агат

Оксиды в природе:
Al 2 O 3 ∙ 2 SiO 2 ∙2Н 2 О -
белая глина
Н 2 О
вода,
оксид водорода
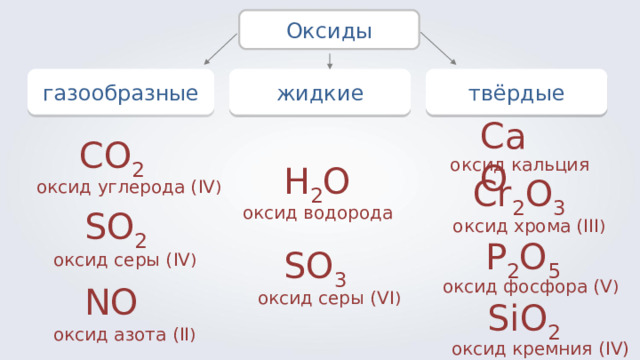
Оксиды
газообразные
жидкие
твёрдые
CaO
CO 2
оксид кальция
H 2 O
Cr 2 O 3
оксид углерода ( IV )
оксид водорода
SO 2
оксид хрома ( III )
P 2 O 5
SO 3
оксид серы ( IV )
оксид фосфора ( V )
NO
оксид серы ( VI )
SiO 2
оксид азота ( II )
оксид кремния ( IV)
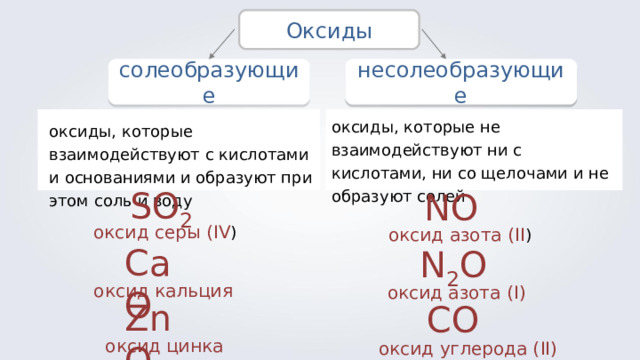
Оксиды
солеобразующие
несолеобразующие
оксиды, которые не взаимодействуют ни с кислотами, ни со щелочами и не образуют солей
оксиды, которые взаимодействуют с кислотами и основаниями и образуют при этом соль и воду
SO 2
NO
оксид серы ( IV )
оксид азота ( II )
CaO
N 2 O
оксид кальция
оксид азота ( I)
ZnO
CO
оксид цинка
оксид углерода ( II)
20
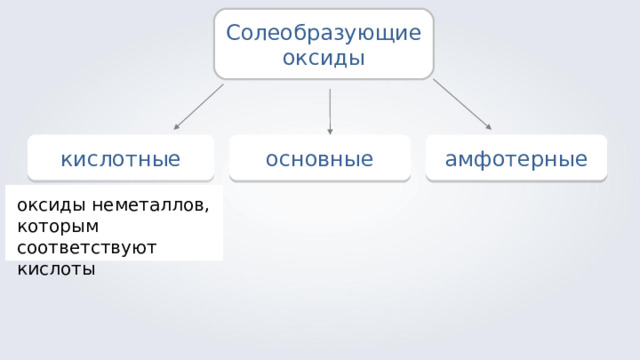
Солеобразующие оксиды
кислотные
основные
амфотерные
оксиды неметаллов, которым соответствуют кислоты
20

Кислотные оксиды
H 2 SO 3
SO 2
оксид серы ( IV )
сернистая кислота
—
P 2 O 5
H 3 PO 4
—
оксид фосфора ( V )
фосфорная кислота
SiO 2
H 2 SiO 3
оксид кремния ( IV )
—
кремниевая кислота
N 2 O 3
HNO 2
оксид азота ( III )
—
азотистая кислота
N 2 O 5
HNO 3
оксид азота ( V )
—
азотная кислота
Кислотные оксиды — оксиды неметаллов, которым соответствуют кислоты.

—
—
Кислотные оксиды
SO 3
H 2 SO 4
оксид серы ( VI )
—
серная кислота
CO 2
H 2 CO 3
оксид углерода ( IV )
—
угольная кислота
H 2 CrO 4
хромовая кислота
CrO 3
оксид хрома ( VI )
H 2 Cr 2 O 7
дихромовая кислота
Mn 2 O 7
HMnO 4
—
оксид марганца ( VII )
марганцевая кислота
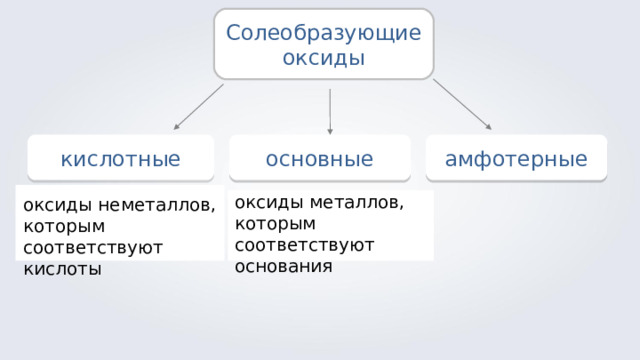
Солеобразующие оксиды
кислотные
основные
амфотерные
оксиды металлов, которым соответствуют основания
оксиды неметаллов, которым соответствуют кислоты
20

Основные оксиды
Основные оксиды содержат в своём составе металлы в степени окисления +1 и +2 и являются твёрдыми веществами.
CaO
Ca(OH) 2
оксид кальция
гидроксид кальция
—
Na 2 O
NaOH
—
оксид натрия
гидроксид натрия
MgO
Mg(OH) 2
оксид магния
гидроксид магния
—
BaO
Ba(OH) 2
оксид бария
гидроксид бария
—
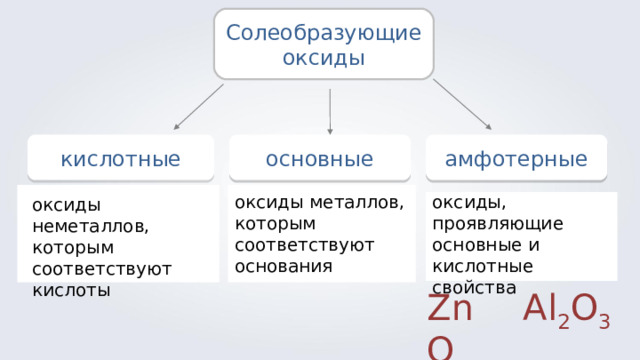
Солеобразующие оксиды
кислотные
основные
амфотерные
оксиды, проявляющие основные и кислотные свойства
оксиды металлов, которым соответствуют основания
оксиды неметаллов, которым соответствуют кислоты
ZnO
Al 2 O 3
20
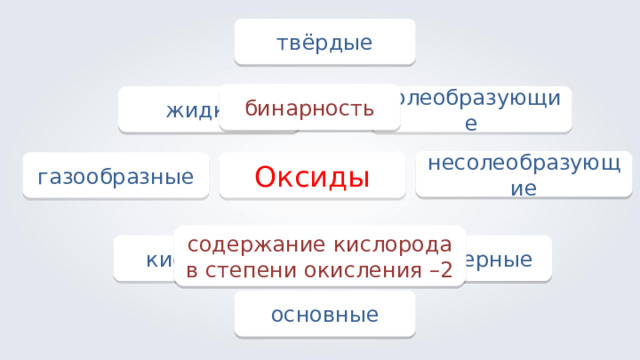
твёрдые
бинарность
жидкие
солеобразующие
несолеобразующие
Оксиды
газообразные
содержание кислорода в степени окисления –2
кислотные
амфотерные
основные
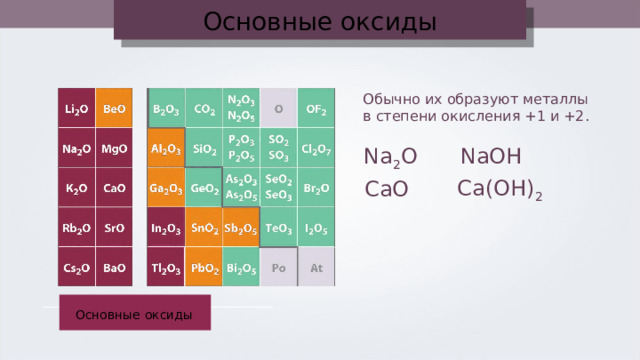
Основные оксиды
Обычно их образуют металлы
в степени окисления +1 и +2.
Na 2 O
NaOH
Са(ОН) 2
CaO
Основные оксиды

Кислотные оксиды
Их образуют неметаллы
и металлы в высоких степенях окисления.
P 2 O 5
Н 3 РО 4
Кислотные оксиды

Амфотерные оксиды
Амфотерные оксиды
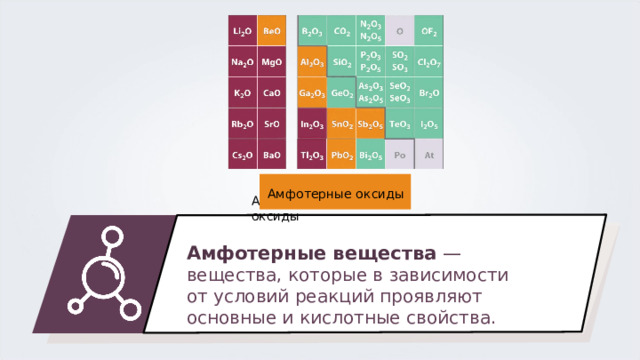
Амфотерные оксиды
Амфотерные оксиды
Амфотерные вещества — вещества, которые в зависимости от условий реакций проявляют основные и кислотные свойства.





Домашнее задание:






























































