7 класс химия дата проведения_____________
Тема урока: Соли. Состав и химические свойства солей.
Цель урока: Сформировать представление о солях как об основном классе неорганических соединений, обобщить знания о физических свойствах, составе и химических свойствах солей
Тип урока: комбинированный
Ход урока
I. Организационный момент урока
– Здравствуйте. Присаживайтесь. Дежурные, назовите отсутствующих. Все ли готовы к уроку? Что было сложным при выполнении домашнего задания?
II. Актуализация знаний учащихся
Химическая разминка « Что мы знаем о солях?»
Вопрос №1: Установите соответствие название солей: сульфаты, сульфиты, карбонаты, фосфаты, нитраты, силикаты.
кислотам соответствуют соли:
H2CO3 -карбонаты,
H3PO4- фосфаты,
H2SO4-сульфаты,
H2SiO3-силикаты,
H2SO3-сульфиты
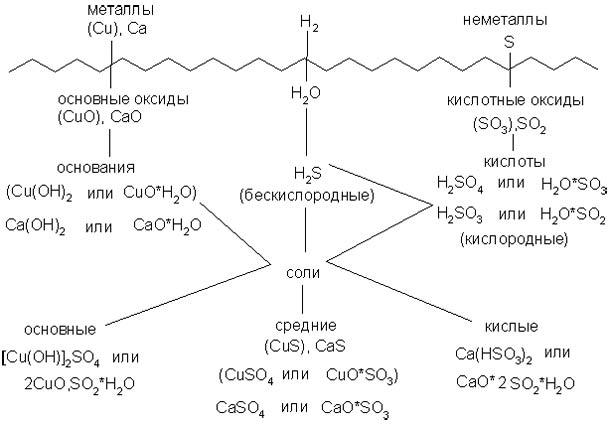
Изучение нового материала. Сообщение темы и целей урока:
Соли:
—состав и классификация солей
—химические свойства солей: взаимодействие с металлами, кислотами, щелочами, солями
—получение солей
—соли в природе и повседневной жизни человека
—экологические проблемы добычи и переработки солей
Темой нашего урока будут соли. Сегодня на уроке повторим составление формул солей, их названия, практическое применение некоторых из них
Соли - сложные вещества, которые состоят из атомов металла и кислотных остатков. Это наиболее многочисленный класс неорганических соединений.
Классификация
| СОЛИ |
|
| Средние |
| Кислые |
| Основные |
| Двойные |
| Смешанные |
| Комплексные |
Средние. При диссоциации дают только катионы металла (или NH4+)
Na2SO4 « 2Na+ +SO42-
CaCl2 « Ca2+ + 2Cl-
Кислые. При диссоциации дают катионы металла (NH4+), ионы водорода и анионы кислотного остатка.
NaHCO3 « Na+ + HCO3- « Na+ + H+ + CO32-
Продукты неполного замещения атомов водорода многоосновной кислоты на атомы металла.
Основные. При диссоциации дают катионы металла, анионы гидроксила и кислотного остатка.
Zn(OH)Cl « [Zn(OH)]+ + Cl- « Zn2+ + OH- + Cl-
Продукты неполного замещения групп OH соответствующего основания на кислотные остатки.
Двойные. При диссоциации дают два катиона и один анион.
KAl(SO4)2 « K+ + Al3+ + 2SO42-
Смешанные. Образованы одним катионом и двумя анионами:
CaOCl2 « Ca2+ + Cl- + OCl-
Комплексные. Содержат сложные катионы или анионы.
Средние соли Получение Большинство способов получения солей основано на взаимодействии веществ с противоположными свойствами:
металла с неметаллом: 2Na + Cl2 ® 2NaCl
металла с кислотой: Zn + 2HCl ® ZnCl2 + H2
металла с раствором соли менее активного металла Fe + CuSO4 ® FeSO4 + Cu
основного оксида с кислотным оксидом: MgO + CO2 ® MgCO3
основного оксида с кислотой CuO + H2SO4 –t°® CuSO4 + H2O
основания с кислотным оксидом Ba(OH)2 + CO2 ® BaCO3¯ + H2O
основания с кислотой: Ca(OH)2 + 2HCl ® CaCl2 + 2H2O
соли с кислотой:
MgCO3 + 2HCl ® MgCl2 + H2O + CO2
BaCl2 + H2SO4 ® BaSO4¯ + 2HCl
раствора основания с раствором соли: Ba(OH)2 + Na2SO4 ® 2NaOH + BaSO4¯
растворов двух солей 3CaCl2 + 2Na3PO4 ® Ca3(PO4)2¯ + 6NaCl
Химические свойства
Термическое разложение.
CaCO3 ® CaO + CO2
2Cu(NO3)2 ® 2CuO + 4NO2 + O2
NH4Cl ® NH3 + HCl
Гидролиз.
Al2S3 + 6H2O « 2Al(OH)3¯ + 3H2S
FeCl3 + H2O « Fe(OH)Cl2 + HCl
Na2S + H2O « NaHS +NaOH
Обменные реакции с кислотами, основаниями и другими солями.
AgNO3 + HCl ® AgCl¯ + HNO3
Fe(NO3)3 + 3NaOH ® Fe(OH)3¯ + 3NaNO3
CaCl2 + Na2SiO3 ® CaSiO3¯ + 2NaCl
Окислительно-восстановительные реакции, обусловленные свойствами катиона или аниона.
2KMnO4 + 16HCl ® 2MnCl2 + 2KCl + 5Cl2 + 8H2O
Химические свойства.
Термическое разложение с образованием средней соли
Ca(HCO3)2 ® CaCO3¯ + CO2 + H2O
Взаимодействие со щёлочью. Получение средней соли.
Ba(HCO3)2 + Ba(OH)2 ® 2BaCO3¯ + 2H2O
Закрепление. Выполнение Лаб. on. 9. Взаимодействие солей с металлами
Подведение итогов. Беседа по вопросам.
1. Что повторили на уроке?
2. Что нового изучили на уроке?
3.Понравился ли вам урок и почему?
Домашнее задание:
§41 Задания 3, 5, 7, 8-10
2





























