Тема. Алканы. Строение молекулы метана. Понятие о гибридизации атома углерода, sp3-гибридизация. Гомологический ряд алканов. Изомерия алканов. Международная систематическая номенклатура алканов. Физические свойства алканов.
Цели: - сформировать у учащихся понятие алканы;
- изучить особенности строения молекулы метана, понятие о гибридизации атома углерода sp3-гибридизация;
- изучить гомологический ряд алканов, их изомерию и систематическую номенклатуру;
- разобрать физические свойства алканов.
Тип урока: изучение нового материала
Ход урока:
Организационный момент.
Изучение нового материала.
Углеводороды – простейшие органические соединения, состоящие из двух элементов: углерода и водорода.
Алканы или предельные углеводороды – соединения, состав которых выражается общей формулой CnH2n+2, где n – число атомов углерода.
В молекулах предельных углеводородов атомы углерода связаны между собой простой (одинарной) связью, а все остальные валентности насыщены атомами водорода. Алканы называют так же насыщенными углеводородами или парафинами.
Первым членом гомологического ряда алканов является метан – CH4. Окончание -ан является характерным для названий предельных углеводородов. Далее следует этан – C2H6, пропан- C3H8 , бутан- C4H10. Начиная с пятого углеводорода, название образуется из греческого числительного, указывающего число углеродных атомов в молекуле, и окончания –ан. Это пентан- C5H12, гексан- C6H14, гептан- C7H16, октан- C8H18, нонан- C9H20, декан- C10H22 и т.д.
Алканы, начиная с 4го члена ряда (бутана), имеют изомеры.
Все алканы насыщены водородом до предела(максимально). Их атомы углерода находятся в состоянии sp3-гибридизации, а значит, имеют простые (одинарные) связи.
Строение молекулы и свойства метана
Вопросы:
а) Какие формы электронных облаков знаете?
(шарообразные - s, гантелеобразные - p, крестообразные - d, и f - электронные облака).
б) Какие расположения в пространстве имеют s, p, d, f - орбитали?
(s - орбитали – 1 расположение(1 орбиталь), p – орбитали – 3 расположения (3 орбитали), d – орбитали – 5 расположений (5 орбиталей), f – орбитали – 7 расположений (7 орбиталей).
в) Как происходит заполнение электронами орбиталей?
(Сначала по одному, затем происходит спаривание электронов).
Молекула метана в действительности имеет форму тетраэдра. Тетраэдр – это пирамида, в основании которой лежит равносторонний треугольник. В центре тетраэдра находится атом углерода, а все его четыре валентности направлены к вершинам тетраэдра.
─Почему молекула метана имеет такую пространственную форму?
─Чем объясняется направление валентных связей атома углерода от центра к вершинам тетраэдра?
Ответ следует искать в электронном строении атома углерода и молекулы метана.
С 1S2 2S2 2P2 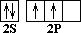 –– C * 1S2 2S1 2P3
–– C * 1S2 2S1 2P3 
(основное состояние) (возбужденное состояние)
Так как на втором энергетическом уровне Р-подуровне есть свободная орбиталь, то на неё переходит один из 2S2-электронов. В результате этого атом углерода в возбуждённом состоянии имеет четыре неспаренных электрона, т.е. становится четырёхвалентным.
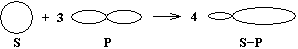
(негибридные эл. облака) (гибридные электронные облака)
Облака всех четырёх валентных электронов атома углерода выравниваются, становятся одинаковыми. При этом они принимают форму вытянутых в направлении к вершинам тетраэдра восьмёрок.
Явление, при котором происходит смешение и выравнивание по форме и энергии электронных облаков, называется гибридизацией.
Так как гибридизации подвергаются один S и три Р-электрона, то такое состояние называется SP3-гибридизацией.
Итак, молекула метана имеет тетраэдрическое строение, что обусловлено SP3-гибридизацией атома углерода, тетраэдрическим направлением четырёх гибридных электронных облаков атома углерода.
Номенклатура алканов и их производных
Названия первых десяти членов ряда предельных углеводородов уже даны. Чтобы подчеркнуть, что алкан имеет неразветвленную углеродную цепь, часто к названию добавляют слово нормальный (н-), например:
CH3─CH2─CH2─CH3 CH3─CH2─CH2─ CH3─CH2─CH2─CH3
н-бутан н-гептан
(нормальный бутан) (нормальный гептан)
При отрыве атома водорода от молекулы алкана образуются одновалентные частицы, называемые углеводородными радикалами (сокращенно называют буквой R). Названия одновалентных радикалов производятся от названий соответствующих с заменой окончаний –ан на –ил.
Гомологический ряд
Углеводородов Одновалентные радикалы
| Метан CH4 Этан C2H6 Пропан C3H8 Бутан C4H10 Пентан C5H12 | Гексан C6H14 Гептан C7H16 Октан C8H18 Нонан C9H20 Декан C10H22 | Метил CH3 ─ Этил C2H5 ─ Пропил C3H7 ─ Бутил C4H9 ─ Пентил C5H11 ─ | Гексил C6H13 ─ Гептил C7H15 ─ Октил C8H17 ─ Нонил C9H19 ─ Децил C10H21 ─ |
Гомологи - это вещества, сходные по строению и свойствам и отличающиеся на одну или более групп СH2.
Радикалы образуются не только органическими, но и неорганическими соединениями. Так, если от азотной кислоты отнять гидроксильную группу OH, то получится одновалентный радикал –NO2, называемый нитрогруппой и т.д.
При отнятии от молекулы углеводорода 2х атомов водорода получаются двухвалентные радикалы. Их названия также производятся от названий соответствующих предельных углеводородов с заменой окончания на –илен. (Например, радикал CH2 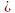 имеет название метилен). Названия радикалов используются в номенклатуре многих производных углеводородов. Например: CH3 I ─йодистый метил, C4H9Cl ─ хлористый бутил, CH2Cl2 ─хлористый метилен.
имеет название метилен). Названия радикалов используются в номенклатуре многих производных углеводородов. Например: CH3 I ─йодистый метил, C4H9Cl ─ хлористый бутил, CH2Cl2 ─хлористый метилен.
Для названий изомеров широко применяют международную систематическую номенклатуру (ИЮПАК). Согласно ей, основой для названия служит одна углеродная цеп, а всем др.. фрагменты в молекуле рассматриваются как заместители.
Для составления названия алканов по систематической номенклатуре нужно:
Выбрать самую длинную неразветвленную цепь углерода
Пронумеровать эту цепь таким образом, чтобы заместители, которые в молекулах углеводородов замещают атомы водорода, были ближе к началу цепи.
Указать цифрой место и название заместителя, затем название основной цепи с суффиксом –ан. Для этого нужно знать название радикалов (образуются при отщеплении атома водорода от атома углерода), которые образуются от названий соответствующих углеводородов, путём замены суффикса –ан на –ил.
Затем называют: 1)номер углеродного атома, 2)углеводород, котрому соответствует длинная цепь. Если в формуле содержится несколько одинаковых радикалов, то перед их название укзывают число прописью (ди-, три-, тетра-), а номера радикалов разделяют запятыми. Вот так по этой номенклатуре следует назвать изомеры гексана:
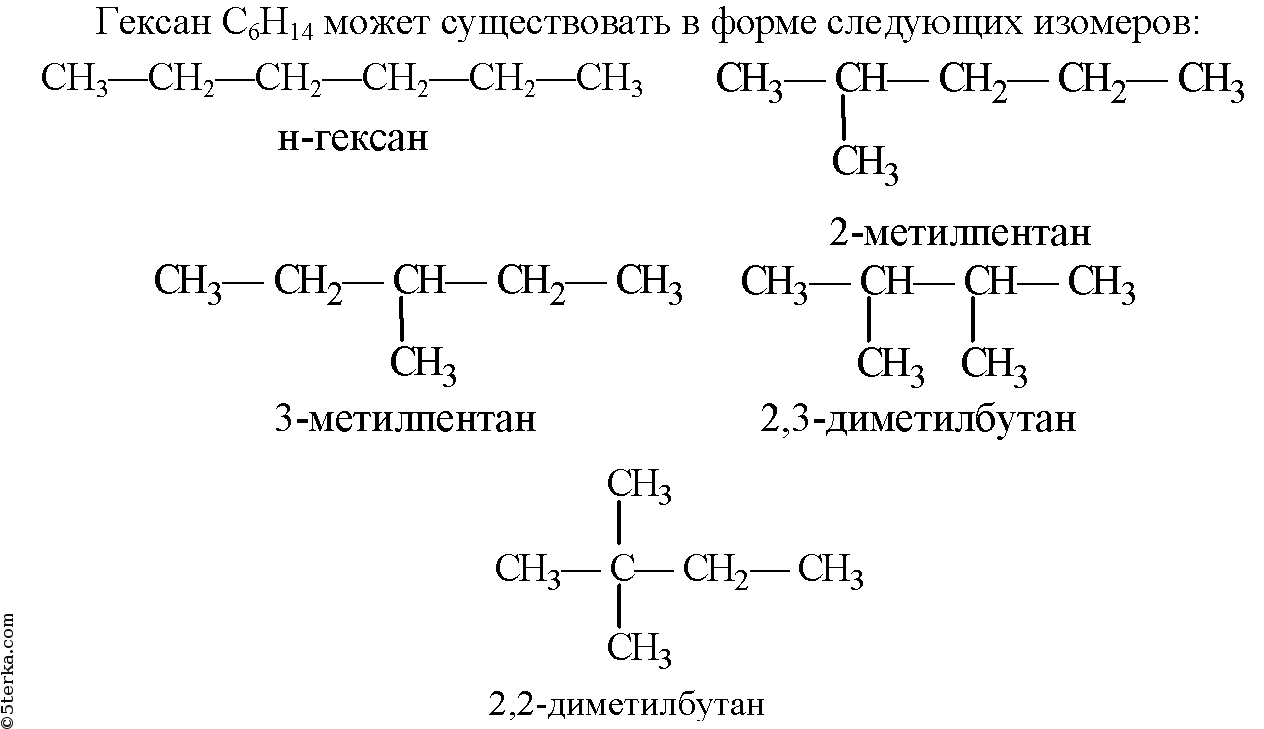
Физические свойства алканов.
Мы узнали состав, строение, номенклатуру алканов. Сейчас нам предстоит изучить физические свойства данного класса веществ.
1)Температуры плавления и кипения
С ростом числа атомов углерода в гомологическом ряду алканов возрастают:
температуры кипения;
температуры плавления;
плотность.
─При обычных условиях ( температура ≈ 22 С) первые 4 члена ряда ( метан, этан, пропан, бутан) – газы, с C5H12 до C16H34 – жидкости, а с C17H36- твердые вещества.
Так, например, при 20 °C н-пентан — жидкость, а неопентан — газ.
─Алканы с большим числом атомов углерода ( 15 ) — твёрдые легкоплавкие вещества без запаха.
─Все алканы практически не растворяются в воде.
2)МЕТАН – газ, без цвета и запаха, почти в 2 раза легче воздуха, мало растворим в воде. Он образуется в природе в результате разложения без доступа воздуха остатков растительных и животных организмов. Поэтому может быть обнаружен в заболоченных водоемах, где появляется в виде пузырьков газа, или накапливается в каменноугольных шахтах, куда выделяется из угольных пластов. В значительном количестве (80-97%) метан содержится в природном газе и в попутных нефтяных газах. Метан горит бледным синеватым пламенем.
3)ЭТАН, ПРОПАН И БУТАН входят в состав природного и попутного нефтяного газов. АЛКАНЫ содержатся в нефти. С ростом относительной молекулярной массы наблюдается переход количественных отношений в качественные: изменяется агрегатное состояние, возрастают температуры плавления и кипения.
3.Закрепление знаний
Напишите структурные формулы следующих веществ:
а) н – пентан; б) 2 – метилбутан; в) 2,4 – диметилпентан; г)2—метилгексан;
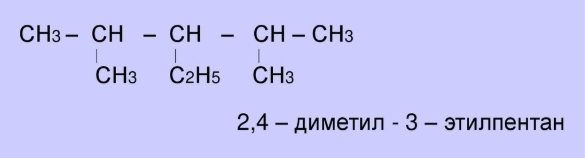
д) 3 – метил – 4 – этилгексан; у) триметилметан ; ж) 2,4 – диметил - 3 – этилпентана;
з) н – гептан
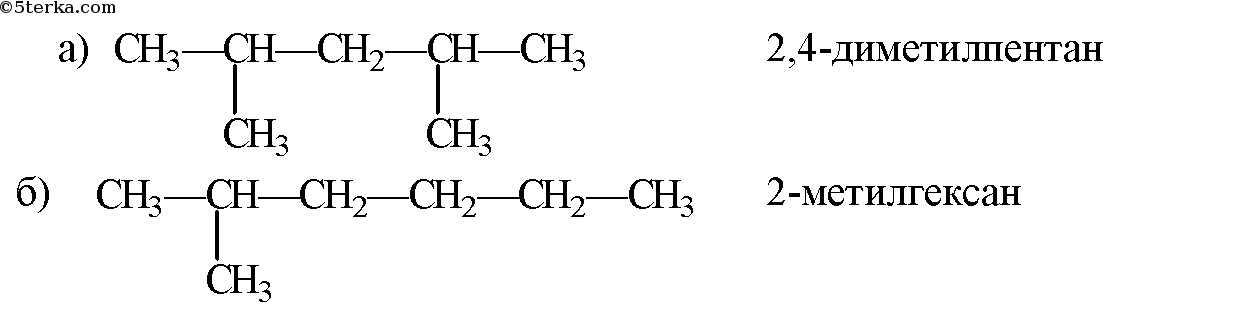
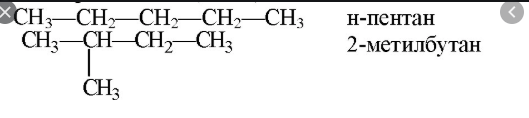
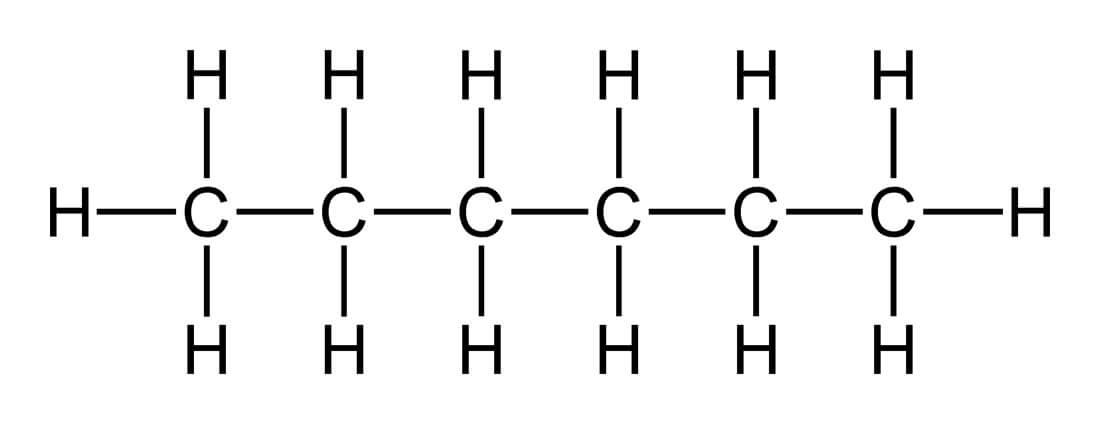
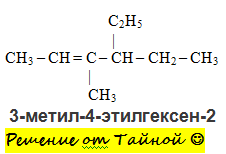
Н -гептан
-гептан
4.Домашняя работа
Выучить: общую формулу алканов, гомологический ряд, радикалы и их названия, схему составления изомеров и физ. св-ва.









 имеет название метилен). Названия радикалов используются в номенклатуре многих производных углеводородов. Например: CH3 I ─йодистый метил, C4H9Cl ─ хлористый бутил, CH2Cl2 ─хлористый метилен.
имеет название метилен). Названия радикалов используются в номенклатуре многих производных углеводородов. Например: CH3 I ─йодистый метил, C4H9Cl ─ хлористый бутил, CH2Cl2 ─хлористый метилен.
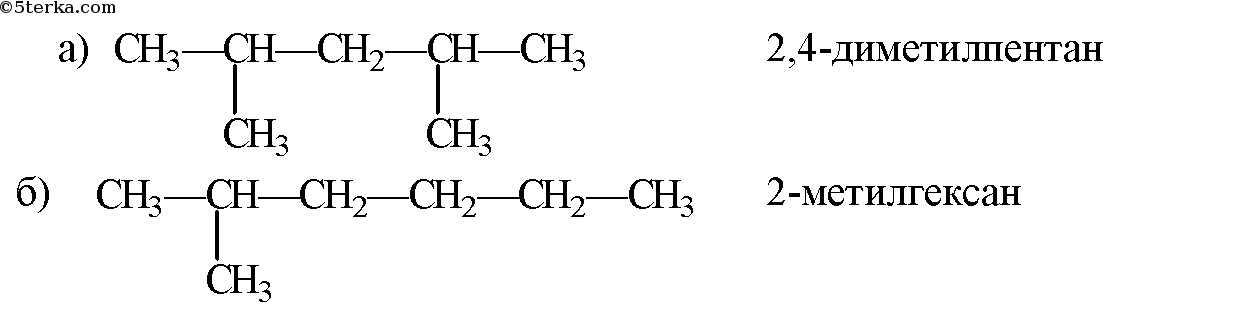
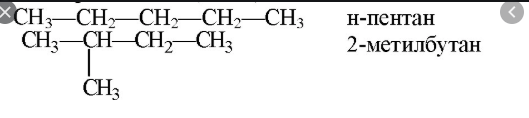


 -гептан
-гептан













