Муниципальное общеобразовательное учреждение
«Гадалейская средняя общеобразовательная школа»
Технологическая карта урока химии в 11 классе.
Учитель химии
Миронова Альбина Николаевна.
УМК: Рудзитис Г.Е., Фельдман Ф.Г. Химия. 11 класс: базовый уровень. Учебник. — М.: Просвещение, 2021.
Тема урока: Валентность и валентные возможности атомов.
Тип урока: Открытие нового знания.
Цели: Деятельностные: создание условий для усвоения учащимися темы урока, развитие мыслительных операций школьников, умения анализировать, систематизировать, делать общие выводы; развитие навыков самоконтроля.
Содержательные: Повторить и углубить знания учащихся о валентности и степени окисления атомов, познакомить с понятием валентные возможности атомов.
Технология: развитие критического мышления через чтение и письмо (приёмы «Фишбоун», «Метод активного чтения», «Инсерт»».
Оборудование: компьютер, проектор, мультимедийная презентация.
Формы организации учебной деятельности: парная, групповая, индивидуальная.
Организационная структура урока
| Стадия (фаза) | Деятельность учителя | Деятельность учащихся |
| Организационный момент | Проверяет готовность к уроку.
| Проверяют наличие принадлежностей необходимых для работы на уроке. |
| Психологическая подготовка к уроку. | Афоризм: «Доводы, до которых человек додумывается сам, обычно убеждают его больше, нежели те, которые пришли в голову другим» (Блез Паскаль, французский математик и физик, философ и писатель). | Обсуждение афоризма. |
-
1. Вызов | Прочитайте текст. Дополните недостающую информацию. В 19 веке ученые предположили, что атомы разных химических элементов обладают различной способностью присоединять к себе другие атомы. Так, было замечено, что атом водорода может присоединять лишь один атом другого химического элемента, кислород - два атома, азот - три. В настоящее время известно, что атомы, входящие в состав молекул, соединены между собой химическими связями в определенной последовательности. Чтобы показать это, используют ________, или ________ формулы, выражающие не только число атомов, но и последовательность их соединения. Химические связи между атомами в молекулах принято обозначать черточками. Число простых (одинарных ) связей, которые данный атом образует с другими атомами, называют ______________. Формулирование темы урока -
Напишите определение : валентность – это… -
Дополните схему примерами:   Валентность Валентность
Постоянная Переменная -
Определите валентность всех элементов в соединениях, подпишите валентность:
HCl, HNO3, H3РО4, H2SO4 -
Объясните, составьте алгоритм определения валентности и представьте его соседу по парте
|
Учащиеся работают с текстом. Извлекают необходимую информацию из прочитанного текста, систематизируют собственные знания. - повторение уже известного материала - осмысление материала - соотнесение материала с уже известной информацией Обсуждение результатов работы.
Самостоятельно определяют тему урока, формулируют цели, задачи. Записывают в тетради тему урока.
Самостоятельная актуализация имеющихся знаний по теме и пробуждение познавательной активности. Учащиеся включаются в ситуации самоконтроля, взаимоконтроля
|
| 2.Стадия осмысления
Метод активного чтения, Маркировка «Инсерт»: V знал; — думал по-другому; ? спросить учителя (непонятная информация); + новая информация; ! очень важно.
Толстый вопрос
Прием Фишбоун
Рефлексия | Задание: -
Обратитесь к учебнику ( дополнительным источникам информации)
Внимательно прочтите текст «Валентные возможности атома», «Периодические изменения валентности и размеров атомов» -
Ознакомьтесь с графическими формулами азота и фосфора, почему фосфор может быть в нескольких валентных состояниях -
Объясните на примере фосфора возможность образовывать разные валентности -
Напишите графическую формулу распределения электронов в атоме кремния, укажите варианты возможной валентности. -
Используя таблицу Менделеева, напишите как изменяется (увеличивается или уменьшается ) размер атомов во А) 2 группе ПСХЭ Б) 3 периоде ПСХЭ Чем отличается валентность от степени окисления?
В «голове» рыбы записывается вопрос. На первых «косточках», ближайших к голове, записываются понятия, которые нужно сравнить, на вторых – определения этих понятий. Понятие валентности рассматривается уже на более высоком уровне, с точки зрения образования ковалентных связей. На следующих «косточках» записывают примеры веществ и определяют валентности и степень окисления элементов данных соединениях. (Приложение 1. Задание группам. ) Учащимся предлагается на основании электронной конфигурации атома (и ее графического отображения) определить валентные возможности атома.
Тестовый контроль (Приложение 2.) | Работа с текстом учебника. Сохранение интереса к теме, постепенное продвижение от знания «старого» к «новому».
Ведут записи по мере осмысления новой информации.
Работа в парах. Осуществляют совместную деятельность в парах с учетом конкретных учебно-познавательных задач, умеют задавать вопросы для уточнения последовательности работы.
Работа в группах Делают вывод о том, в чем состоит отличие рассмотренных понятий. Этот вывод записывается в «хвосте» рыбы. (выступление у доски) Учащиеся соотносят новую информацию со старой, используя знания, полученные на стадии осмысления. Исходя из решения данной проблемы, учащиеся самостоятельно или совместно с учителем делают вывод.
Взаимопроверка по ключу. |
-
4. Домашнее задание | Сообщить учащимся о д/з и разъяснить методику его выполнения. Прочитать параграф § 5, упр. 11-17, (с. 22)
| Записывают домашнее задание |
Приложение1.
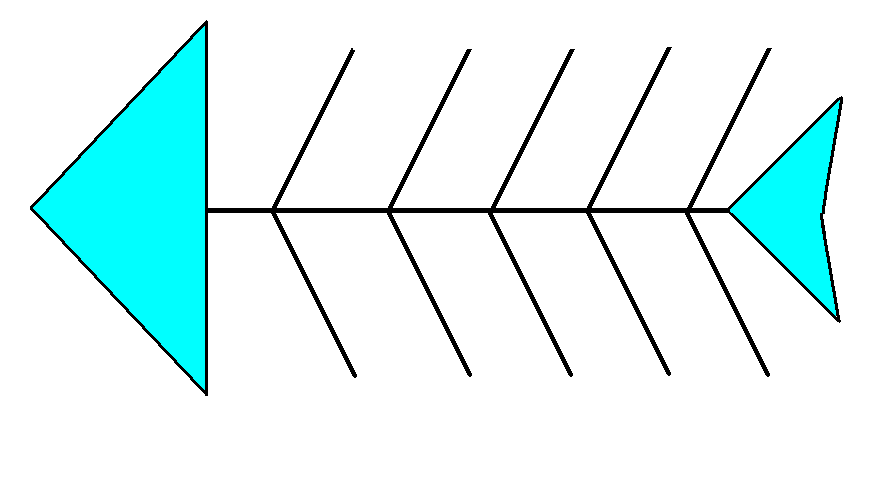

Приложение 2.
-
Валентность - это
1)число химических связей, образуемых атомом химического элемента
2)условный заряд атома, вычисленный на основе предположения, что соединение построено по ионному типу
3)число, равное количеству электронов в атоме
4)число, равное количеству электронов внешнего уровня атома
2.Максимальная валентность атома фосфора:
1)+5 2)V 3)+4 4)IV
3.Минимальная валентность атома хлора:
1)VI 2) -6 3) I 4)-1
4.Максимальная степень окисления хлора:
1) VII 2)-2 3)II 4)-1
5. Минимальная степень окисления атома углерода
1)V 2)-4 3)II 4)+2
6.Отрицательное значение степени окисления не может иметь атом химического элемента:
1) Br 2)N 3)Mg 4)P
7.Максимальное значение степени окисления +2 может иметь атом химического элемента:
1)Al 2)S 3)Si 4)O
8.Степень окисления -3 азот имеет в веществе:
1)NH3 2)N2O3 3)N2 4)NF3
9.Вещество, в котором валентность элементаа равна VI :
1)Э2O3 2)ЭO 3)ЭO3 4)ЭО4
10.В соединении SCl6 степени окисления серы и хлора соответственно равны:
1)+6 и -1 2)-6 и +1 3)+3 и -2 4)+12 и -2






 Валентность
Валентность




















