Конспект урока: «Свойства карбоновых кислот»
Тип урока: урок получения новых знаний.
Форма занятия: защита мини-проектов.
Цели:
Образовательные:
организовать деятельность учащихся по получению новых знаний в рамках темы “Карбоновые кислоты”.
Развивающие:
помочь учащимся осознать практическую значимость учебного материала;
содействовать развитию у школьников умений выделять главное, сравнивать, анализировать познавательный объект;
содействовать развитию у школьников исследовательской деятельности (умений выдвигать гипотезы, формулировать проблемы, предлагать пути их решения);
развивать у школьников культуру самоуправления учебной деятельностью;
содействовать развитию у учащихся коммуникативной культуры;
Воспитательные:
осознание учениками того, какую значительную роль играют карбоновые кислоты в жизни человека.
Методы:
метод проектов;
демонстрационный эксперимент.
Средства обучения:
учебники; справочный материал, интернет -ресурсы
компьютер;
медиапроектор.
Форма организации работы в классе: индивидуальная, групповая.
ХОД УРОКА
I. Организационный этап .
1. Приветствие.
Добрый день ребята, гости. Сегодня наше занятие мы проведем, используя метод проектов. А ваше хорошее настроение и работоспособность приведет нас к замечательным результатам. Итак, метод проектов, давайте вспомним, что для него характерно. Информация добывается самостоятельно с помощью учебника, дополнительного материала, интернет ресурсов, проведения эксперимента и используется следующий алгоритм.
выдвигается гипотеза
ставиться цель
определяются задачи
проводится исследование
получается продукт проекта
Эпиграфом к занятию будут слова «Опыт и наблюдение - таковы величайшие источники мудрости, доступ к которым открыт для каждого человека. (Чаннинг)» Вот и сегодня вы будете наблюдать и экспериментировать. Для проведения занятия вы разделены на творческие группы, в которой нужно будет ,определить лидера именно он будет представлять результат проекта.
О чем же пойдет речь?
Что объединяет помещённые на слайде изображения с точки зрения химии?
( в каждом из них содержаться карбоновые кислоты)
О чем мы говорили на прошлом уроке,
(о строении молекул, изомерии и номенклатуре кислот)
Что осталось не изученным?
(свойства)
Вот о них и пойдет сегодня речь.
Тема урока: Свойства карбоновых кислот.
– А зачем нам нужно знать химические свойства карбоновых кислот?
Каждый образованный человек, обязан знать, что он ест и пьет, с чем имеет дело в быту, что происходит в нашем организме. Знать, чем опасны эти вещества, с чем они могут прореагировать. Каждая группа получила на столы инструкционные карты, согласно которым вы будете исследовать физические и химические свойства кислот, используя метод проектов и конечно не забывая о правилах техники безопасности. Итак, начинаем ,успеха вам ребята.
Приложение 1-3
Ребята, наступило время защиты проектов. Мы работаем в тетрадях, записываем химические свойства и выводы сделанные группой.
Мое подведение итогов
- в отличие от большинства неорганических кислот, карбоновые кислоты являются слабыми электролитами, а потому диссоциируют обратимо:
СН3 СООН = СН3СОО- + Н+ .
Планируемый ответ ученика.
(В растворе кислоты лакмусовая бумажка краснеет.)
- Уксусная кислота взаимодействует с металлами, стоящими в ряду напряжения металлов до водорода:
2СН3 СООН + Мg = (СН3 СОО)2Мg + Н2 .
Соли уксусной кислоты называются ацетатами, соли муравьиной кислоты – формиатами.
- Что вы наблюдали при проведении второго опыта? Какой вывод можно сделать?
Планируемый ответ ученика.
(Видели, что при взаимодействии кислоты с магнием выделялся газ. Значит, уксусная кислота взаимодействует с металлами.)
- Уксусная кислота взаимодействует с основными оксидами и амфотерными оксидами с образованием соли и воды:
2СН3 СООН + МgО = (СН3 СОО)2Мg + Н2О,
2СН3 СООН + ZnО = (СН3 СОО)2 Zn + Н2О.
- Что вы наблюдали при проведении третьего опыта? Какой вывод можно сделать?
Планируемый ответ ученика.
(При проведении третьего опыта мы наблюдали исчезновение порошка оксида магния в растворе уксусной кислоты. Это говорит о том, что уксусная кислота взаимодействует с оксидами металлов.)
- Уксусная кислота взаимодействует с основаниями и амфотерными гидроксидами. Запишем уравнение реакции взаимодействия уксусной кислоты с гидроксидом меди и гидроксидом цинка:
2СН3 СООН + Сu(ОН) 2 = (СН3 СОО)2Сu + 2Н2О,
2СН3 СООН + Zn(ОН) 2 = (СН3 СОО)2 Zn + 2Н2О.
- Каковы результаты четвертого опыта?
Планируемый ответ ученика.
(В четвертом опыте мы наблюдали исчезновение осадка гидроксида меди. Уксусная кислота взаимодействует с основаниями.)
- Уксусная кислота как слабый электролит взаимодействует с солями слабых кислот:
2СН3 СООН + СaСО3 = (СН3 СОО)2 Са + Н2О + СО2 .
- Что можно сказать о результатах пятого опыта? Какой вывод можно сделать?
Планируемый ответ ученика.
(При взаимодействии уксусной кислоты с карбонатом кальция наблюдали бурное течение реакции с выделением газа. Это говорит о том, что уксусная кислота взаимодействует с солями.)
Специфические свойства ,проверяем правильность написания уравнений реакций с помощью презентации.(см. слайд № 5 Презентации)
Участники устно комментируют в общем виде:
1. Реакция этерификации:
R–COOH + HO–R` –– R–COO–R` + H2O
Демонстрация опыта: СН3СООН + НО–С2Н5 ––
2. Хлорирование углеводородного радикала: обратите внимание хлорирование идет в соседний атом углерода при карбоксильной группе
R–СН2–COOH + Сl2 –– …
Вывод группы: …
Вопросы – ответы ….
Учитель обобщает и делает вывод по защите проектов 1 и 2 групп учащихся.
3 группа: Индивидуальные свойства (см. слайд № 6 Презентации)
1. Муравьиная кислота.
Демонстрация опыта:
IV. Этап подведения итогов учебного занятия
Итоги и выставление оценок группам я попрошу сделать вам самим. На ваших столах находятся листы контроля и оценивания, попрошу проставить оценки каждой группе и внутри группы по вкладу каждого участника проекта
| № групп | 1 группа | 2 группа | 3 группа |
| оценки | | | |
| ФИО участника | Оценка участника проекта | Оценка участника проекта | Оценка участника проекта |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Общий вывод учителя.
Таким образом, сегодня на уроке мы рассмотрели свойства карбоновых кислот и познакомились со сферами их применения. А метод минипроектов можно использовать не только на уроке, а и как домашнее занятие. В классе работала творческая группа учащихся, заданием для которых было создание авторских задач по теме карбоновые кислоты. Условия этих задач участники группы скинут в беседу вашего класса и именно с них мы начнем следующий урок. Продукт же проекта они представят сейчас.
V. Домашнее задание
Решение авторских задач и выставление за них оценки
VI. Рефлексия
Я справился(ась) с задачами урока- по 5-ти бальной шкале(в тетрадях)
Мне было интересно-….
Мне понравился урок и я на нем.
– Спасибо всем! Хорошо поработали. Оценки будут на следующем уроке, с учетом выполненных заданий на листочках
Приложение
1 группа
Свойства общие с неорганическими кислотами
Инструктивная карта -1 группа.
Выполните опыты, указанные в таблице.
Во втором столбце запишите наблюдаемые явления и уравнение реакции
В третьем столбце запишите выводы. Если затрудняетесь сделать вывод самостоятельно, заполнение столбца оставьте до обсуждения.
| № опыта | Опыт | Что наблюдали Уравнение реакции | Вывод |
| 1. | В пробирку с уксусной кислотой добавьте 1-2 капли метилоранжа.
| | |
| 2. | В пробирку с магнием прилейте уксусную кислоту.
| | |
| 3. | Прилейте уксусную кислоту в пробирку с оксидом магния.
| | |
| 4. | Прилейте уксусную кислоту в пробирку с гидроксидом меди.
| | |
| 5. | Прилейте уксусную кислоту в пробирку с карбонатом кальция. | | |
2 группа
Инструктивная карта. Специфические свойства
Используя интернет ресурсы, найдите видео опыты указанные в таблице.
Во втором столбце запишите наблюдаемые явления и уравнения реакции
В третьем столбце запишите выводы. Если затрудняетесь сделать вывод самостоятельно, заполнение столбца оставьте до обсуждения.
| № опыта | Опыт | Что наблюдали Уравнение реакции | Вывод |
| 1. | Реакция этерификации
| | |
| 2. | Хлорирование углеводородного радикала
| | |
| 3. | Индивидуальные свойства муравьиной кислоты (реакция «серебряного зеркала»)
| | |
| 4. | Индивидуальные свойства муравьиной кислоты (реакция «медного зеркала») | | |
Инструктивная карта -3 группа.
Изучение физических свойств и применение карбоновых кислот
Низшие насыщенные карбоновые кислоты (С1-С3) при обычных условиях представляют собой легкоподвижные жидкости, обладающие характерным острым запахом.  Например, этановая (уксусная) кислота имеет характерный «уксусный» запах.
Например, этановая (уксусная) кислота имеет характерный «уксусный» запах.
Кислоты состава С4-С9 – вязкие маслянистые жидкости с неприятным запахом, напоминающим запах пота, плохо растворимые в воде (разветвленные кислоты до С13 — жидкости). Высшие карбоновые кислоты (с С10) — твердые вещества, без запаха, нерастворимые в воде.
Алифатические карбоновые кислоты с количеством атомов углерода более 10 относят к высшим жирным кислотам (ВЖК), так как подавляющее большинство из них могут быть выделены из жиров животного или растительного происхождения.
Муравьиная, уксусная и пропионовая кислоты смешиваются с водой в любых соотношениях. С увеличением молекулярной массы кислот растворимость в воде уменьшается. Высшие карбоновые кислоты, например, пальмитиновая С15Н31СООН и стеариновая С17Н35СООН – бесцветные твердые вещества, не растворимые в воде.
Монокарбоновые кислоты хорошо растворяются также во многих органических растворителях.

С увеличением числа атомов углерода в молекулах кислот и соответственно, с ростом относительной молекулярной массы температура кипения увеличивается, запах ослабевает и исчезает.
Температуры плавления кислот с четным числом углеродных атомов имеют более высокие температуры плавления, чем с нечетным числом. С увеличением числа углеродных атомов в молекуле кислоты температура плавления уменьшается и где-то после С25 практически сходит на нет.
Температуры кипения и плавления кислот значительно выше температур кипения и плавления спиртов и альдегидов с тем же количеством атомов углерода.
Карбоновые кислоты имеют аномально высокие температуры кипения из-за наличия межмолекулярных водородных связей. Водородная связь, образуемая водородом гидроксильной группы одной молекулы с карбонильным кислородом другой, более прочная, чем в спиртах.
В твердом и жидком состоянии молекулы насыщенных монокарбоновых кислот димеризуются в результате образования между ними водородных связей в устойчивые циклические димеры:
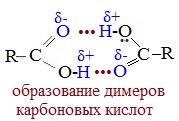
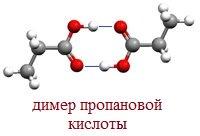
Между двумя молекулами могут устанавливаться две водородные связи, это и обусловливает сравнительно большую прочность димерных молекул.
Молекулы муравьиной и уксусной кислот за счёт водородных связей могут образовывать димеры, которые не разрушаются даже в паровой фазе. 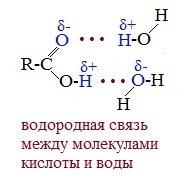 Муравьиная кислота в парообразном состоянии состоит из димеров. Уксусная кислота в парах представляет собой смесь простых и удвоенных молекул.
Муравьиная кислота в парообразном состоянии состоит из димеров. Уксусная кислота в парах представляет собой смесь простых и удвоенных молекул.
Растворимость карбоновых кислот в воде несколько выше, чем у спиртов, так как и с водой кислоты образуют более прочные водородные связи.
Отсутствие среди карбоновых кислот газообразных веществ связано с межмолекулярной ассоциацией (соединением) молекул посредством водородных связей.
 Муравьиная кислота НСООН – бесцветная жидкость с резким запахом, кипит при 1010С. Растворяется в воде в любых количествах. Муравьиная кислота содержится в выделениях муравьев, в крапиве, и хвое ели. Вызывает ожоги на коже. Ожог крапивой – это результат раздражающего действия муравьиной кислоты.
Муравьиная кислота НСООН – бесцветная жидкость с резким запахом, кипит при 1010С. Растворяется в воде в любых количествах. Муравьиная кислота содержится в выделениях муравьев, в крапиве, и хвое ели. Вызывает ожоги на коже. Ожог крапивой – это результат раздражающего действия муравьиной кислоты.
 Уксусная кислота СН3СООН при обычной температуре – бесцветная жидкость, кислая на вкус, с резким запахом. Температура кипения 100%-й уксусной кислоты – 1180C. Безводная уксусная кислота застывает при температуре ниже + 16,80С, образуя красивые кристаллы, похожие на лед, поэтому ее называют ледяной уксусной кислотой. В кристаллах между молекулами уксусной кислоты образуются особенно прочные водородные связи.
Уксусная кислота СН3СООН при обычной температуре – бесцветная жидкость, кислая на вкус, с резким запахом. Температура кипения 100%-й уксусной кислоты – 1180C. Безводная уксусная кислота застывает при температуре ниже + 16,80С, образуя красивые кристаллы, похожие на лед, поэтому ее называют ледяной уксусной кислотой. В кристаллах между молекулами уксусной кислоты образуются особенно прочные водородные связи.
3-9% водный раствор кислоты известен под названием столового уксуса, который применяется как приправа к пище. 70-80% уксусная кислота называется уксусной эссенцией.
Уксусная кислота смешивается во всех отношениях с водой, спиртом, эфиром, бензолом. Ледяная уксусная кислота хороший растворитель многих органических веществ. Концентрированные растворы уксусной кислоты при попадании на кожу вызывают ожоги.
Видеоопыт «Замораживание уксусной кислоты (демонстрация ледяной уксусной кислоты)»

В химпроме — сырье для органического синтеза.  Используются в производстве мыл, моющих средств, сложных эфиров, смазочных масел, эмульгаторов, инсектицидов, катализаторов, растворителей, пластификаторов, лаков, смол и клеев, гликолей, пластиков, реактивов для флотации, ПАВ и многих других нужных для промышленности и быта веществ.
Используются в производстве мыл, моющих средств, сложных эфиров, смазочных масел, эмульгаторов, инсектицидов, катализаторов, растворителей, пластификаторов, лаков, смол и клеев, гликолей, пластиков, реактивов для флотации, ПАВ и многих других нужных для промышленности и быта веществ.
В пищепроме — в качестве консервантов, стабилизаторов, антиоксидантов, ароматизаторов.
В фармацевтике используются для синтеза лекарственных препаратов и дезинфицирующих средств.
В косметической индустрии — для получения ароматических веществ, парфюмов, изготовления кремов и мазей.
В металлургии, текстильной отрасли, кожевенном и бумажном производстве, сельском хозяйстве, в аналитической химии.







 Например, этановая (уксусная) кислота имеет характерный «уксусный» запах.
Например, этановая (уксусная) кислота имеет характерный «уксусный» запах.


 Муравьиная кислота в парообразном состоянии состоит из димеров. Уксусная кислота в парах представляет собой смесь простых и удвоенных молекул.
Муравьиная кислота в парообразном состоянии состоит из димеров. Уксусная кислота в парах представляет собой смесь простых и удвоенных молекул. Муравьиная кислота НСООН – бесцветная жидкость с резким запахом, кипит при 1010С. Растворяется в воде в любых количествах. Муравьиная кислота содержится в выделениях муравьев, в крапиве, и хвое ели. Вызывает ожоги на коже. Ожог крапивой – это результат раздражающего действия муравьиной кислоты.
Муравьиная кислота НСООН – бесцветная жидкость с резким запахом, кипит при 1010С. Растворяется в воде в любых количествах. Муравьиная кислота содержится в выделениях муравьев, в крапиве, и хвое ели. Вызывает ожоги на коже. Ожог крапивой – это результат раздражающего действия муравьиной кислоты. Уксусная кислота СН3СООН при обычной температуре – бесцветная жидкость, кислая на вкус, с резким запахом. Температура кипения 100%-й уксусной кислоты – 1180C. Безводная уксусная кислота застывает при температуре ниже + 16,80С, образуя красивые кристаллы, похожие на лед, поэтому ее называют ледяной уксусной кислотой. В кристаллах между молекулами уксусной кислоты образуются особенно прочные водородные связи.
Уксусная кислота СН3СООН при обычной температуре – бесцветная жидкость, кислая на вкус, с резким запахом. Температура кипения 100%-й уксусной кислоты – 1180C. Безводная уксусная кислота застывает при температуре ниже + 16,80С, образуя красивые кристаллы, похожие на лед, поэтому ее называют ледяной уксусной кислотой. В кристаллах между молекулами уксусной кислоты образуются особенно прочные водородные связи.
 Используются в производстве мыл, моющих средств, сложных эфиров, смазочных масел, эмульгаторов, инсектицидов, катализаторов, растворителей, пластификаторов, лаков, смол и клеев, гликолей, пластиков, реактивов для флотации, ПАВ и многих других нужных для промышленности и быта веществ.
Используются в производстве мыл, моющих средств, сложных эфиров, смазочных масел, эмульгаторов, инсектицидов, катализаторов, растворителей, пластификаторов, лаков, смол и клеев, гликолей, пластиков, реактивов для флотации, ПАВ и многих других нужных для промышленности и быта веществ.









