Урок химии в 11 классе: « Металлы».
Тип урока:
Изучение и первичное закрепление новых знаний и способов деятельности.
Цели урока:
Образовательная: учащиеся должны повторить известные сведения
о строении атомов металлов, коррекция знаний учащихся характеризовать общие химические свойства, записывать уравнения химических реакций.
Развивающая: создать условия для формирования умения анализировать
информацию, выделять главное, существенное, продолжить развитие навыков самостоятельного умственного труда, умение сравнивать, наблюдать, делать выводы.
Воспитательная: продолжить работу по воспитанию аккуратности, коммуникативности, взаимопомощи.
Средства обучения:
1) ПСХЭ Д.И.Менделеева,
2)раздаточный материал: таблица « Физические свойства металлов», опорный сигнал по теме «Металлы»;
3) демонстрационные таблицы: кристаллическая решетка металлов, изменения радиуса атомов в периодической системе;
4) коллекция «Металлы и сплавы»;
5) модели кристаллических решеток металлов;
6) мультимедийный проектор.
Форма организации работы в классе: индивидуальная, фронтальная, парная.
Ход урока
Организационный момент. (1 минута).
( Настроить учащихся на активную, плодотворную работу.)
Постановка цели . (2 минуты).
Учитель: Мы приступаем к изучению большой темы «Вещества и их свойства». Изучение веществ начинаем с самой многочисленной и разнообразной группы - металлов. Цель урока: обобщить систематизировать знания о Ме, которые вы получили при изучении химии в 8,9,10 классах и повседневной жизни. Записываем тему урока «Металлы». (Беседа с учащимися о значении металлов).
Учитель сообщает план урока (учащиеся записывают в тетрадях):
1.Хим. элементы металлы (Ме):
а) положение в ПСХЭ Д.И.Менделеева
б) особенности электронного строения атомов.
2.Простые вещества Ме:
а) структура простых веществ, общие физические свойства.
б) общие химические свойства.
3. Актуализация опорных знаний. (10 минут).
Предварительный контроль: (фронтальный опрос)
Вопрос: Охарактеризуйте положение Ме в ПСХЭ Д.И.Менделеева;
Вопрос: Каковы особенности строения атомов химических элементов металлов?
Вопрос: К каким семействам относят элементы Ме?
Учитель: Рассмотрим строение атомов s,p,d-элементов Ме.
(Учитель организует самостоятельную работу по группам.
Карточка с заданием у каждого ученика на столе)
Задание: Запишите схемы строения атомов:
натрия (1 группа),
алюминия (2 группа),
железа(3группа),
По одному человеку от каждой группы работают у доски, а остальные ученики - в рабочих тетрадях. Учащиеся записывают схемы строения атомов, электронные и электронно-графические формулы.
(Индивидуальный опрос: учитель проверяет работу учащихся у доски).
Самопроверка знаний: оценили свою работу, обратили внимание на особенности d-элементов.
Учитель:
Вопрос: Какие значения степеней окисления могут проявлять эти элементы?
Задание: Сравните число значений степеней окисления у элементов побочных подгрупп с элементами главных подгрупп. Почему?
Ученики отвечают на вопросы, указывая на большее значение степеней окисления у элементов побочных подгрупп, связывая это с большими валентными возможностями атомов.
Введение новых знаний. (10 минут).
Вопрос: Какими свойствами обладают атомы Ме?
Задание: Дайте определение химическим элементам Ме исходя из особенностей строения их атомов.(Ученики отвечают на вопрос, дают определение химическим элементам Ме).)
Учитель: Переходим к рассмотрению простых веществ Ме.
На основании особого строения атомов у Ме существует особый вид связи.
Вопрос: Какой тип связи характерен для простых веществ Ме? (ученики отвечают на вопрос).
МЕ связь – это связь в металлах и сплавах между катионами метал-
лов, нейтральными атомами за счёт свободных электронов. ( Ученики записывают в тетради определение металлической связи).
Учитель: Раз у всех металлов одинаковый вид связи, то и тип кристаллической решётки, тоже одинаковый. Какой?
Что находится в узлах кристаллической решётки металлов?
Чем они связаны? (ученики отвечают на вопросы).
Учитель: (демонстрирует таблицу «Кристаллическая решетка металлов»).
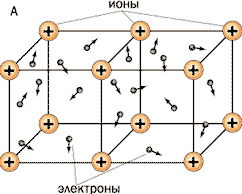
Изображение условно, так как атом, теряя электрон, превращается в ион, а ион, присоединяя электрон, превращается в атом. То есть система динамическая. Поскольку у металлов тип кристаллической решетки один, то и физические свойства металлов общие.
Учитель: (Демонстрирует образцы металлов).
Вопрос: Пользуясь таблицей« Физические свойства металлов», перечислите общие физические свойства металлов. (Ученики называют общие физические свойства Ме , сравнивают физические свойства металлов, отмечают особые свойства металлов).
Учитель: Общие физические свойства металлов объясняются наличием свободных электронов. Однако у металлов, наряду с общими, есть и специфические физические свойства.
Вопрос: Используя таблицу « Физические свойства металлов», назовите металлы, которые обладают специфическими физическими свойствами.
Учитель: Специфические физические свойства обусловлены, различными типами металлических кристаллических решеток. (Демонстрирует различные типы металлических кристаллических решёток).
5 . Первичное обобщение и ведение новых знаний в систему знаний учащихся. (15 минут).
Учитель: Особое строение атомов, особый вид химических свойств, приводит к особым химическим свойствам металлов.
В химических реакциях атомы металлов отдают электроны, превращаясь в положительно заряженные ионы:
Ме0 – ne ® Me+n (процесс окисления)
восстановитель
( ученики записывают схему в тетради)
Ученики делают вывод о восстановительных свойствах простых веществ металлов.
Учитель: Познакомимся с химическими свойствами Ме:
Взаимодействие Ме с простыми веществами:
(Демонстрирует опыты с помощью мультимедийного проектора:
«Горение железа кислороде»; «Взаимодействие железа с серой»;
«Взаимодействие сурьмы, меди и железа с хлором»)
Текущий контроль:
Ученики записывают уравнение химической реакции « Горение железа хлоре», рассматривают реакцию как окислительно-восстановительную, указывают окислитель и восстановитель. Один ученик выполняет это задание на доске. Обращаем внимание на значение степени окисления железа в этой реакции. Прогнозируют состав продуктов реакций, степени окисления Ме в соединениях с серой.
Учитель: Рассмотрим взаимодействие Ме со сложными веществами. По степени активности металлы располагают в ряд напряжений, в котором металлы расположены в порядке убывания их восстановительных свойств и усиления окислительных свойств их ионов. Он характеризует активность металлов в ОВР, протекающих в водных растворах.
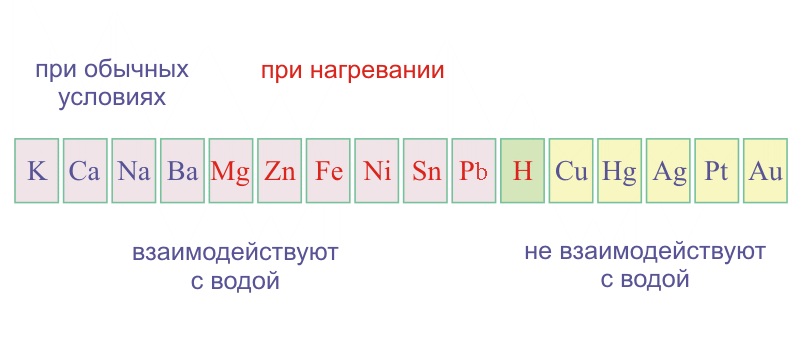
(Демонстрирует опыты с помощью мультимедийного проектора:
«Взаимодействие натрия и кальция с водой», «Взаимодействие железа с серной кислотой», «Взаимодействие меди с раствором нитрата ртути (II)», «Взаимодействие натрия с этанолом»).
Текущий контроль:
Ученики записывают уравнение одной из химических реакций, а остальные уравнения будут делать при выполнении домашнего задания. Один ученик выполняет это задание на доске, рассматривает реакцию как окислительно-восстановительную, указывает окислитель и восстановитель. Ученики прогнозируют состав продуктов реакций, степени окисления Ме в образовавшихся соединениях.
6. Закрепление и применение полученных знаний. (2 минуты).
Вопрос: Какие свойства проявляют в химических реакциях простые вещества металлы? (Ученики делают вывод о восстановительных свойствах простых веществ металлов).
7. Подведение итогов урока. (2минуты).
Учитель: Сегодня мы рассмотрели химические элементы и простые вещества металлы. Выяснили общие и специфические физические свойства простых веществ металлов. Рассмотрели общие химические свойства простых веществ металлов. Ещё раз убедились в том, что свойства веществ зависят от строения. Что нового вы узнали о простых веществах Ме?
Учащиеся перечисляют, что нового узнали о простых веществах металлах, оценивают свою работу на уроке. Учитель комментирует оценки и выставляет их в журнал.
8. Информация о домашнем задании. (3 минуты).
§ №18.Написать уравнение наблюдаемых реакций и рассмотреть их, как ОВР:
на оценку «5»составить уравнение электронного баланса, указать окислитель и восстановитель, процессы окисления и восстановления для всех реакций; на оценку «4»составить уравнение электронного баланса, указать окислитель и восстановитель, процессы окисления и восстановления для четырех реакций;
на оценку «3»составить уравнение электронного баланса, указать окислитель и восстановитель, процессы окисления и восстановления для двух реакций.
Задание индивидуальное: Подготовьте сообщение о
применение металлов, основанное на их особых свойствах.



















