План-конспект урока по химии в 12 классе разработан
учителем первой квалификационной категории
филиала «Новоалтайская вечерняя (сменная) общеобразовательная школа»
КГКОУ Вечерняя школа №2
Ненашевой Светланой Васильевной.
Дата проведения: 12.03.2018.
Урок на тему «Соли (c применением здоровье-сберегающих и ИКТ технологий)»
Тип урока: КУ (комбинированный урок).
Цели урока:
создать условия для совершенствования информационно-коммуникативной и предметной компетенций через изучение состава, свойств, применение и получение средних, кислых и основных солей, их диссоциацию; через умение экспериментальным путём подтверждать химические свойства средних солей.
Развивать умения сравнивать по составу различные виды солей, анализировать их способы получения, процесс диссоциации; формировать навыки экспериментальной работы, способность обобщать и систематизировать полученные знания о солях, их взаимосвязи с другими классами сложных неорганических веществ
Стимулировать деятельность обучающихся, применяя приёмы здоровьесберегающих технологий обучения (хромотерапии). Особое внимание уделить проблеме физиологического действия солей на организм человека. Развивать творческие способности, социальную активность учащихся через установление межпредметных связей химии с биологией, экологией, медициной, историей, литературой. Воспитывать общую культуру.
Методы и методические приемы: словесные, наглядные, практические, проектный; демонстрация ответов; лабораторный эксперимент; конспектирование материала учениками; работа в группах и выступление с отчетом.
Форма организации работы в классе: индивидуальная, групповая, фронтальная, коллективная.
Оборудование: на столе учителя – набор сухих солей ( NaCl, NaHCO3, K2Cr2O7, K2Cr2O4, NiSO4 , CoSO4, CuS; компьютер, презентация, учебное электронное издание химия, виртуальная лабораторная работа.
Пояснительная записка: Данный урок является 9 уроком темы «вещества и их свойства» программы О.С. Габриеляна «Программа курса химии для 8-11 классов общеобразовательных учреждений» Москва. Дрофа. 2011. Учебник. О.С.Габриелян. Учебник для общеобразовательных учреждений. «Химия. 11 класс. Базовый уровень». – М.: Дрофа, 2007.
Ход урока
I.Организационный этап (1 минута.)
Приветствие учеников, знакомство с изучаемой темой, постановка цели. Напоминание о соблюдении правильной осанки.
II Этап проверки домашнего задания
Подготовка учащихся к восприятию нового материала осуществляется через повторение уже изученного, при этом используются слайды презентации. Учитель: Сегодня на уроке мы продолжим изучать тему «вещества и их свойства». Прежде чем приступить к изучению нового материала, необходимо проверить ваши знания о составе и классификации уже изученных классов веществ.
Опрос будет проходить по группам: I группа (I ряд) – специалисты по оксидам, II группа (II ряд) – специалисты по основаниям, III группа (III ряд) – специалисты по кислотам. Всем обучающимся выдаются цветные листы контроля знаний с немыми (без формул) схемами, отражающими классификации оксидов (I группа), оснований (II группа), кислот (III группа).
I группа будет работать на жёлтых листах. Жёлтый цвет ассоциируется с солнцем и интуицией, стимулирует нервную систему, укрепляет печень и сердце.
II группа получает синие листы. Синий цвет ассоциируется со спокойствием и умом, создаёт атмосферу умиротворения, снимает раздражительность.
III группе достаются красные листы. Красный цвет – цвет жизни, он помогает бороться со стрессом, стимулирует чувственность и возвращает жизненную силу.
Лечение цветом называется хромотерапией. Надеюсь, что данный приём создаст на уроке благоприятную атмосферу и поможет вам справиться с поставленными задачами.
Итак, вспомним состав и классификацию сложных неорганических веществ.
- Какие классы сложных неорганических веществ вы знаете? Ответ: оксиды, основания, кислоты, соли. Посмотрите на доску. (Демонстрация слайдов)
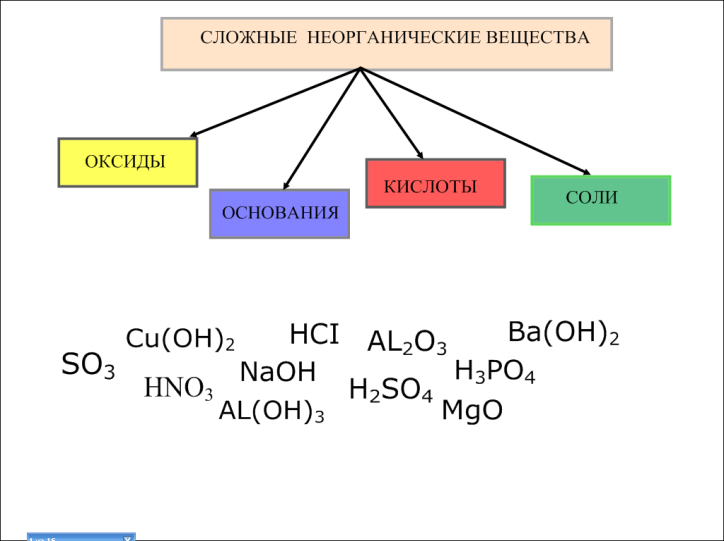
Слайд 1 слайд 2
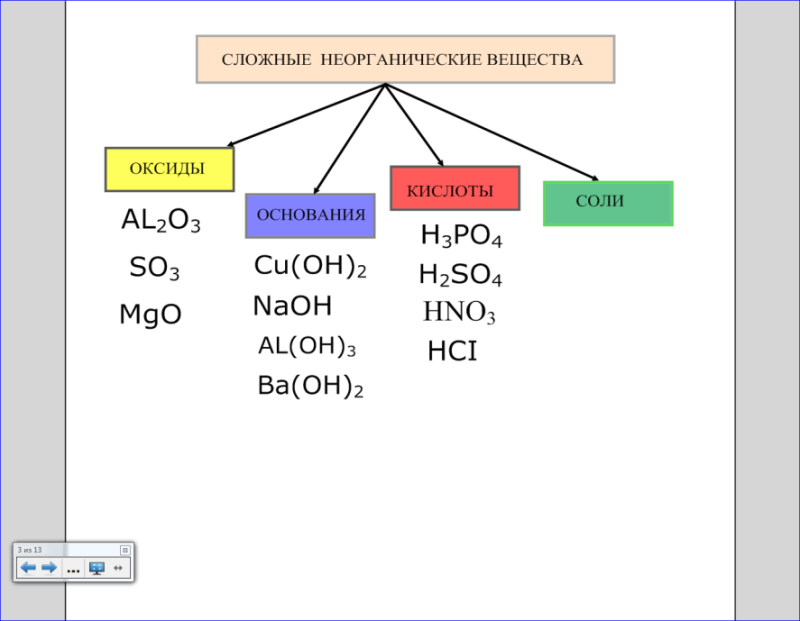
- Задание: перемещением распределите по классам формулы указанных веществ. Выходят представители каждой группы и перемещением распределяют по классам формулы оксидов, оснований и кислот (слайд 2).
- Какие вещества называются оксидами? Ответ: оксиды – это сложные вещества, состоящие из двух элементов, одним из которых является кислород в степени окисления -2.
- Назовите выделенные оксиды. Ответ: Al2O3 - оксид алюминия, SO3 - оксид серы (VI), MgO – оксид магния.
- Какие вещества называются основаниями? Ответ: основания - это соединения, состоящие из атомов металла и одного или нескольких гидроксид-ионов OH- , способных замещаться на кислотные остатки с образованием солей.
- Назовите выделенные основания. Ответ: Cu(OH)2 – гидроксид меди (II), NaOH – гидроксид натрия, AL(OH)3 – гидроксид алюминия, Ba(OH)2 – гидроксид бария.
- Какие вещества называются кислотами? Ответ: кислоты - это соединения, состоящие из кислотных остатков и атомов водорода, способных замещаться атомами металлов с образованием солей.
- Как называются выделенные вами кислоты? Ответ: H3PO4 – ортофосфорная кислота, H2SO4 – серная кислота, HNO3 - азотная кислота, HCl – соляная кислота.
- А теперь повторим классификацию оксидов, оснований и кислот.
Идёт работа в группах, учащиеся заполняют немые (без формул) схемы на листах контроля знаний. При этом используются формулы выше названных веществ. По истечении 3-4-х минут проходит проверка, учитель постепенно демонстрирует слайды с заранее заполненными схемами: «Оксиды», «Основания», «Кислоты».
На доске – схема «Оксиды».
- Проверим, как справилась с заданием I группа. Сравните результат своей работы с образцом на доске. Обратите внимание на характер свойств оксидов и соответствующих им гидроксидов.
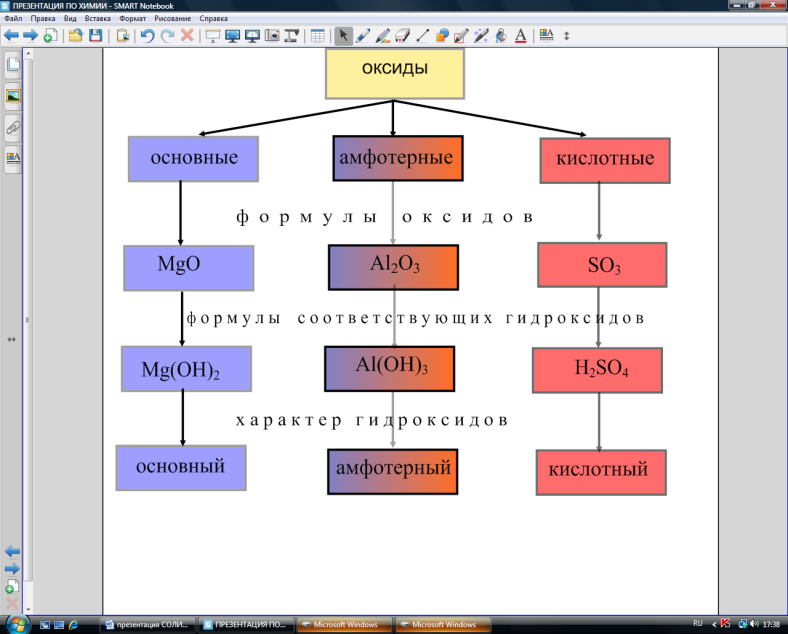
Слайд 3
На доске – схема « Основания ».
- А теперь посмотрим, как распределили формулы оснований по двум классификациям обучающиеся II группы. Сравните результат своей работы с образцом.
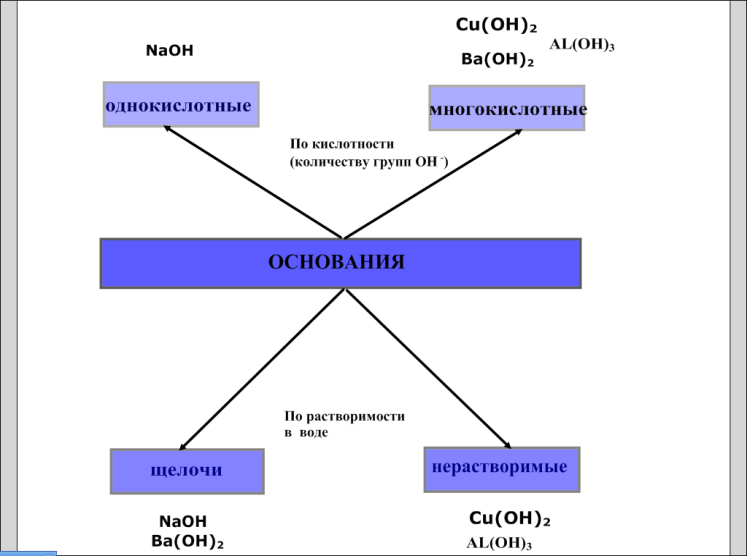
Слайд 4
- Сегодня на уроке особенно важно знать деление оснований по кислотности на однокислотные и многокислотные.
В работу включается III группа. На доске появляется схема «Кислоты».
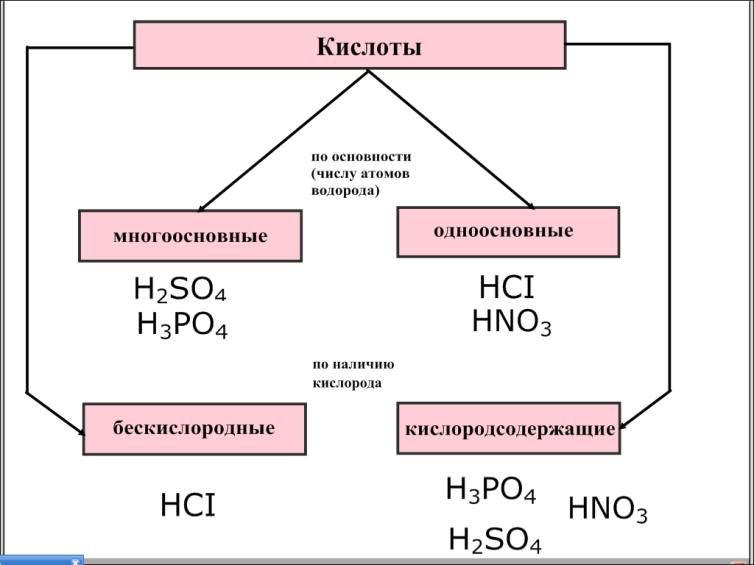
Слайд 5
- Проверьте распределение кислот по двум классификациям. Обратите внимание на то, что кислоты по основности делятся на одноосновные и многоосновные.
- Итак, мы повторили состав и классификацию оксидов, оснований и кислот, а теперь приступим к изучению нового материала.
III. Этап изучения новых знаний и способов деятельности
- Обратимся к уже знакомой схеме. На доске появляется изображение (рис. 2).
- Какой класс неорганических веществ ещё не изучался? Ответ: соли.
- Они обозначены на схеме зелёным цветом. Зелёный цвет – цвет природы, он успокаивает при болезненных состояниях.
- Сегодня на уроке мы расширим наши знания о солях, их многообразии, свойствах, способах получения и применении.
- Запишите тему урока – «Соли».
- Давайте вспомним, какие вещества относятся к солям. Ответ: соли – это сложные вещества, состоящие из ионов металла и кислотного остатка.
- Сегодня на уроке вы узнаете более полное определение солей.
Соли – это продукты полного или частичного замещения атомов водорода в молекуле кислоты атомами металла либо продукты полного или частичного замещения гидроксогрупп в молекуле основания кислотными остатками.
Соли очень многообразны по своим свойствам и составу.
Демонстрируется слайд со схемой «Соли».
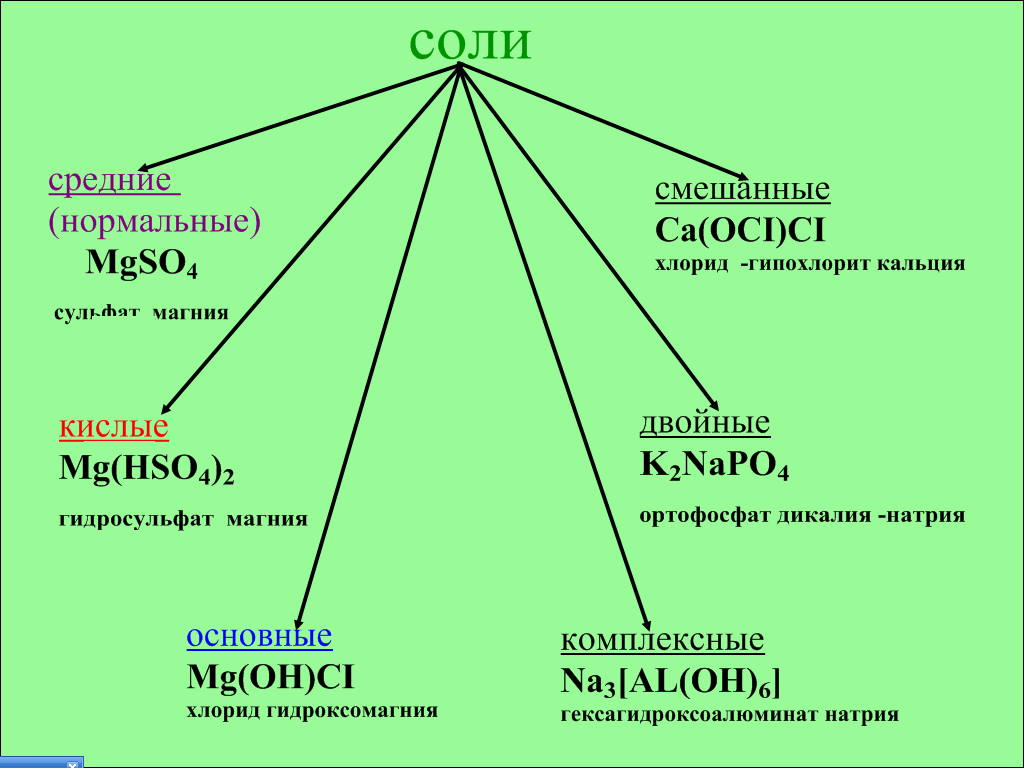
слайд. 6
- Соли очень многообразны по своим свойствам и составу. Как видно из схемы, соли бывают средние (нормальные), кислые, основные, смешанные, двойные, комплексные. В смешанных солях атомы металла связаны с двумя разными кислотными остатками, в двойных – атомы двух металлов связаны с одним кислотным остатком. В комплексных солях выделяют комплексный ион (он пишется в квадратных скобках). Используя значок шторки, учитель закрывает правую часть схемы.
На уроке будут рассматриваться более подробно только средние, кислые и основные соли.
На 25 минуте урока учащимся предлагается отвлечься и провести физкультминутку, выполнить упражнения для глаз.
Хочется отметить некоторые физические свойства этих солей. Соли, за небольшим исключением, являются твердыми кристаллическими веществами. Большинство солей белого цвета, такие как гидрокарбонат натрия и хлорид натрия. Некоторые соли имеют оранжевую окраску как дихромат калия, желтую - хромат калия, зеленую – сульфат никеля (II), розовую - сульфат кобальта(II), черную – сульфид меди (II). Учитель демонстрирует названные соли.
Многие соли хорошо растворяются в воде. Кислые соли, как правило, лучше растворимы, чем соответствующие средние, а основные – хуже.
- А теперь поработаем с учебником. Учитель указывает параграф. Обучающиеся открывают нужные страницы.
- Найдите определение средних солей. Ответ: средние соли - это продукты полного замещения атомов водорода в молекуле кислоты на металл или продукты полного замещения гидроксид-ионов в молекуле основания кислотными остатками. Учитель приводит пример средней соли из схемы – сульфат магния.
- Найдите определение кислых солей. Ответ: кислые соли – это продукты неполного замещения атомов водорода в молекулах многоосновных кислот на металл. Учитель приводит пример кислой соли из схемы – гидросульфат магния.
- Чем по составу кислая соль отличается от средней? Ответ: в кислой соли в кислотном остатке присутствуют катионы водорода.
- При этом в названии соли появляется приставка гидро-.
- Найдите определение основных солей. Ответ: основные соли – это продукты неполного замещения гидроксид-ионов в молекулах многокислотных оснований кислотными остатками. Учитель приводит пример основной соли из схемы – хлорид гидроксомагния.
- В составе основной соли присутствуют гидроксид-ионы, наличие которых в названии указывают приставкой гидроксо- к названию катионов. Обучающиеся выписывают формулы и названия средней, кислой и основной солей из схемы.
Средние, кислые и основные соли при растворении в воде способны диссоциировать на ионы. На интерактивной доске появляется схема.

Слайд 7
- Посмотрите внимательно на схему. Какие особенности диссоциации средних, кислых и основных солей можно отметить? Ответ: средние соли диссоциируют в одну ступень. Кислые и основные соли диссоциируют ступенчато. Учитель просит обучающихся сделать записи в тетради.
- При диссоциации кислых солей образуются два вида катионов – катионы металла и катионы водорода. При диссоциации основных солей образуются два вида анионов – анионы кислотного остатка и гидроксид-ионы.
- А теперь обсудим способы получения каждого вида солей. Соли можно представить как продукты взаимодействия основания и кислоты. На интерактивной доске появляется схема.
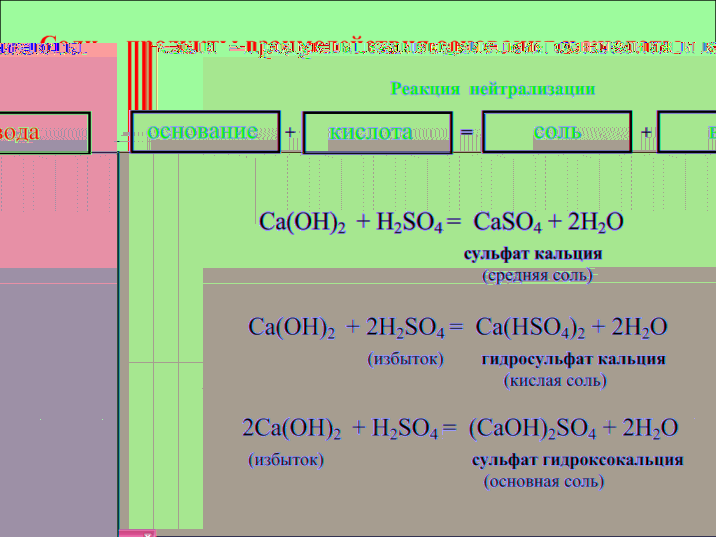
Слайд 8
- Какие реагенты используются во всех реакциях? Ответ: реагенты одинаковые – гидроксид кальция и серная кислота.
- Почему же в ходе этих реакций получаются разные соли? Ответ: при получении кислой соли кислота взята в избытке, а при получении основной соли – в недостатке.
- А теперь сделаем записи в тетради: при получении кислой соли основание взаимодействует с избытком многоосновной кислоты. При образовании основной соли кислота взаимодействует с избытком многокислотного основания.
Следует отметить, что при получении средней соли основание может быть разной кислотности, а кислота - разной основности. При этом реагенты берутся в титрованных количествах. Идёт выполнение виртуальной лабораторной работы

- Способов получения средних солей много. С некоторыми из них мы встречались при изучении оксидов, кислот и оснований. На интерактивной доске появляется схема, нижняя часть которой закрыта шторкой (рис. 10).
- Некоторые способы получения солей основаны на химических свойствах солей. В этом легко убедиться. Учитель открывает шторку. На схеме отражены химические свойства средних солей.

Слайд 11
- На схеме подчёркнуты те способы получения солей, которые совпадают с химическими свойствами солей. Учитель просит обучающихся открыть учебник, где показаны уравнения реакций, подтверждающие химические свойства солей. При этом указывается на особенности проведения некоторых реакций, в частности, образование нерастворимых продуктов.
- Многие соли имеют двойные названия. В повседневной жизни мы часто пользуемся тривиальными названиями солей. Демонстрируется следующий слайд.

- Дайте двойные названия предложенных солей.
IV.Этап первичной проверки понимания изученного.
Учитель проверяет понимание ключевых моментов урока таких, как: Что такое соли? Какого типа соли бывают? Какие способы получения солей известны?
V этап закрепление изученного материала.
Обучающимся предлагается тест. После выполнения работы обучающиеся сдают учителю листы контроля знаний на проверку.

VI этап. Информация о домашнем задании. Изучить п.24, ответить на вопросы 1,2,4,7 на стр.199-200 устно.
VII. Заключительный этап урока. Рефлексия.
1)Рефлексия. Возьмите таблички. (Они заранее разложены на столах учащихся). Возьмите ручки и поставьте плюсы, если вы считаете, что степень ваших знаний и умений изменилась, сможете ли вы теперь без помощи учителя дать характеристику солей?
2)Подведение итогов. Беседа учителя с учащимися.
Учитель рассказывает о большом практическом значении солей для человека, промышленности, сельского хозяйства. Например: NaCl – хлорид натрия, поваренная соль (приправа к пище); NaHCO3 - гидрокарбонат натрия, пищевая сода (добавка к тесту); KMnO4 - перманганат калия, марганцовка (медицинский препарат); CaCO3 – мел (строительный материал); (CuOH)2CO3 – карбонат гидроксомеди (II), малахит (ценный поделочный камень); HgCl2 – хлорид ртути (II), сулема (антисептик); NH4Cl - хлорид аммония, нашатырь (медицинский препарат); AgNO3 – нитрат серебра, ляпис (медицинский препарат).
Подводится итог результатов работы учащихся на уроке с аргументацией поставленных оценок: пояснением активности их работы, правильности ответов и уровня сложности задания.
Учебно- методическое обеспечение
Поурочные планы по учебнику О.С. Габриелян, Г.Г. Лысовой./ авт.-сост. В.Г. Денисова.- Волгоград: Учитель, 2005
Методическое пособие/О.С. Габриелян, Г.Г. Лысова.-3-е изд. Стереотип., Москва Дрофа. 2004, химия 11 класс:
Оборудование
Компьютер
Мультимедийный проектор
Электронные пособия:
Электронные диски «Кирилл и Мифодий»
http://festival.1september.ru
http://www.xumuk.ru/
Приложение «Химия», сайт www.prosv.ru (рубрика «Химия»).
Мультимедиа учебный курс «1С:Образовательная коллекция. Общая химия»
Учебное электронное издание «Химия(8-11 класс) Виртуальная лаборатория»
Интернет-школа Просвещение. ru, online курс по УМК О.С.Габриеляна и др. (www.ihternet-school.ru)





























