Урок по химии в 9-м классе.
Тема: «Оксид и гидроксид алюминия, их свойства»
Цели урока:
1. Дать понятие об амфотерности, амфотерных оксидах и гидроксидах, переходных металлах;
2. Повторить, закрепить и развить знания о классификации и свойствах гидроксидов (в том числе и в свете ТЭД) и о генетической связи между классами веществ.
Воспитательные, образовательные и развивающие задачи урока:
развитие интереса к химии и познавательной активности учащихся;
развитие знаний о классификации и свойствах веществ и о генетической связи;
дать понятие об амфотерности, переходных элементах
Для достижения поставленных целей на уроке используются личностно-ориентированные и компьютерные технологии обучения.
Оборудование и реактивы:
ХОД УРОКА:
1. Организационный момент.
(сообщение темы и цели урока, настрой на работу) Слайд №1
- связи алюминия и его соединений изображена на доске
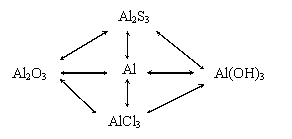
2. Повторение изученного материала.
1) Проверка домашнего задания :
Карточка№1.
План характеристики физических свойств металла алюминия:
1. В каком агрегатном состоянии находится алюминий при данных условиях?
2. Какого цвета? Блеск?
3. Имеет ли алюминий запах?
4. Проявляет ли данный металл пластичность, хрупкость, эластичность?
5. Растворяется ли в воде при данных условиях?
6. Обладает ли алюминий теплопроводностью и электропроводностью?
(Проверьте свои результаты, посмотрев на слайд.) (Слайд №2)
2) Решить цепочку превращения схема на доске (хим. свойства Аl)

3. Изучение нового материала.
(Карточка №2)
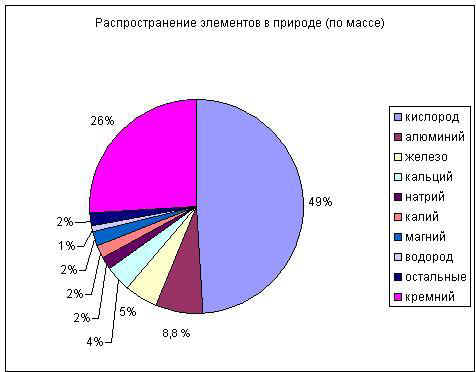
1. Алюминий в природе: встречается в основном в виде соединений, по распространенности в земной коре занимает 1 место среди металлов и 3-е место среди всех элементов (после кислорода и кремния) (Слайд №3 )
2. Одно из самых распространенных соединений алюминия – это его оксид Al2O3
В природе он представлен в виде различных горных пород и минералов: Слайд №4 )
Оксид алюминия Al2O3 – белый тугоплавкий порошок, температура плавления 2044°С, температура кипения 3530°С, плотность 4 г/см3, по твердости близок к алмазу.
 Al2O3 бокситы (горная порода содержащая Al(OH)3 )
Al2O3 бокситы (горная порода содержащая Al(OH)3 )
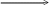
 корунд (минерал)
корунд (минерал)
в мелкозернистом виде в виде кристаллов
используется как наждак как драгоценные камни
красные - рубины синие – сапфиры
 глинозём
глинозём
Получение:
оксид алюминия – природное соединение, может быть получен из бокситов или при термическом разложении гидроксида алюминия:
2Al(OH)3 = Al2O3 + 3H2O;
Химические свойства (Слайд№5)
Al2O3 – амфотерный оксид, химически инертен, благодаря своей прочной кристаллической решетке. Он не растворяется в воде, не взаимодействует с растворами кислот и щелочей и может реагировать лишь с расплавленной щелочью.
Взаимодействует лишь с горячими концентрированными растворами:
Al2O3 + 6HCl = 2AlCl3 + 3H2O;
Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]
Al2O3 + 2NaOН = 2NaAlO2
3. Другое очень интересное соединение – это гидроксид алюминия.( Слайд№6)
Гидроксид алюминия Al(OH)3 – бесцветное твердое вещество, нерастворимое в воде, входит в состав многих бокситов.
Химические свойства (слайд№7)
Гидроксид алюминия – типичное амфотерное соединение, свежеполученный гидроксид растворяется в кислотах и щелочах:
Лабораторный опыт №1 (Слайд№8)
Докажем амфотерность гидроксида алюминия на опыте.
Для начала получим его:
- В 2 пробирки налейте по 1 мл раствора соли алюминия
- В обе пробирки прилейте по каплям раствор щелочи до появления белого осадка гидроксида алюминия:
AlCl3 + 3NaOH = Al(OH)3 + 3NaCl
1.Взаимодействие с кислотами
В одну пробирку с осадком прилейте раствор соляной кислоты.
.Взаимодействие со щелочами
В другую пробирку с осадком прилейте избыток раствора щелочи
Что наблюдали? Осадки в обеих пробирках растворились. (записать уравнения реакции на доске)
Al(OH)3 + 3HCl = AlCl3 + 3H2O
Al(OH)3 + NaOH = Na[Al(OH)4].
4. От перемены мест слагаемых сумма …. изменяется!!! (для амфотерных соединений имеет значение)
1. В одну пробирку налейте 1 мл соли хлорида алюминия AlCl3 и добавьте 3-4 капли раствора натриевой щелочи NaOH.
2. Во вторую пробирку налейте наоборот- 1 мл натриевой щелочи NaOH и добаьте 3-4 капли соли хлорида алюминия AlCl3.
Что наблюдали? В первой пробирке образовывался осадок, а во второй нет.
Для амфотерных соединений имеет большое значение, в какой последовательности проводить эксперимент!
Во втором случае изначально щелочь была в избытке:
AlCl3 + 4NaOH = Na[Al(OH)4] + 3NaCl
5. Закрепление пройденного материала.
Выполнение задач .
КАРТОЧКА №3
Когда учащиеся узнали, что алюминий способен вытеснять другие металлы из их оксидов, Катя предположила, что методом алюмотермии можно получить никель и магний.
Саша с ней согласился и записал уравнения реакций.
Игнат сказал, что одна из этих реакций не произойдёт.
КАРТОЧКА №4.
На факультативе учитель дал ребятам задание экспериментально доказать амфотерность гидроксида алюминия.Инна взяла для опытов две пробирки и насыпала в них следующие вещества: нитрат бария и нитрат натрия .
Сергей сказал, что так ничего не докажешь, и предложил раствор азотной кислоты.
Антон с ним не согласился и сказал, что нужно взять раствор гидроксида калия.
Помогите учащимся выполнить задание учителя. Что им надо сделать? Кто из ребят взял нужные реактивы? Поясните свой ответ.
5.Подведение итогов.
Домашнее задание. Решить цепочку превращений
 NaAlO2
NaAlO2



 Al Al2O3 AlCl3 Al(OH)3
Al Al2O3 AlCl3 Al(OH)3
 Al2(SO4)3
Al2(SO4)3










 Al2O3 бокситы (горная порода содержащая Al(OH)3 )
Al2O3 бокситы (горная порода содержащая Al(OH)3 )
 корунд (минерал)
корунд (минерал)
 NaAlO2
NaAlO2 



 Al Al2O3 AlCl3 Al(OH)3
Al Al2O3 AlCl3 Al(OH)3
 Al2(SO4)3
Al2(SO4)3










