«Молярный объем газов. Закон Авогадро».
Тема урока: Молярный объем газов. Закон Авогадро.
Цели:
образовательная – систематизировать знания учащихся о понятиях количество вещества, число Авогадро, молярная масса, на их основе сформировать представление о молярном объеме газообразных веществ; раскрыть сущность закона Авогадро и его практического применения;
развивающая – формировать способность к адекватному самоконтролю и самооценке; развивать умение логически мыслить, выдвигать гипотезы, делать аргументированные выводы.
Тип урока: комбинированный
Характер деятельности: репродуктивный, частично-поисковый, с элементами исследования.
Ход урока:
1.Организационный момент.
Проверьте готовность, все в порядке?
Готов ли учебник, дневник и тетрадка?
Своим одноклассникам ты улыбнись,
И к знаниям стойким, дружочек, стремись!
2.Объявление темы и целей урока.
3.Актуализация опорных знаний.
3.1. Беседа с учащимися:
Как вы уже знаете, химия – это наука о веществах, их свойствах и превращениях.
В теме нашего урока фигурирует фамилия ученого А.Авогадро.
При изучении какого понятия мы уже встречались с этой фамилией?
Массу мы измеряем килограммах, путь в километрах. А каким же образом измерить количество вещества.
Мы знаем, что вещество состоит из молекул, но отсчитать количество молекул, входящих в то или иное вещество, очень сложно, несмотря на развитие современной техники.
Для измерения вещества была выбрана единица, которая была названа моль. Она как бы объединяет число молекул и массу вещества.
Как же отмерить 1 моль вещества?
Для этого необходимо взять столько его граммов, какова относительная атомная или относительная молекулярная масса вещества.
Например, один моль воды имеет массу равную 18 грамм.
А как связано с количеством вещества число его молекул?
Установлено, что один моль вещества всегда содержит одинаковое число частиц и равно 6*1023 . Это число называется постоянная Авогадро, в честь итальянского ученого Лоренцо Романо Амадео Карло Авогадро, который выдвинул гипотезу, согласно которой, при одинаковых температуре и давлении в равных объёмах идеальных газов содержится одинаковое число молекул. Постоянная Авогадро имеет буквенное обозначение (NA).
Таким образом, 1 моль воды, имеющий массу 18 грамм, содержат 6*1023молекул.
Дадим определение понятию моль.
Моль – это такое количество вещества, в котором содержится 6*1023 молекул этого вещества.
Какой физический смысл имеет число Авогадро и его числовое значение?
В какой формуле (из изученных) применяется эта величина?
Чтобы узнать число молекул (N), содержащихся в определенном количестве вещества, можно воспользоваться формулой: число молекул, содержащихся в определенном количестве вещества, равно произведению постоянной содержащихся в определенном количестве вещества на количество вещества, то есть число молей.
N = NA*n
Исходя из этой формулы, будут верны и обратные формулы:
n = N/NA
Количество вещества равно число молекул вещества разделить на число Авогадро, равное числу молекул в определенном объеме при нормальных условиях.
3.2.Решение задач
3.2.1. Давайте освежим в памяти применение этой формулы, заполнив пропуски в таблице.
|
| Число частиц | Число Авогадро | Количество вещества |
| 1. |
| 6.02 * 1023 1/моль | 2 моль |
| 24.08 * 1023 | |
| 2. |
| 3 моль |
| 6.02* 1023 |
|
| 3. |
| 1.5 моль |
| 60.2* 1023 |
|
(после выполнения осуществляется самопроверка, обратная связь, учащиеся заполняют на доске таблицу)
3.2.2. В теме урока проговаривается новое понятие – «молярный объем», а мы уже знакомы с понятием «молярная масса», давайте вспомним, какое принято обозначение для массы 1 моль вещества, в каких единицах измеряется, с какой величиной совпадает численное значение? (обсуждение с учащимися)
Как называют массу 1 моль вещества?
Чтобы нам было немного легче при изучении нового материала, предлагаю вычислить молярные массы веществ в различных агрегатных состояниях (групповая работа)
1 ряд – находит молярную массу твердого вещества CuSO4,
2 ряд – находит молярную массу жидкого вещества H3PO4,
3 ряд – находит молярную массу газообразного вещества NH3
(после выполнения самопроверки записываем полученный ответ на доске)
3.2.3. Подведем итоги закрепления материала:
C помощью каких физических величин можно охарактеризовать порцию вещества?
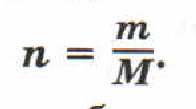
Молярная масса вещества равна отношению массы этого вещества к его количеству.
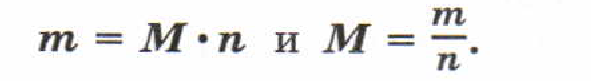
4.Изучение нового материала.
4.1.На сегодняшнем уроке у вас будет возможность сделать то, что в 1811 году удалось итальянскому ученому Амедео Авогадро – сформулировать один из газовых законов.
Презентация ученый химик А.Авогадро
4.1.1.Сегодня мы повторили многие количественные характеристики вещества – масса, молярная масса, количество вещества, число структурных единиц. Но тема нашего урока «Молярный объём», и на уроках химии мы ещё не встречались с такой величиной. Хотя химические реакции нередко идут с участием газообразных веществ, измерять которые удобнее по объему. А вот на уроках физики с величиной, объём вы уже встречались.
В каких же формулах, которые вы используете на уроках физики, используется понятие объём?
Плотность = масса/объем (переводим запись в символическую).
Выразим из формулы, чему равен объем – V = m/ρ
4.1.2.Обратите внимание на рисунок 1, он демонстрирует нам расстояние между молекулами в веществах разных по агрегатному состоянию, давайте вместе выясним, какова зависимость плотности и объема (зависимость обратно пропорциональная)
Рисунок 1.
Агрегатное состояние веществ
Твердое
Газообразное
Жидкое












4.1.3.Допустим, что мы имеем дело с веществами количеством вещества 1 моль, тогда возможно заменить m на М, а объем будет определяться, как молярный (который занимает 1 моль вещества).
4.1.4.Работа по вариантам
Вычислим эту величину для соединений в различных агрегатных состояниях, взятых при одинаковых условиях:
Нормальными условиями (н.у.) в химии принято называть температуру 0оС и давление 760 мм рт. ст., или 101,3 кПа.
Таблица 2.
| Формула вещества | Агрегатное состояние | Молярная масса, г/моль | Плотность, г/л | Молярный объем, л/моль |
| Na2CO3 | Твердое | 106 г/моль | 2500 г/л | 0.04 л/моль |
| Al | Твердое | 27 г/моль | 2700 г/л | 0.01 л/моль |
| H2SO4 | Жидкое | 98 г/моль | 1860 г/л | 0.053 л/моль |
| H2O | Жидкое | 18 г/моль | 1000 г/л | 0.018 л/моль |
| CO2 | Газообразное | 44 г/моль | 1.96 г/л | 22.4 л/моль |
| O2 | Газообразное | 32 г/моль | 1.43 г/л | 22.4 л/моль |
( данные последней графы таблицы учащиеся заполняют после выполнения задания)
4.1.5. По числовым данным молярного объема для веществ в разных агрегатных состояниях делаем вывод, что значения этой величины для твердых и жидких веществ - малые и разные. А для газообразных соединений – величины большие одинаковые.
Вывод - При одинаковых условиях газообразные вещества количеством 1 моль занимают одинаковый объем – 22.4 л/моль.
22,4 л газа при нормальных условиях всегда содержит 6*1023 частиц. (стр.71 рис.21)
(демонстрируем вещества количеством 1 моль – вода, сода, модель фигуры объемом 22.4 л)
4.1.6. Молярный объем газа – это объем газа количеством вещества 1 моль. Обозначают его буквой Vm .
У жидкостей и твердых тел молярный объем зависит от плотности. От чего же зависит молярный объем у газов?
Если взять 1 моль водорода, кислорода, углекислого газа и озона при одинаковых условиях, то окажется, что 1 моль любого из этих газов займет один и тот же объем, равный 22,4 л.
4.2.Промежуточное закрепление.
Для расчетов рационально связать такие характеристики газа, как объем и количество вещества n.
Молярный объем – это физическая величина, равная отношению объема вещества к количеству вещества. Vm= V/n. Выразите из этой формулы чему равны объём и количества вещества?
Заполним недостающие данные в таблице 3.
Таблица 3.
| Объем, л | Объем молярный, л/моль | Количество вещества, моль |
|
|
22.4 л/моль | 1 моль |
|
| 5 моль |
|
| 3 моль |
| 56л |
|
| 44.8 л |
|
| 2.24 л |
|
4.3.В теме нашего урока фигурирует название закона. Я предлагаю вам почувствовать себя учеными и самостоятельно сформулировать закон Авогадро.
Этапы рассуждения:
Вывод – если брать одинаковые объемы газов при одинаковых условиях (Р и t), то они будут содержать одинаковое число молекул.
Следствие – при одинаковых условиях 1 моль любого газа занимает одинаковый объем (22.4 л/моль).
Это доказательство было выдвинуто в соответствии с законом Авогадро 1811 года, который гласит: в равных объемах разных газов при одинаковых условиях содержится одинаковое число молекул (то есть одинаковое количество вещества).
Обращаемся к учебнику, сверим полученные выводы с формулировкой А.Авогадро. (стр.71)
Молярный объем газообразных веществ выражается в л/моль (литрах на моль).
При этом один 1 кмоль (киломоль) равен м3/кмоль, а один 1 ммоль (миллимоль) – 22,4 мл/ммоль.
4.4 Решение задач
Рассмотрим основные типы решения задач по данной теме.
Задача 1.
Какой объем при нормальных условиях займет углекислый газ, взятый в количестве вещества 0,5 моль?
Решение. Поскольку объем вещества равен молярному объему, умноженному на количество вещества, то объем углекислого газа равен 22,4л/моль умножить на 0,5 моль. Ответ: объем углекислого газа равен 11,2 литра.
Задача 2.
Какой объем займет при нормальных условиях хлороводород HCl массой 14,6 г?
Решение:
Определяем количество вещества хлороводорода HCl по формуле: количество вещества равно масса вещества разделить на молярную массу вещества. Таким образом, количество вещества хлороводорода равно: массу хлороводорода разделить на молярную массу хлороводорода. Таким образом, количество хлороводорода составит 0,4моль. Далее находим объем хлороводорода: молярный объем умножить на количество вещества. Ответ: объем хлороводорода равен 8,96 литра.
Задача 3.
Определите массу и объем, занимаемый при нормальных условиях 3,01 * 1026 молекулами метана (СН4).
Решение:
Определяем количество вещества метана n (СH4) по формуле: количество молекул метана разделить на число Авогадро, то есть три целых одна сотая, умноженная на десять в двадцать шестой степени, разделить на шесть, умноженное на десять в двадцать третьей степени. Получаем количество вещества метана равное 500 моль.
Используя значение молярного объема газа при нормальных условиях, вычисляем объем метана СH4 при нормальных условиях: двадцать две целых четыре десятых литра умножить на пятьсот моль, в результате получаем одиннадцать тысяч двести литров, что составляет одиннадцать целых два десятых метра кубических.
Массу газа метана m (СH4) рассчитываем по формуле: масса метана равна произведению молярной массы метана и количества вещества. Массу метана, равную шестнадцати, умножаем на количество вещества метана, равное пятистам. Отсюда масса метана равна 8000 грамм, или 8 килограмм.
Теперь даем развернутый ответ на вопрос, поставленный в задаче: при нормальных условиях объем, занимаемый 3,01 * 1026 молекулами метана (СН4), составляет 11,2 метра кубических, а масса вещества равна 8 килограмм.
5.Закрепление материала (тест по изученному материалу «Взаимопроверка»)
6.Подведение итогов урока. Рефлексия.
7.Домашнее задание (разноуровневое).