Просмотр содержимого документа
«Урок по химии на тему "Серная кислота"»

«Я растворю любой металл. Меня алхимик получал В реторте глиняной простой. Слыву я главной кислотой... Когда в воде я растворяюсь,
то сильно нагреваюсь…»

Тема урока:
«Серная кислота»

План урока:
1. Общая характеристика серной кислоты (H 2 SO 4 )
2. Физические свойства H 2 SO 4
3 . Химические свойства.
4. Использование H 2 SO 4 в различных сферах производства.
5. Нахождение серы в природе (видео).
6. Решение упражнений.
7. Домашнее задание.
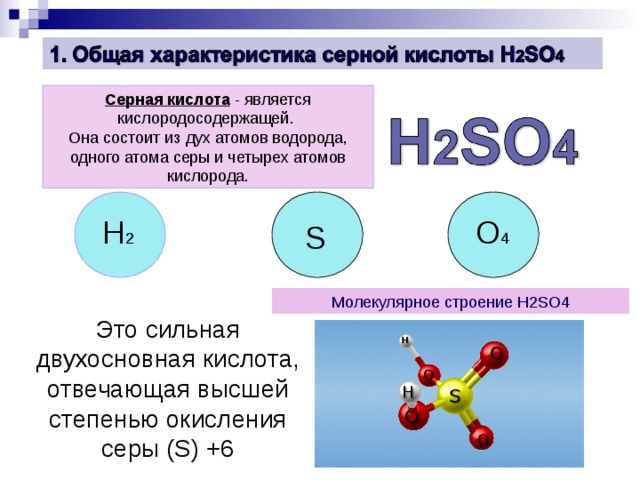
Серная кислота - является кислородосодержащей.
Она состоит из дух атомов водорода, одного атома серы и четырех атомов кислорода.
H 2
O 4
S
Молекулярное строение H2SO4
Это сильная двухосновная кислота, отвечающая высшей степенью окисления серы ( S) +6

2. Физические свойства H 2 SO 4
Нельзя добавлять
воду в
концентрированную
серную кислоту!
2) Тяжелая ( p = 1,84 г/см)
5) При добавлении H 2 O происходит
сильное разогревание

3. Химические свойства.
Разбавленная серная кислота проявляет все характерные свойства кислот:
- С оксидами металлов (реакция обмена)
H2SO4 + MeO = MeSO4 + H2O
2) C основаниями (реакция обмена)
H2SO4 + Me(OH)n = MeSO4 + H2O
3) C металлами (реакция замещения)
H2SO4 + Me = MeSO4 + H2
4) C солями (реакция обмена)
H2SO4 + MeR = MeSO4 + HR
( протекает при условии если в итоге образуется газ или осадок)
Условные обозначения: Me – металл, R – кислотный остаток, участвующий в образовании соли.
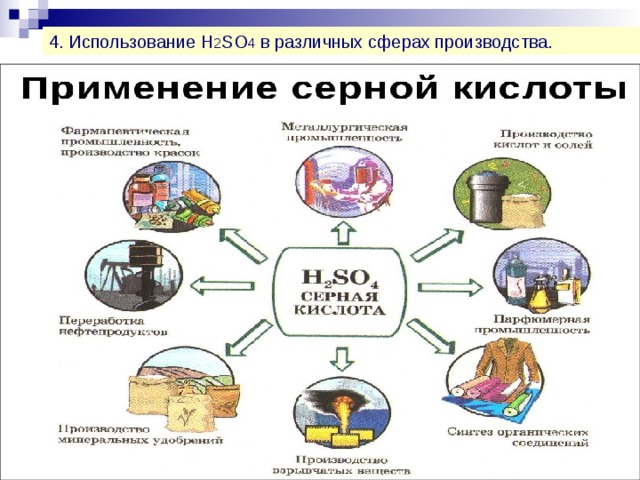
4. Использование H 2 SO 4 в различных сферах производства.

5. Нахождение серы в природе.

6. Решение упражнений.
Задание №1. Рассчитайте массовые доли всех химических элементов в формуле серной кислоты. На примере азотной кислоты HNO 3 .
HNO3
M = Ar (H) + Ar (N) + Ar (O)
M (HNO3) = 1 + 14 + (16*3) = 63 г/моль
w = Ar * n / M *100%
w (H) = 1 / 63 * 100% = 1 ,6 %
w (N) = 14/63 *100% = 22,2 %
w (O) = 16*3 /63 *100% = 76,2%

Задание № 2. Рассчитайте количество вещества H 2 SO 4 , если известно, что масса серной кислоты составляет 294 г.
Решение:
- Записываем формулу для нахождения количества вещества:
n = m / M
2. Вычисляем молярную массу серной кислоты:
М (H 2 SO 4 ) = 1*2 + 32 + 16*4 = 98 г/моль
3. Подставляем известные значения в формулу и находим количество вещества.
n ( H 2 SO 4 ) = 294 : 98 = 3 моль.
Ответ: 3 моль.

7. Домашнее задание:
Конспект в тетради. + Задание №3
Задание №3:
Количество вещества серной кислоты – 2 моль. Рассчитайте массу серной кислоты.




























