Муниципальное бюджетное образовательное учреждение
"Работкинская СШ"
Разработка урока по химии в 11 классе
по теме: "Гидролиз солей"
Тип урока: изучение нового материала.
Вид урока: проблемно-исследовательский.
Цель урока: сформировать у учащихся понятие гидролиза солей.
Задачи:
- Научить учащихся определять характер среды растворов солей по их составу, составлять ионные уравнения реакций гидролиза солей по первой стадии;
- углубить их знание свойств солей, понимание практического гидролиза в природе и жизни человека;
- развить мышление учащихся, умение делать логические выводы из наблюдений по опыту;
- закрепить умения и навыки химического эксперимента работать с таблицами, справочным материалом, дополнительной литературой.
Оборудование: учебник Габриелян О.Г., таблица растворимости, индикаторная шкала, штатив с пробирками; растворы фенолфталеина, метилового оранжевого, соляной кислоты, гидроксида натрия, хлорида железа(III), карбоната натрия, хлорида натрия.
Учитель химии: Медведева С.Н.
Ход урока:
Актуализация опорных знаний. Сегодняшний урок начнём с решения кроссворда. (слайд 2)
Работа с терминами. Решение кроссворда.
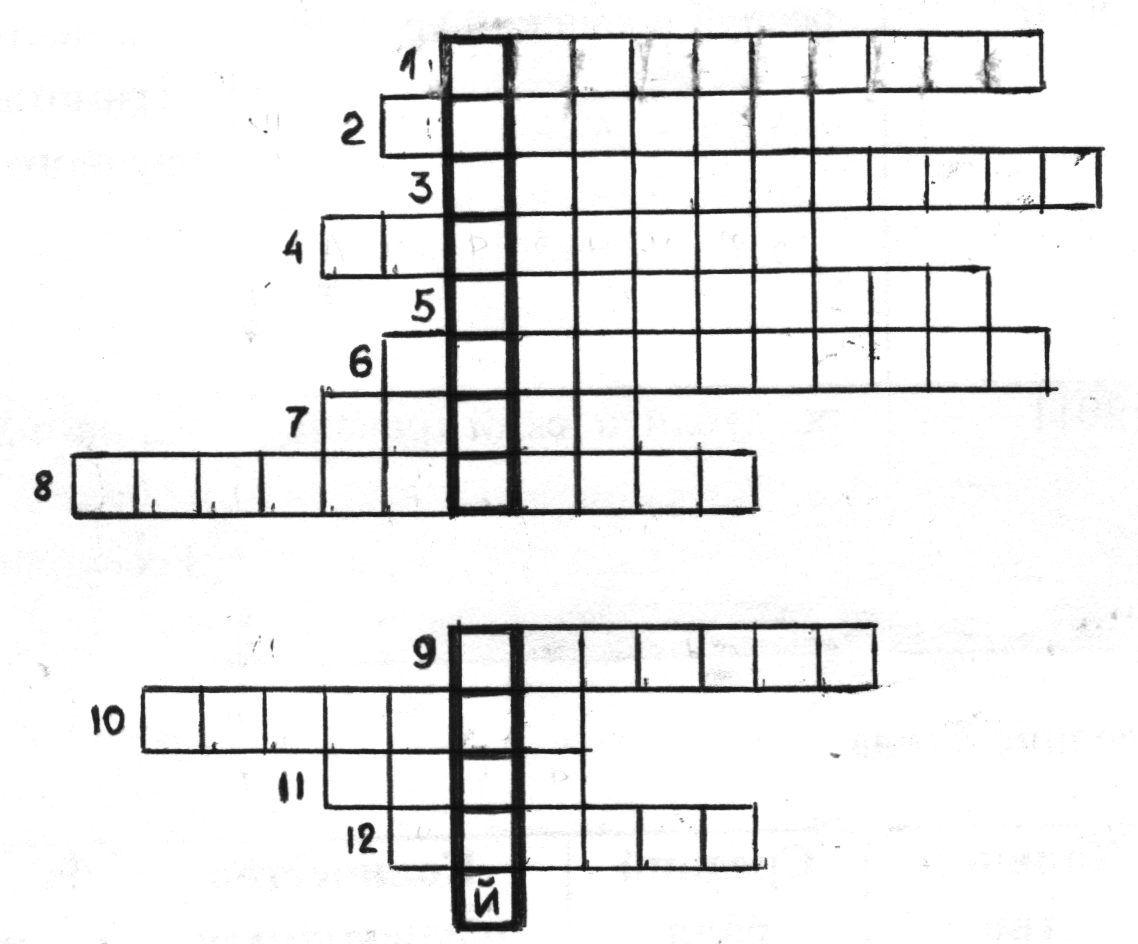
1.Процесс связывания частиц растворимого в воде вещества с молекулами воды. (гидратация)
2. Электролиты, диссоциирующие на катионы водорода и анионы кислотного остатка. (кислоты)
3. Процесс распада электролитов на ионы. (диссоциация)
4. Автор теории электролитической диссоциации. (Аррениус)
5. Электролиты, диссоциирующие на катионы металла и гидроксид-анионы. (основания)
6. Вещества, которые в растворах распадаются на ионы. (электролиты)
7. Отрицательно заряженный ион. (анион)
8. Роль воды при взаимодействии порошков алюминия с йодом. (катализатор)
9. Степень диссоциации каких электролитов стремится к единице? (сильных)
10. Гомогенная система, состоящая из молекул воды и частиц растворенного вещества. (раствор)
11. Электролиты, диссоциирующие на катионы металла и анионы кислотного остатка.(соли)
11. Растворимое основание. (щелочь)
2. Постановка проблемы.
Урок продолжаем решением задачи, текст которой вы видите на слайде. (слайд 3)
Задача: При сливании 25 г. 82% раствора хлорида железа(III) с избытком раствора кальцинированной соды выделяется газ и выпадает осадок. Определите массу выпавшего осадка.
Внимательно прочитаем и решим у доски эту задачу.
 Дано : Решение
Дано : Решение
ω (FeCl3) = 82% 2FeCl3 + 3Na2CO3 → 6 NaCl + Fe2(CO)3
![]() m (раствора) = 25 г.
m (раствора) = 25 г.
m (осадка) = ?
Ученики констатируют факт, что среди продуктов нет газа. Учитель рекомендует проверить по таблице растворимости соль Fe2(CO)3. Ученики устанавливают тот факт, что в таблице растворимости на месте этой соли стоит прочерк.
А может условия задачи ошибочны? Проверим опытным путём.
Один из учащихся напоминает правила ТБ (приложение 1) (слайд 4).
Опыт 1. Учащиеся сливают растворы хлорида железа (III) и карбоната натрия.
И так что мы с вами наблюдаем? (Выделяется бесцветный газ и выпадает коричневого цвета осадок)
Таким образом, проводя эксперимент, мы пришли к выводу, что в условии задачи все сформулировано правильно. А вот мы при составлении уравнения реакции что - то не учли. Что же? (Взаимодействием солей с водой при получении раствора)
Мы этого не учли, поэтому у нас не получается решение задачи. На этом уроке мы рассмотрим, как различные соли взаимодействуют с водой, а затем попробуем вернуться к решению этой задачи.
Давайте запишем тему урока: "Гидролиз солей". (Она высвечивается из решенного кроссворда). (слайд 5)
2. Изучение материала (основная часть).
Вопрос: "Что же называется гидролизом? ".
"Гидро" - вода, "лизис" - разложение.
Делается вывод, что гидролиз - это взаимодействие между некоторыми солями и водой.
Гидролиз соли - это реакции обменного взаимодействия вещества с водой, приводящие к их разложению. Известно, что молекула воды хотя и не значительно, но все же диссоциирует на ионы Н+ и ОН-. Для определения кислотности или щёлочности среды пользуются водородным показателем pH.
1) Если рН = 7,то среда нейтральная и при этом [Н+] = [ ОН-] = 10-7 моль/л.
2) Если рН 7,то среда щёлочная, при этом [Н+] -]
3) Если рН +] [ ОН-] (Слайд 6)
Для понимания сущности гидролиза проанализируем отношение солей к воде в присутствии индикатора. По изменению цвета индикатора можно сделать вывод, что некоторые соли реагируют с водой. Каким образом?
Опыт 2. Давайте проверим опытным путем. (слайд 7) Поместим в пробирку раствор хлорида железа(III) и поместим в него полоску лакмусовой бумажки. Что мы наблюдаем? (Окраска бумажки становиться красной).
Для сравнения в другую пробирку поместим раствор соляной кислоты и также поместим в него полоску лакмусовой бумажки. Что мы наблюдаем теперь? (Окраска становиться красной).
Какой вывод мы можем сделать на основе этих наблюдений? (Раствор соли хлорида железа(III) так же, как и раствор кислоты, имеет pH
Проанализируем состав соли. (слайд 8) Любая соль состоим из металла и кислотного остатка, и может быть получена при взаимодействии основания и кислоты. Каким основанием и какой кислотой может быть образована эта соль? Сильными или слабыми электролитами являются эти основание и кислота?(Соль FeCl3 образована слабым основанием Fe(OH)3-нерастворимое основание, сильной кислотой HCl )
Давайте составим уравнение реакции: молекулярное, полное и сокращенное ионные. (Слайд 9).
В растворе все соли диссоциируют на ионы
FeCl3 ↔ Fe3+ + 3Cl- , но в растворе есть еще диполь воды (H+ОН-)
Fe3++ HOH ↔ FeOH2+ + H+ среда кислая
FeCl3 + HOH ↔ FeOHCl2 + HCl
Это молекулярное уравнение первой стадии гидролиза, чаще всего он идет именно так поэтому мы на нем и остановимся.
Учащиеся делают вывод: гидролиз идет по слабому компоненту, а среда определяется сильным компонентом. Заполняют первую часть таблицы. (Приложение 3)
Опыт 3. Первая группа.Теперь проведем эксперимент с раствором карбоната натрия. Поместим в пробирку раствор данной соли и поместим в него полоску лакмусовой бумажки. Что вы наблюдаете? (Бумажка окрасилась в синий цвет)
Для сравнения в другую пробирку поместим раствор гидроксида натрия и также поместим в него полоску лакмусовой бумажки. Что мы наблюдаем? (Бумажка окрасилась в синий цвет).
Какой вывод мы можем сделать на основе этих наблюдений? (Раствор карбоната натрия так же, как и раствор гидроксида натрия, имеет pH 7, среда щелочная).
Используя таблицу растворимости, проанализируем состав соли. (Соль Na2CO3 образованна угольной кислотой H2CO3 и гидроксидом натрия NaOH )
Какой силы эти электролиты? (Угольная кислота - слабая, гидроксид натрия - сильное основание, щелочь).
Один из учащихся составляет уравнения реакции гидролиза записав его на доске.
Na2CO3 ↔ 2Na+ + CO32- H+ОН-
CO32- + HOH ↔HCO3-+ OH- среда щелочная
Na2CO3 + HOH ↔ NaOH + NaHCO3
(Слайд 10)
Учащиеся убеждаются в правильности вывода "что сильнее то и определяет среду", и вносят данные в таблицу.
Опыт 4. Вторая группа. Теперь поведем эксперимент с раствором хлорида натрия. Поместим в пробирку раствор данной соли и поместим в него полоску лакмусовой бумажки. Что вы наблюдаете? (Бумажка окрасилась в фиолетовый цвет)
Давайте для сравнения в пробирку поместим дистиллированную воду и также поместим в него полоску лакмусовой бумажки. Что мы наблюдаем? (Бумажка окрасилась в фиолетовый цвет)
Какой вывод мы можем сделать на основе этих наблюдений? (Раствор хлорида натрия так же, как и дистиллированная вода, имеет рН = 7,среда нейтральная)
Используя таблицу растворимости, проанализируйте состав соли(Соль NaCl образована кислотой НСl и гидроксидом натрия NaOH)
А какай силы эти электролиты (Соляная кислота - сильный электролит, гидроксил натрия сильное растворимое основание, щёлочь)
Один из учащихся составляет уравнение реакции гидролиза записывая его на доске (Слайд 11)
NaCl ↔ Na+ + Cl- H+ОН-
Гидролиз не идет, среда нейтральная.
Учащиеся делают вывод: силы электролитов равны, и вносят данные в таблицу.
А каким ещё может быть случай образования солей? (Соль может быть образованна слабым основанием и слабой кислотой).
Давайте обратимся за помощью к тексту учебника на странице 150.
Учащиеся читают текст учебника и выписывают уравнение реакции гидролиза сульфида алюминия.
Al2S3 + 6H2O → 2Al(OH)3↓ + 3H2S↑
Очевидно, такому же необратимому гидролизу подвергается карбонат железа(III) (Слайд 12)
Fe2(CO3)3 + 3HOH→ 2Fe(OH)3 ↓+ 3CO2↑
Учащиеся делают вывод: "соли, образованные слабым основанием и слабой кислотой, подвергаются необратимому гидролизу, то есть полностью разлагаются с образованием осадка и выделением газа". Вносят данные в таблицу.
3. Разрешение проблемы (решение задачи).
Вернёмся к задаче (Слайд 13), при решении которой зашли в тупик. Что нужно изменить в написании уравнения реакции? ( В левую часть добавить вещество H2O,в правой части соль карбонат железа(III)заменить на осадок гидроксида железа(III) и углекислый газ. Соль хлорид натрия образована сильным основанием и сильной кислотой, поэтому гидролизу не подвергаются, в уравнении реакции остается без изменений.)
Приглашается тот же ученик закончить решение задачи. Ученик изменяет уравнение реакции и производит расчеты .
2 FeCl3 +3Na2CO3 + 3H2O= 2Fe(OH)3 ↓ + 3CO2 ↓+ 6NaCl
(Масса выпавшего осадка составляет 13,5 г ).
Вот мы и решили задачу, определили газ, нашли массу осадка.
4. Значение гидролиза в природе и практической деятельности человека.
И так, у вас возник вопрос: "Так ли уж часто следует учитывать процессы гидролиза?" Давайте прочтем о значении гидролиза в природе и в жизни человека в учебнике на стр. 153-154.
Один из учеников выступает с сообщением. (слайд 14)
5. Подведение итогов.
Проверим результативность нашей совместной исследовательской деятельности и решим несколько заданий на закрепление материала. (слайды 15-18)
№1. Установите соответствие между названием соли и отношением её к гидролизу: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ СОЛИ | | ОТНОШЕНИЕ К ГИДРОЛИЗУ |
| A) карбонат натрия Б) хлорид натрия B) хлорид железа (III) Г) карбонат железа (III) | | 1) гидролизуется по катиону 2) гидролизуется по аниону 3) гидролизуется по катиону и аниону 4) не гидролизуется |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам. Ответ: 2423
№2. Установите соответствие между солью и окраской лакмуса в её растворе: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СОЛЬ | | ОКРАСКА ЛАКМУСА |
| A) хлорид железа (III)  Б) карбонат железа (III)  В) хлорид натрия  Г) карбонат натрия  | | 1) синяя 2) красная 3) фиолетовая |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам. Ответ: 2331
№ 3. Установите соответствие между названием соединения и средой его водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СОЕДИНЕНИЕ | | СРЕДА РАСТВОРА |
| A) фосфат калия Б) ацетат бария B) нитрат хрома(III) Г) нитрат натрия | | 1) нейтральная 2) кислая 3) щелочная |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам. Ответ: 3321
№ 4. Установите соответствие между названием соли и показателем рН его водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ СОЛИ | | рН РАСТВОРА |
| А) нитрит калия Б) сульфат натрия В) сульфит аммония Г) ацетат кальция | | 1) рН = 7 2) рН 7 3) рН |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам. Ответ: 2112
Итак, сегодня мы познакомились с явлением гидролиза солей. Прошу дать краткие ответы на мои вопросы.
1.Что такое гидролиз?
2.На какие группы мы разделили все соли?
3.Как происходит гидролиз каждой группы?
Домашнее задание :§18 , №3,7. (Слайд 19)






 Дано : Решение
Дано : Решение










