МБОУ «Мазунинская основная общеобразовательная школа»
Урок Химии
ТЕМА: «Состав воздуха»
9 класс
Учитель химии:
Кокшарова
Людмила Егоровна
2013 год.
Тема: «Состав Воздуха»
Цель урока: 1.Развитие познавательных способностей учащихся, углубление знаний о составе воздуха.
Задачи урока:
1.Обобщить и систематизировать знания учащихся о составных частях воздуха.
2.Установить межпредметные связи между химией, литературой, экологией
по данной теме.
3. Воспитывать у ребят культуру поведения, общения друг с другом в процессе учебной деятельности.
Оборудование: мультимедийный проектор, компьютер
Эпиграф к уроку:
«Воздух вызывает, как дух жизни, дыхания и теплоту сердца. Люди могут выжить там лишь, где им подводится свежий и годный для дыхания воздух…» энциклопедия средневековых знаний «Книга Верных братьев» (слайд №3)
Вступительное слово учителя.
Земная атмосфера, сформированная в ходе длительной геобиохимической эволюции – это та часть природной среды, которой человек (и почти все живые организмы) пользуются. В сутки человеку необходимо не менее 12 кг воздуха (в 8 раз больше, чем воды, и в 12 раз больше, чем пищи).
Воздух – один из самых нужных компонентов для жизни человека (недаром о чем-то жизненно - важном говорят: необходим как воздух), ведь если без пищи человек может прожить 30, без воды – 10 дней, то без воздуха – лишь считанные минуты.
И так, разговор пойдет о воздухе – океане из газов, на дне которого живут люди, животные и растения.
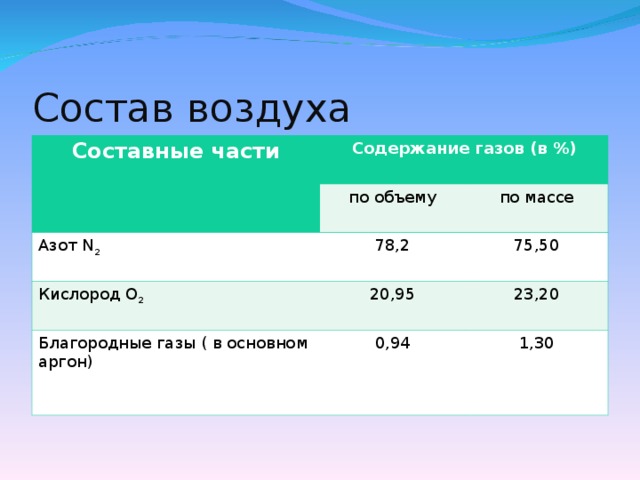
2. Состав воздуха. Давайте вспомним из чего состоит воздух. /выслушать ответы детей.)(4 слайд)
-Почему мы не можем дышать чистым кислородом?
(Согласно современной концепции, человеческий организм приспособился в ходе эволюции к дыханию воздухом, а не чистым кислородом. В случае же дыхания чистым кислородом ускоряются окислительные процессы обмена веществ и человеческий организм быстрее « сгорает». )
В произведении Ж. Верна « Опыт доктора Окса» описано воздействие чистого кислорода на живые организмы: «…стоило бросить в землю семечко, как из него поднимался зелёный стебелёк, который рос не по дням, а по часам… Кочаны капусты превращались в кусты, а грибы становились величиной с зонтик… Но, увы! Все эти растения быстро блекли и умирали, сожжённые, истощённые, обессиленные… Все кикандонцы стали теперь форменными обжорами. В городе стали потреблять в три раза больше продуктов».
Так что Ж. Верн в чём – то был прав.
- Какова роль азота в воздухе?
Кислород, азот и благородные газы это постоянные составные части воздуха.
- А что ещё может находиться в воздухе, кроме кислорода, азота, благородных газов. /выслушать ответы детей/


 Воздух (слайд №5)
Воздух (слайд №5)
Постоянные составные части воздуха Случайные составные части
(О2; N2; благородные газы) (пыль, микроорганизмы, пыльца
растений, некоторые газы)
Переменные составные части воздуха
( СО2; водяные пары , О3 )
В состав воздуха входят кислород и озон – это аллотропные видоизменения химического элемента кислорода. Давайте вспомним:
- Что такое аллотропия?
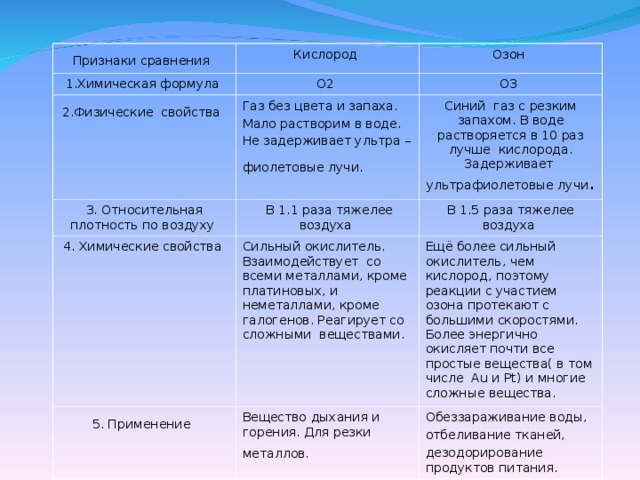
- Давайте сравним свойства этих веществ.
используя материал учебника на странице 71-73 заполнить таблицу в тетради.( приложение№1) слайд №6
Вывод по таблице:/ в тетрадь/
Общее:
1. Оба вещества – газы при обычных условиях.
2. Оба простые вещества.
3. Оба – образованы одним и тем же элементом – кислородом, т.е. являются аллотропными модификациями его.
4. Оба – сильные окислители.
Признаки различия:
1. Физические свойства
2.Биологические свойства
3. Химические свойства
4. Применение
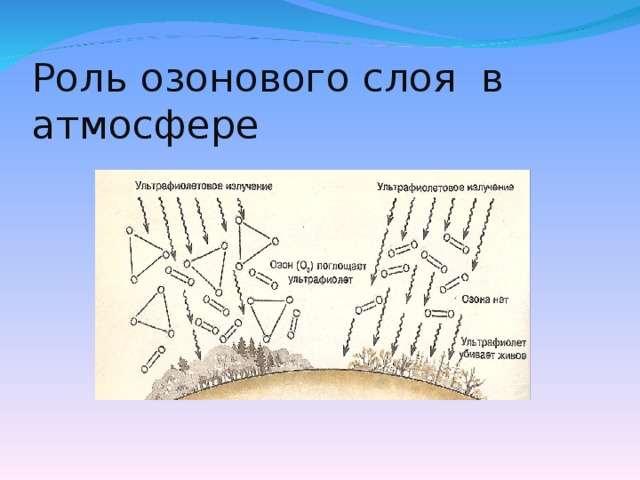
Слайд №7 Озон имеет очень большое значение для сохранения всего живого на нашей планете. Озоновый слой, расположенный на высоте 20 – 25 км, задерживает губительные ультрафиолетовые лучи, которые разрушительно действуют на клетки живых организмов. Но постоянно происходит истощение озонового слоя. Какие вещества оказывают разрушающее действие на озоновый слой. (Приложение №2) -доклад
- Эта проблема не безразлична и многим поэтам. Послушайте и пропустите через себя стихотворение М. Ножкина «Дыра».(Приложение №3) слайд №8
Подведение итогов:
Тест ( Приложение№4).
Оценки за урок
Домашнее задание: параграф 16 ,записи в тетради. с.74 упр.1-2
Литература
1. Кузнецова Н.Е. Титова И.М. Гара Н.Н. Химия 9 класс: Учебник для учащихся общеобразовательных учреждений.- М.: Вентана-Граф, 2008- 288с.:
2. Криксунов Е.А. и др. Экология : 9 класс . М.: Дрофа, 1995.- 240с.
3. Интернет ресурс: http://www.rusmissia.ru/Zakat/3-1-4.html
4. Интернет ресурс: http://www.coolreferat.com/%D0%9E%D0%B7%D0%BE%D0%BD%D0%BE%D0%B2%D1%8B%D0%B9_%D1%81%D0%BB%D0%BE%D0%B9_3
5. Интернет ресурс: http://www.ecology-portal.ru/publ/9-1-0-144
Приложение №1
Используя материал учебника, заполни сравнительную таблицу.
Сравнение аллотропных модификаций кислорода
| Признаки сравнения | Кислород | Озон |
|
1.Химическая формула | О2 | О3 |
|
2.Физические свойства | Газ без цвета и запаха. Мало растворим в воде. Не задерживает ультра – фиолетовые лучи. | Синий газ с резким запахом. В воде растворяется в 10 раз лучше кислорода. Задерживает ультрафиолетовые лучи. |
|
3. Относительная плотность по воздуху | В 1.1 раза тяжелее воздуха | В 1.5 раза тяжелее воздуха |
|
4 Химические свойства | Сильный окислитель. Взаимодействует со всеми металлами, кроме платиновых, и неметаллами, кроме галогенов. Реагирует со сложными веществами. | Ещё более сильный окислитель, чем кислород, поэтому реакции с участием озона протекают с большими скоростями. Более энергично окисляет почти все простые вещества( в том числе Au и Pt) и многие сложные вещества. |
|
5. Применение | Вещество дыхания и горения. Для резки металлов. | Обеззараживание воды, отбеливание тканей, дезодорирование продуктов питания. |
Используя материал учебника, заполни сравнительную таблицу.
Сравнение аллотропных модификаций кислорода
| Признаки сравнения | Кислород | Озон |
|
1.Химическая формула |
|
|
|
2.Физические свойства |
|
|
|
3. Относительная плотность по воздуху (D)
Mr (воздуха)= 29 |
|
|
|
4 Химические свойства |
|
|
|
5. Применение |
|
|
Приложение №2
Причины истощения озонового слоя
Основной причиной истощения озонового слоя является применение людьми хлорфторуглеродов (фреонов), широко используемых в производстве и быту в качестве хладореагентов, пенообразователей, растворителей, аэрозолей. Фреоны интенсивно разрушают озон. Сами же они разрушаются очень медленно, в течение 50 - 200 лет.
Впервые "дыра" в озоновом слое, защищающем нашу планету от ультрафиолетовых лучей, была обнаружена около 35 лет назад. Тогда ее размер в три раза превышал площадь Австралии.
Применение озоноразрушающих химикатов было запрещено Монреальским протоколом 1987 года, который на сегодняшний день ратифицировали 180 стран.
На данный момент есть свидетельства того, что озоновый слой реагирует на уменьшение уровня содержания хлора в атмосфере, благодаря сокращению применения фреонов.
По данным группы японских учёных к 2020 году озоновая дыра над Антарктидой начнёт уменьшаться и может исчезнуть к 2050 году благодаря снижению выброса в атмосферу хлорфторуглеродов и других разрушающих озоновый слой газов. С ними также соглашаются и другие исследователи из разных стран
!
Озонная дыра над Антарктидой!
Приложение № 3
М. Ножкин «Дыра»
А не было её ещё вчера
Зачем она учёными открыта?
Неужто в вечность нам уже пора?
Неужто судный день для бела света
Подкрался вдруг космической тропой,
И под жестоким ультрафиолетом
Нам корчиться беспомощной толпой?
Неужто всё, что дорого и свято
В единой человеческой судьбе,
Вдруг будет уничтожено, распято,
Потоками диапазона «Б»?
На миллион квадратных километров
Пробита наша вечная броня,
И даже антарктические ветры
От страха взвыли, душу леденя?
Великая озонная защита
Разорвана отныне навсегда,
Виновников незримых не ищите,
Виновники мы с вами, - господа!
Природу мы так рьяно покоряем,
Уродуем творение творца,
Долбим, сверлим, копаем, ковыряем,
И травим, и взрываем без конца.
Безумие своё реализуя,
Давно уж мирозданию хамим,
Давно на всю галактику газуем,
Давно на всю Вселенную дымим.
И с мудростью хвостатых наших предков,
И с вечным нетерпением ножа,
Всё спорим – у кого же лучше клетка
И у кого добрее сторожа?...
Озонная дыра над Антарктидой,
Как рана в сердце, как пожар в груди,
Одумайся, беспечный индивидум.
И в будущее взор обороти!
И ощути всей плотью знак сей грозный,
И хоть на миг забудь о барышах,
Одумайся, пока ещё не поздно.
Пока не сделал свой последний шаг,
Пока другие дыры не пробиты
На нашем общем малом корабле,
Пока одна дыра над Антарктидой,
Пока один Чернобыль на Земле…
Приложение 4
Тест по теме «Воздух. Его состав»
1. Значительно тяжелее воздуха
2. Может использоваться для обеззараживания водопроводной воды
3. Газ с резким запахом
4. Жизнь на Земле без этого газа невозможна
5. Образуется в процессе фотосинтеза
6. В больших концентрациях убивает живые организмы
7. Энергично реагирует со многими веществами
8. В лаборатории получают разложением перманганата калия
Тест по теме «Воздух. Его состав»
1. Значительно тяжелее воздуха (О3 )
2. Может использоваться для обеззараживания водопроводной воды (О3 )
3. Газ с резким запахом (О3 )
4. Жизнь на Земле без этого газа невозможна (О 2 ) или (О3 )
5. Образуется в процессе фотосинтеза (О 2 )
6. В больших концентрациях убивает живые организмы (О3 )
7. Энергично реагирует со многими веществами (О3 )
8. В лаборатории получают разложением перманганата калия (О 2 )








 Воздух (слайд №5)
Воздух (слайд №5)