Просмотр содержимого документа
«Урок по теме валентные состояния атома углерода»
Тема: «Валентные состояния атома углерода»
Цели урока:
Образовательная – вызвать объективную необходимость изучения нового материала, способствовать овладению знаниями по теме “Валентные состояния атома углерода, познакомить учащихся с понятием гибридизация и валентными состояниями атома углерода, научить определять по структурной формуле вещества гибридное состояние и форму атома углерода.
Развивающая – формировать умение устанавливать причинно-следственные связи, систематизировать материал, делать выводы по теме; способствовать развитию мышления, познавательных и общетрудовых умений.
Воспитательная – формировать добросовестное отношение к учебному труду, положительной мотивации к учению, коммуникативных умений; убеждать в необходимости привлечения средств науки химии к пониманию и описанию процессов, идущих в окружающем мире.
Задачи урока:
Изучить строение атома углерода в трёх валентных состояниях, понятие гибридизации; типы химической связи в молекулах алканов, алкенов, алкинов; пространственное строение молекул. Продолжить формирование умений в моделировании химических явлений.
Развитие умений обобщать и систематизировать знания, относящиеся к разным классам углеводородов; выявлять сущность свойств углеводородов и взаимосвязь между химической связью в органических соединениях и их строением и составом.
Продолжить формирование диалектико-материалистического мировоззрения на примере молекулы метана, этилена, ацетилена. Развитие умений в установлении причинно-следственных связей.
Методы: репродуктивный, частично-поисковый, исследовательский.
Форма организации занятий: словесный (лекция), наглядный, проблемное изложение, работа с книгой, фронтальный опрос, самостоятельная работа.
Форма организации работы в классе: индивидуальная, фронтальная.
Ход урока
I. Организационный этап
II. Актуализация знаний.На этапе актуализации знаний ученики вспоминают типы химической связи, кратность ковалентных связей, 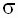 - связь и
- связь и 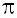 -связь, теорию строения органических веществ и то, что углерод в органических соединениях четырехвалентен.
-связь, теорию строения органических веществ и то, что углерод в органических соединениях четырехвалентен.
III. Постановка цели и задач урока.
Атом углерода – основа всех органических соединений, поэтому его электронное строение представляет особый интерес при изучении органической химии.
К доске выходит ученик и по положению в ПСХЭ Д. И. Менделеева дает характеристику строения атома углерода. (На доске представлена схема строения атома углерода) Уч- ся объясняет нормальное и возбужденное состояние атома углерода
IV. Изучение нового материала.
Поглощенная энергия (при возбуждении атома углерода) затем с избытком компенсируется при образовании четырех химических связей. Как вы считаете, энергетические состояния этих электронов одинаковы?
Ученики: поскольку это разные подуровни, то они должны отличаться энергиями.
Учитель: на самом деле в симметрично построенных молекулах, таких как CH4 и CCI4 и др., четыре химические связи атома углерода с другими атомами практически одинаковы. Чтобы объяснить это противоречие, физиками было введено понятие о гибридизации (смешении) электронных орбиталей (слайд 3). Согласно этой гипотезе, электроны находятся не на “чистых” s- и р-орбиталях, а на усредненных, обладающих одинаковой энергией. Такие орбитали называют гибридными. При смешении одной 2s- и трех 2р-орбиталей образуются четыре одинаковые sp3-гибридные орбитали (слайды 4, 5).Их формы отличаются от форм исходных 2s- и 2р-орбиталей, один из “лепестков” этой орбитали значительно вытянут в одну сторону от ядра. Все они строго ориентированы в пространстве под углом 109о28', образуя геометрическую фигуру – тетраэдр.
Заполнение таблицы «Валентные состояния атома углерода».
Учитель: для атома углерода возможны три типа гибридизации, три валентных состояния атома углерода – sp3, sp2 и sp. Два новых состояния, чем отличаются от первого?
Ученик: участвуют не все р-орбитали.
Учитель объясняет второе валентное состояние и образование двойной связи. . А как же возникает тройная связь?
Ученик: в sp-гибридизации должны перекрываться только 2s- и одна 2р-орбиталь.
Учитель: объяснение третьего валентного состояния атома углерода (На протяжении прохождения нового материала учащиеся составляют таблицу в тетрадях с опорой на презентацию учителя (тема, понятие гибридизации, валентные состояния атома углерода).
V. Закрепление изученного материала.
Собрать шаростержневые молекулы метана, этилена и ацетилена.
Показать валентные углы.
Назвать тип гибридизации для каждой связи.
Какой тип гибридизации не существует и почему?
Определите тип гибридизации каждого атома углерода в молекулах веществ
1) СН3 - СН2 - СН3; 2) СН2 = СН - СН2 - СН3; 3) СН 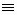 С - СН2 - СН3
С - СН2 - СН3
VI. Рефлексия
Достигли ли вы цели урока? В какой степени?
Какие вопросы вызвали наибольшее затруднение?
VII. Домашнее задание §4, № 1, 2
















