Кремний и его соединения
Цели урока: дать общую характеристику кремния, рассмотреть его природные соединения; провести сравнительный анализ соединениями углерода; сформировать представление о свойствах кремния.
Планируемые результаты: уметь характеризовать элемент кремний на основании его положения в ПСХЭ Д.И. Менделеева и строения атома; знать физические и химические свойства кремния, его важнейшие природные соединения; уметь составлять уравнения химических реакций с участием кремния и уравнивать их методом электронного баланса, проводить сравнительный анализ двух оксидов: углерода и кремния.
Тип урока: изучения нового материала
Оборудование и реактивы: компьютер, мультимедийный проектор, экран, презентация в программе PowerPoint, образцы природных соединений кремния (гранит, горный хрусталь, кварц и т.д.),раствор силиката натрия (канцелярский клей), соляная или серная кислота, раствор гидроксида натрия, речной песок, вода, лакмус, пробирки, штатив, стеклянные палочки, учебник.
Ход урока
Мотивационный этап
Сегодня на уроке мы с вами будем знакомиться с химическим элементом, роль которого для всего живого переоценить невозможно.
Подсказка 1. Это второй по распространенности в земной коре химический элемент.
Подсказка 2. Что объединяет эти картинки? (Слайд 1)
Сосед углерода привык к работе,
Замену ему нигде не найдете.
Если бы этот пропал элемент,
Где бы мы взяли кирпич и цемент,
Чем бы стеклили окно, и куда
Делись бы кварц, и фарфор, и слюда?
Пляжи песчаные, толщи подземные -
Где бы все это было без кремния?
Учитель. Да, ребята, и калькуляторы на солнечных батарейках и песок в песочных часах и даже большие солнечные панели на космическом корабле – объединяет именно кремний.
В чистом виде кремний был выделен в 1811 году французскими учёными Жозефом Луи Гей-Люссаком и Луи Жаком Тенаром.
В 1825 году шведский химик Йёнс Якоб Берцелиус действием металлического калия на фтористый кремний SiF4 получил чистый элементарный кремний. Новому химическому элементу было дано название «силиций» (от лат.Silex — кремень). Русское название «кремний» введено в 1834 году российским химиком Германом Ивановичем Гессом. В переводе c др.-греч. Κρημνός — «утёс, гора».
В природе кремний – второй по распространенности химический элемент. Чаще всего он встречается в виде кремнезёма. Это соединение кислорода с кремнием – оксид кремния(IV) SiO2 или песок. (Слайд 2), материал, который встречается повсеместно.
Из оксида кремния и силикатов состоит 87% земной коры (Слайд 3). Кроме песка, оксид кремния входит в различные минералы (слайды 4-5), горный хрусталь, опал, халцедон, яшму, кварц.
Из разновидностей минералов на основе оксида кремния (IV)(кремня, халцедона и др.) первобытные люди изготавливали орудия труда. Именно кремень – этот невзрачный и не очень прочный камень, положил начало каменному веку – веку каменных орудий труда.
Второй тип природных соединений кремния – силикаты. Самые распространённые алюмосиликаты: гранит, различные виды глин, слюды (слайд 6)
Не содержащий алюминия силикат – асбест (из него изготавливают огнестойкие ткани).
Оксид кремния (IV) необходим и растениям, и животным. Он придаёт прочность стеблям растений и покровам животных (камыши твёрдо стоят, осока режет, как лезвие, чешуя рыб, панцири насекомых, крылья бабочек, перья птиц, шерсть животных содержат оксид кремния (IV) (слайд 7)
Кремний придаёт гладкость и прочность костям человека, входит в состав низших живых организмов – диатомовых водорослей и радиолярий (образует их скелеты) (слайд 8).
Запишите тему урока «Кремний и его соединения».
Актуальность темы: Как Вы думаете ребята это важная тема? Ответим на этот вопрос, прочитав текст рабочего листа.
В эпоху палеолита, т.е. 800 тысячелетий тому назад, кремень помог человеку в борьбе за жизнь. Этот твердый камень, от которого легко отбить кусок с острыми краями, послужил материалом для первого оружия (наконечником копий и стрел) и первых орудий труда (топоров, ножей и т.д.).
Позднее, когда на смену камню пришли медь, бронза, железо, кремень нашел использование в виде огнива.
Мировые компьютерные компании находятся в «Кремниевой долине». Именно кремний служит материалом для изготовления современных процессоров.
Современный процессор является самым сложным готовым продуктом на Земле. Инженеры-технологи научились изготавливать процессоры из песка.
Изучение нового материала
1 блок. Кремний как элемент
Опишите положение кремния в ПСХЭ Д.И. Менделеева, составьте схему строения атома и электронную формулу кремния. Возможные степени окисления. (1 - й ученик).
2-й ученик характеристика положения углерода в таблице химических элементов Д.И. Менделеева, возможные степени окисления, построение электронной формулы атома углерода.
3 ученик делает обобщение:
-У кремния электроны расположены на трёх энергетических уровнях, а у углерода – на двух, следовательно, окислительные (неметаллические) свойства у кремния выражены слабее, а восстановительные (металлические) – сильнее.
2 блок. Кремний как простое вещество
В природе кремний не встречается в свободном состоянии, поэтому его получают восстановлением оксида кремния (IV) магнием или углем.
Закончите уравнения реакций: лабораторный способ получения
SiO2 +2Mg = 2MgO + Si
SiO2 + 2C = 2CO + Si промышленный способ (при температуре 19000С)
При этом получается кремний с примесями. Для получения чистого кремния сначала получают карбид кремния, из него – летучее водородное соединение – силан. Силан разлагают без доступа кислорода на водород и чистый кремний. Этот кремний затем используют для изготовления солнечных батарей и в электронике.
Простое вещество кремний встречается :
А) в аморфном виде – белый порошок (без примесей) или коричневый (с примесями), обладает высокой реакционной способностью
Б) в кристаллическом виде – твёрдый, хрупкий, непрозрачный, серый, с металлическим блеском полупроводник (т.е его электропроводность при нагревании повышается), имеет атомную кристаллическую решетку, подобную алмазу. Химически пассивен.
Физические константы кристаллического кремния:
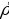 =2.33 г/см3, tпл = 14150С, tкип 35000С.
=2.33 г/см3, tпл = 14150С, tкип 35000С.
Химические свойства кремния:
а) кремний - восстановитель
Все реакции протекают при нагревании!
Si + O2 = SiO2 (оксид кремния (IV))
Si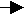 0 – 4e- → Si+4 восстановитель
0 – 4e- → Si+4 восстановитель
O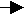 2 + 4e- →2O-2 окислитель
2 + 4e- →2O-2 окислитель
2. Si + 2Cl2 = SiCl4 (хлорид кремния)
3.Si + 2S = SiS2 (сульфид кремния)
20000C
4. Si + C = Si+4C-4 (карбид кремния или карборунд, по твёрдости близок к алмазу)
4. Si + 2H2O(пар) = SiO2 + H2
5. Si + 2NaOH(конц.) + H2O = Na2SiO3 + 2H2
Видеофрагмент взаимодействие кремния с щелочами.
б) кремний – окислитель
Si + 2Ca = Ca2Si (силицид кальция)
С водородом не взаимодействует.
Силан (SiH4 - бесцветный газ, ядовит) получают разложением силицидов металлов кислотой: Mg2Si + 2H2SO4 → SiH4 + 2MgSO4
Вывод: свойства кремния и углерода похожи. Оба неметалла взаимодействуют с кислородом, галогенами, серой, металлами. Но в отличие от углерода кремний напрямую не соединяется с водородом.
3 блок. Соединения кремния.
Оксид кремния (IV), кремнезем – SiO2.
К какой группе оксидов он относится? Кислотный. Какими свойствами обладают кислотные оксиды?
- взаимодействуют с водой
- с основными оксидами
-со щелочами.
Но с водой оксид кремния не взаимодействует! Давайте убедимся в этом, проведя опыт. (Техника безопасности!)
Лабораторный опыт. Насыпьте немного речного песка в пробирку, прилейте воды, взболтайте. Что наблюдаете? Прилейте к полученной смеси раствор лакмуса. Произошли ли изменения? Нет, значит, реакция среды в полученном растворе не изменилась.
Запомните, что оксид кремния не растворяется в воде. Это связано с тем, что оксид кремния имеет атомную кристаллическую решетку, сходную с алмазом.
Но с щелочами и основными оксидами может реагировать при нагревании.
Продолжите уравнения реакций взаимодействия оксида кремния с оксидом натрия и гидроксидом натрия.
Сравнительный анализ оксидов углерода (IV) и оксида кремния (IV)
| Свойства CO2 | Свойства SiO2 |
| Кислотный оксид |
| Молекулярная кристаллическая решетка | Атомная кристаллическая решетка |
| Бесцветный газ, при сжатии и охлаждении легко переходит в жидкое и твердое состояние (сухой лед). | Кристаллическое, твердое вещество, тугоплавкое, высококипящее. Имеет несколько модификаций. |
| Химические свойства |
| H2O + CO2 ↔H2CO3 | SiO2 + H2O≠ |
| CO2 +CaO = CaCO3 | SiO2 + CaO = CaSiO3 |
| CO2 + Ca(OH)2 =CaCO3↓+H2O | SiO2 + 2NaOH = Na2SiO3 +H2O |
| CO2 +2Mg =2MgO+C | SiO2 +2Mg = 2MgO +Si |
| C +CO2= 2CO↑ | SiO2 +2C = Si + 2CO↑ |
Вывод: физические свойства резко различаются, но химические свойства схожи. Отличие состоит в различном отношении к воде.
Особым свойством кремнезёма является его способность реагировать с плавиковой (фтороводородной) кислотой.
Если у кремния есть кислотный оксид, то есть и соответствующая оксиду кислота. Кремниевую кислоту получают при действии кислот на растворы ее солей. При этом она выпадает в виде студенистого осадка.
Лабораторный опыт. Давайте получим ее вытеснением из раствора соли более сильной кислотой. Для этого в пробирку налейте 1 мл раствора силиката натрия (концентрированный раствор силиката натрия – это канцелярский или силикатный клей), добавьте столько же серной кислоты. Получается полупрозрачный осадок кремниевой кислоты.
Запишем уравнение реакции в молекулярном, ионном и сокращенном ионном видах.
Na2SiO3 + H2SO4 = Na2SO4 + H2SiO3 ↓
SiO3- + 2H+ = H2SiO3↓
Добавим к полученному осадку раствор гидроксида натрия и перемешайте стеклянной палочкой. Что наблюдаете? Запишите уравнение реакции в молекулярном, полном и сокращенном ионном видах.
H2SiO3 +2 NaOH = Na2SiO3 + 2H2O
H2SiO3 + 2Na+ + 2OH- = 2Na+ + SiO3- + 2H2O
H2SiO3+ 2OH- = SiO3- + 2H2O
При высыхании массы кремниевой кислоты образуется высокопористое вещество – силикагель, широко применяемое в качестве адсорбента. (Вспомним, что такое адсорбция).
Рассказать о применении силикагеля.
При нагревании кремниевая кислота теряет воду и превращается в оксид кремния.
III. Заключительная часть.
Первичное обобщение приобретённых знаний и рефлексия:
Итак, сегодня на уроке мы познакомились с кремнием, узнали о строении его атома, свойствах и получении. Рассмотрели соединения кремния - оксид, кислота, бинарные соединения.
Назовите высшую и низшую степени окисления кремния.
Какова формула и характер оксида?
Какова формула гидроксида кремния (кремниевой кислоты), её особенность?
Оценивание работы на уроке учащихся, выставление отметок в дневник и журнал.
IV. Домашнее задание: параграф 31, составить задачу по любому уравнению из темы и решить её (для сильных учеников), задание 2, 4 на стр. 185.
МБОУ Сещинская СОШ
ПЛАН – КОНСПЕКТ
урока химии в 9 классе «Кремний и его соединения»
Выполнила: Карнаух Ю.В., учитель химии МБОУ Сещинской СОШ
18 февраля 2016 г





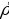 =2.33 г/см3, tпл = 14150С, tкип 35000С.
=2.33 г/см3, tпл = 14150С, tкип 35000С.









