
Здравствуйте, ребята. Мы сегодня повторяем основные сведения по неорганической химии. Рассмотрите схемы в презентации, вспомните теорию по строению атома, классификации веществ и химических реакций. Выполните задания, данные на слайдах, в рабочей тетради.
Вещества
9 класс
Повторение курса химии 9 класса
Презентацию подготовила учитель химии МБОУ «СШ № 19 с УИОП» г. Заволжье Нижегородской области Хрипунова Татьяна Вадимовна
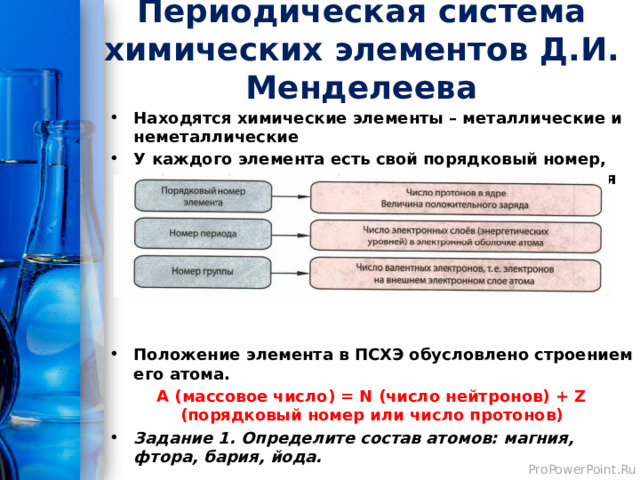
Периодическая система химических элементов Д.И. Менделеева
- Находятся химические элементы – металлические и неметаллические
- У каждого элемента есть свой порядковый номер, период, группа, подгруппа, относительная атомная масса
- Положение элемента в ПСХЭ обусловлено строением его атома.
А (массовое число) = N (число нейтронов) + Z (порядковый номер или число протонов)
- Задание 1. Определите состав атомов: магния, фтора, бария, йода.

Изменение свойств элементов в периоде и группе
Задание 2. Сравните металлические и восстановительные свойства :
а) натрия, магния и алюминия; б) магния, кальция и стронция; неметаллические и окислительные свойства:
а) азота, кислорода и фтора, б) азота, фосфора и мышьяка.
Покажите знаками , =
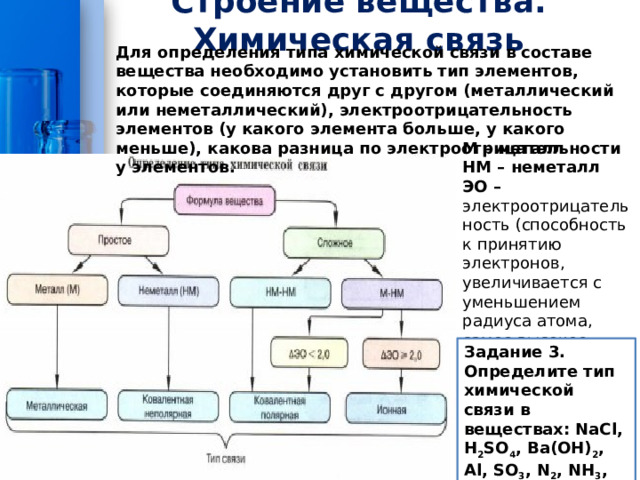
Строение вещества. Химическая связь
Для определения типа химической связи в составе вещества необходимо установить тип элементов, которые соединяются друг с другом (металлический или неметаллический), электроотрицательность элементов (у какого элемента больше, у какого меньше), какова разница по электроотрицательности у элементов.
М – металл
НМ – неметалл
ЭО – электроотрицательность (способность к принятию электронов, увеличивается с уменьшением радиуса атома, самое высокое знание ЭО имеет фтор)
Задание 3. Определите тип химической связи в веществах: NaCl, H 2 SO 4 , Ва(ОН) 2 , Al, SO 3 , N 2 , NH 3 , NH 4 Cl

Тип химической связи связан с типом кристаллической решетки в веществе
Задание 4. Определите тип кристаллической решетки в молекуле углекислого газа, сульфиде натрия, хлороводороде, железе, оксиде алюминия, графите, гидроксиде кальция.

Определение степени окисления (с.о.) элементов в веществе
- Степень окисления водорода в сложных веществах +1, кроме соединений с металлами IA и IIA-групп (в гидридах с.о. водорода -1)
- Почти во всех веществах с.о. кислорода -2, кроме соединений кислорода с фтором (во фторидах с.о. кислорода +1 или +2), и в пероксидах – у кислорода с.о. -1
- Максимальная с.о. металлов и неметаллов равна номеру группы (для элементов главных подгрупп)
- Минимальная с.о. неметаллов (кроме водорода) равна №группы минус 8 (например, для хлора 7-8=-1)
- Сумма всех с.о. в соединении равна нулю, а в ионе – заряду иона
- С.о. центрального атома в кислородсодержащей кислоте совпадает со с.о. центрального атома в ее соли (в H 2 SO 4 у атома серы с.о. +6, во всех сульфатах у серы также с.о. +6, например, в Na 2 SO 4 )
Задание 5. Определите с.о. элементов в соединениях: Na 2 MnO 4 , K 2 Cr 2 O 7 , NH 3 , (NH 4 ) 2 CO 3 , О 2 .

Основные классы неорганических веществ
Вспомните определения и состав каждого класса веществ, указанных в таблице

Классификация сложных веществ

Химические реакции и физические явления
- Химические реакции отличаются от физических явлений тем, что в результате химической реакции всегда образуются новые вещества. Во время физических явлений может измениться форма, агрегатное состояние, размеры, но состав вещества остается постоянным.
- Признаки химической реакции
(характеризуют возможное протекание
химической реакции):
- Изменение цвета
- Выпадение или растворение осадка
- Выделение газа
- Появление запаха
- Изменение окраски индикаторов
- Появление света
- Поглощение или выделение тепла
Задание 6. Выпишите отдельно физические и химические явления цифрами:
- Горение спички
- Кипение воды в чайнике
- Скисание молока
- Образование инея на ветке
- Ржавление железа на автомобиле
- Взрыв метана в газовой плите
- Растягивание медной проволоки
- Образование сосулек на крыше

Классификация химических реакций
- 1) по тепловому эффекту – эндотермические и экзотермические
- 2) по числу реагентов и продуктов реакции – замещения, соединения, разложения, обмена
- 3) по использованию катализатора – каталитические и некаталитические
- 4) по фазе (агрегатному состоянию) – гомогенные и гетерогенные
- 5) по направлению – обратимые и необратимые
- 6) по изменению с.о. – ОВР и неОВР
Задание 7. Охарактеризуйте по всем известным вам признакам реакцию окисления оксида серы (IV) до оксида серы (VI) c участием катализатора V 2 O 5 . Составьте уравнение реакции. Составьте для нее электронный баланс, определите окислитель и восстановитель.

Сильный окислитель – перманганат калия (марганцовка) KMnO 4 – в разных средах восстанавливается до соединений марганца в разных степенях окисления
В некоторых реакциях на состав продукта ОВР влияет температура (например, реакции галогенов с растворами щелочей при комнатной температуре и при нагревании)
Задание 8. Составьте согласно схемы уравнения реакции взаимодействия хлора с гидроксидом калия при комнатной температуре и при нагревании. Сосчитайте сумму коэффициентов во втором уравнении (при нагревании).

Теория электролитической диссоциации С. Аррениуса
- Электролитическая диссоциация – распад электролита в растворе или расплаве на ионы (положительные – катионы и отрицательные - анионы)
- Диссоциация электролита характеризуется степенью электролитической диссоциации α:
α = Nд / Nр , где Nд – количество вещества электролита, распавшегося на ионы,
Nр – количество вещества электролита в растворе
- Степень диссоциации зависит от природы электролита и его концентрации (чем больше концентрация, тем меньше α)
- Многоосновные кислоты диссоциируют ступенчато, но в большей всего по первой ступени.
- Органические вещества (кроме растворимых кислот и их солей), оксиды, простые вещества, нерастворимые в воде вещества электролитами не являются
Вещества
Неэлектролиты
Электролиты
Сильные
(α → 1)
Слабые
(α → 0)

Реакции ионного обмена – реакции между ионами в растворе
- Правило Бертолле: реакции ионного обмена идут до конца, если:
- образуется осадок ,
- выделяется газ
- образуется слабый электролит (например, вода)
Задание 9. Составьте молекулярные и ионные (полные и сокращенные) уравнения реакций между:
- Серной кислотой и гидроксидом железа (III);
- Сульфидом натрия и соляной кислотой;
- Гидроксидом калия и азотной кислотой.

Химические свойства простых и сложных веществ
- Химические свойства металлов
При рассмотрении химических свойств металлов надо учитывать их положение в электрохимическом ряду напряжений
Активность металлов уменьшается
ЩМ – щелочной металл (IA)
ЩЗ – щелочноземельный металл (IIA, кроме Mg, Be)

Металл + простое вещество (неметалл) = бинарные соединения
- Ме + О 2 = оксиды (со щелочными Ме, кроме лития – пероксиды, не реагируют Au, Pt)
- Ме + S = сульфиды
- Ме + Г 2 = галогениды (фториды, хлориды, бромиды, йодиды)
2 Fe + 3 Cl 2 = 2 FeCl 3
- Me + N 2 = нитриды
- Ме + Р = фосфиды
- Ме + С = карбиды
- Ме + Si = силициды
- Ме + Н 2 = гидриды (только активные металлы IA и IIA щелочные и щелочноземельные)
Задание 10. Составьте уравнения реакций натрия с кислородом, серой, азотом, водородом

Металл + сложные вещества
а) Акт. Ме + Н 2 О = щелочь + Н 2 ↑
б) Ме ср. акт. + Н 2 О = оксид Ме + Н 2 ↑
в) Ме (после Н) + Н 2 О ≠
2. С кислотами
Ме (до Н, но не ЩМ и ЩЗМ) + кислота = соль (р) + Н 2 ↑
Me (Al, Mg, Ca) + оксид Ме = оксид Al, Mg, Ca + Ме
- Со щелочами – только Ме с переходными свойствами
Ме + р-р щелочи = комплексная соль + Н 2 ↑
Ме (более активный, но не ЩМ и ЩЗ) + соль (р)= соль акт. Ме +
менее акт. Ме
6. Некоторые Ме + оксид неМе = оксид Ме + неМе
Задание 11. Составьте уравнения реакций кальция с водой, алюминия с соляной кислотой и раствором гидроксида калия, меди с нитратом серебра

Химические свойства неметаллов
- Взаимодействуют с металлами (см. слайд 15)
- Взаимодействуют с другими неМе
неМе + неМе = бинарные соединения
неМе + О 2 = оксид неМе (кроме галогенов)
- Специфические свойства неМе:
а) Г 2 (более акт.) + (р) соль Г (менее акт.) =
Г 2 (менее акт.) + (р) соль Г (более акт.)
б) Г 2 , S, P + р-р щелочи = смесь солей + Н 2 О
в) Концентрированные серная и азотная кислоты реагируют с некоторыми неметаллами, окисляя их до максимальной степени окисления, а сами восстанавливается до SO 2 и NO 2 cоответственно:
C+2 H 2 SO 4 (конц.)→ CO 2 ↑+2SO 2 ↑+2H 2 O
S+6HNO 3 (конц.) → H 2 SO 4 +6NO 2 ↑+2H 2 O
г) О 2 + сложные вещества с атомами в низкой с.о.
Задание 12. Составьте уравнения реакций серы с кислородом, фтором, углеродом, брома с р-ром КОН и с йодидом калия

Химические свойства сложных веществ
Свойства кислот
- Кислота + Ме (до Н, не ЩМ и ЩЗ) = соль (р) + Н 2 ↑
Особо с Ме реагируют H 2 SO 4 (к.) и HNO 3 (к.), Al, Fe, Cr пассивируются конц. кислотами при н.у., реагируют только с горячими кислотами
2. Кислота + оксид Ме (основный, амфотерный) = соль + Н 2 О
3. Кислота + основание = соль + Н 2 О
Если основание – щелочь, то реакция с сильной
кислотой – реакция нейтрализации
- Кислота + соль = др. соль + др. кислота
Реакция ионного обмена идет до конца, если:
образуется газ, осадок, вода
- Кислота нестабильная разлагается при нагревании или при н.у.
H 2 CO 3 = H 2 O + CO 2 4 HNO 3 = 4 NO 2 + 2 H 2 O + O 2

Особенности взаимодействия металлов с азотной и серной кислотами

Азотная кислота образует с металлами разные продукты в зависимости от концентрации

Химические свойства оксидов
1) А.о. + Н 2 О ≠
1) К.о. + Н 2 О = (р) кислота
2) А.о. + оксид Ме = соль Ме
3) А.о. + оксид неМе = соль Ме
2) К.о. + оксид Ме = соль Ме
3) К.о. + щелочь = соль + Н 2 О
4) А.о. + кислота = соль + Н 2 О
5) А.о. + щелочь = соль щелочного Ме + Н 2 О
- О.о. + Н 2 О = (р) основание, щелочь
2) О.о. + оксид неМе = соль Ме
3) О.о. + амфотерный оксид = соль акт. Ме
4) О.о. + кислота = соль + Н 2 О

Химические свойства оснований
- Все основания реагируют с кислотами
Основание + кислота = соль + вода
- Щелочь + кислота = соль + вода
- Щелочь + соль (р) = др. основание + др. соль
- Щелочь + К.о. = соль + вода
- Щелочь + А.о. = соль щел. Ме + вода
- Щелочь (р-р) + Ме (переходный) = комплексная соль + Н 2 ↑
- Щелочь + амфотерный гидроксид = комплексная соль
- Нерастворимые основания и LiOH разлагаются при нагревании
Основание = оксид Ме + вода
Специфические свойства
NH 4 OH ↔ NH 3 + H 2 O

Химические свойства солей (почти все рассмотрены выше)
- Соль (р) + более акт. Ме = др. соль (р) + др. Ме
- Соль + щелочь = др. соль + др. основание
- Соль + кислота = др. соль + др. кислота
- Соль 1 (р) + соль 2 (р) = соль 3 + соль 4
одна из образующихся солей должна быть (н)
- Разложение солей при нагревании (не все соли):
- карбонаты – до СО 2 и оксида Ме CaCO 3 = CO 2 + CaO
- Соли аммония и галогеноводородных кислот – до NH 3 и НГ
NH 4 Cl = NH 3 ↑ + HCl ↑
ОСОБО! NH 4 NO 2 = N 2 + H 2 O NH 4 NO 3 = N 2 O + H 2 O

Особо разлагаются соли азотной кислоты. Вспомним!

Проверьте свои знания
- Выполните задания на с. 216-217
- Подготовьтесь к общему повторению курса химии 9 класса










































