МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
ЧАСТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
«ОО ДПО «МЕЖДУНАРОДНАЯ АКАДЕМИЯ ЭКСПЕТИЗЫ И ОЦЕНКИ»
Итоговая аттестационная работа по дополнительной квалификации
«Педагогическое образование: учитель химии»
ТЕМА: «Вода и ее биологическое значение»
Выполнил:
слушатель факультета ДПО
«Педагогическое образование:
учитель химии»
Скутин Валерий Сергеевич
г. Саратов, 2017 г.
Содержание
ВВЕДЕНИЕ 3
ГЛАВА I. СТРОЕНИЕ И СВОЙСТВА ВОДЫ 6
1.1 Строение воды 6
1.2 Химические свойства воды 9
1.3 Физические свойства 12
ГЛАВА II. БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ ВОДЫ 18
2.1 Популяционно-видовой и биогеоценотический уровни организации жизни ………………………………………………………………………………….18
2.2 Организменный, органный и тканевой уровни. 21
2.3 Клеточный уровень. 25
2.4 Молекулярный уровень 27
ЗАКЛЮЧЕНИЕ 29
ВВЕДЕНИЕ
«Жизнь зародилась в воде, развивалась в воде, вода является ее растворителем и средой. Она является матрицей жизни.»
Антуан Сент-Дьердье.
Вода – основа жизни. Без воды жизнь на нашей планете не могла бы существовать.
Цель данной работы – изучение воды, ее физических и химических свойств и ее биологическое значение на всех уровнях организации жизни.
Вода важна для живых организмов по двум причинам. Во-первых, для многих организмов она служит еще и средой обитания, и, во-вторых, она является необходимым компонентом живых клеток.
Около 71% поверхности Земли покрыто водой (океаны, моря, озёра, реки, льды) — 1 млрд. 400 млн. км3. Общая площадь океанов и морей в 2,5 раза больше площади суши, а объём воды на Земле составляет примерно 1 340 700 тыс. куб. км. При этом 96,4% воды находится в Мировом океане, 1,7% воды находится в подземных водах, 1,8% в ледниках, и т.д. (Табл. 1, Диаграммы 1).
Табл. 1. Распределение воды на Земле.
| Части гидросферы | Объем, млн км.3 | Доля в мировых запасах,% |
| от общих запасов воды | от запасов пресных вод |
| Мировой океан | 1340,7 | 96,4 | - |
| Подземные воды | 23,4 | 1,68 | 29,5 |
| Ледники и постоянный снежный покров | 24,8 | 1,79 | 69,4 |
| в том числе в Антарктиде | 22,4 | 1,61 | 62,5 |
| Подземные воды в зоне многолетнемерзлых пород | 0,3 | 0,02 | 0,84 |
| Болота | 0,01 | 0,0007 | 0,03 |
| Реки | 0,002 | 0,0001 | 0,006 |
| Озера | 0,18 | 0,01 | 0,25 |
| в том числе пресные озера | 0,09 | 0,0006 | 0,25 |
| Вода в атмосфере | 0,01 | 0,00078 | 0,03 |
| Общие запасы пресных вод | 35,8 | 2.58 | 100,0 |
| Общие запасы воды | 1389.5 | 100,0 | - |
Диаграмма 1. Распределение воды на Земле
![]()
Бо́льшая часть земной воды — солёная, непригодная для сельского хозяйства и питья. Доля пресной составляет около 2,58%, причём 98,8% этой воды находится в ледниках и грунтовых водах (Табл.1, Диаграмма 2.). Менее 0,3% всей пресной воды содержится в реках, озёрах и атмосфере, и ещё меньшее количество (0,003%) находится в живых организмах.
Диаграмма 2. Распределение пресной воды
![]()
Является хорошим сильнополярным растворителем. В природных условиях всегда содержит растворённые вещества (соли, газы).
Исключительно важна роль воды в возникновении и поддержании жизни на Земле, в химическом строении живых организмов, в формировании климата и погоды. Вода является важнейшим веществом для всех живых существ на Земле.
Вода является основным компонентом большинства животных и растительных клеток и тканей. Содержание воды в клетках варьирует в зависимости от типа клеток и физиологических условий. Например, в корне моркови содержится около 85% воды, тогда как молодые листья салата на 95% состоят из воды, некоторых сухих семенах и спорах содержание воды составляет всего лишь 10%; однако, для того чтобы они стали метаболически активными, содержание воды в них должно существенно увеличиться.
Организм человека почти на 70% состоит из воды, медузы на 99,9%, форели на 84%, лягушки на 80%
Вода является средой, в которой происходит диффузия растворенных соединений по клеткам; представляет собой вещество, необычайно удобное для регуляции температуры; служит растворителем необходимым для протекания многих биохимических реакций; наконец, вода довольно мало сжимаема при давлениях, существующих в организме, что подчеркивает ее роль в поддержании структуры клетки.
Сегодня уже не надо доказывать, какую роль играет вода в жизнедеятельности человека: от ее качества зависит состояние здоровья людей, уровень их санитарно-эпидемиологического благополучия, степень комфортности и, как следствие, социальная стабильность общества в целом.
ГЛАВА I. СТРОЕНИЕ И СВОЙСТВА ВОДЫ
- Строение воды
Вода (оксид водорода) — бинарное неорганическое соединение с химической формулой Н2O (рис.1). Молекула воды состоит из двух атомов водорода (H+) и одного — кислорода (O2-), которые соединены между собой ковалентной связью.
Молекула воды Н2О имеет пространственную форму тупоугольного треугольника с углом между двумя химическими связями кислород-водород равным около 104º. Электроны водородных атомов оттянуты к кислороду, так, что “водородные углы” треугольника несут излишек положительного заряда, а “кислородный угол”, отрицательного. Вода – это жидкость, молекулы которой образовывают своеобразную кластерную структуру, за счет специфической водородной связи между молекулами воды.
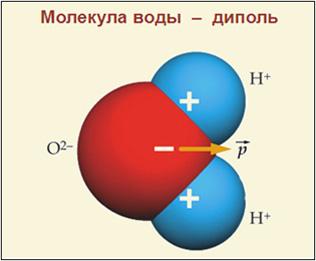


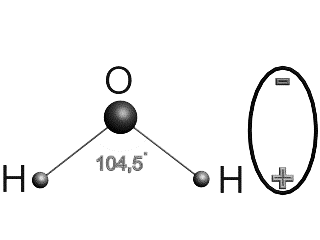
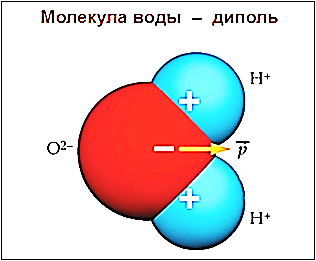
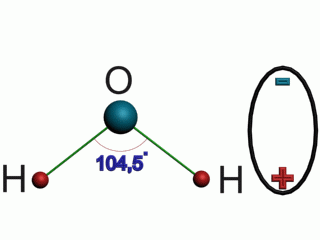 Рис.1. Строение молекулы воды
Рис.1. Строение молекулы воды
Вода – это самое распространенное на нашей планете неорганическое соединение. Физические и химические свойства воды определяются составом её молекул.
Свойства эти довольно необычны и обусловлены главным образом малыми размерами молекул воды, их полярностью и способностью соединяться друг с другом водородными связями. Под полярностью подразумевают неравномерное распределение зарядов в молекуле. У воды один конец молекулы («полюс») несет небольшой положительный заряд, а другой — отрицательный. Такую молекулу называют диполем. У атома кислорода способность притягивать электроны выражена сильнее, чем у водородных атомов, поэтому атом кислорода в молекуле воды стремится оттянуть к себе электроны двух водородных атомов. Электроны заряжены отрицательно, в связи с чем атом кислорода приобретает небольшой отрицательный заряд, а водородные атомы — положительный.
В результате между молекулами воды возникает слабое электростатическое взаимодействие и, поскольку противоположные заряды притягиваются, молекулы как бы «склеиваются». Эти взаимодействия, более слабые, чем обычные ионные или ковалентные связи, называются водородными связями (Рис.2) Водородные связи постоянно образуются, распадаются и вновь возникают в толще воды.
Рис.2 Водородные связи между молекулами воды.
Две молекулы воды, соединенные водородной связью-6+ — очень маленький положительный заряд; 6~ — очень маленький отрицательный заряд
Каждая из присоединённых к данной молекул воды сама способна к присоединению дальнейших молекул. Этот процесс можно называть "полимеризацией".
Если только одна из двух возможных связей участвует в присоединении следующей молекулы, а другая остаётся вакантной, то "полимеризация" приведёт к образованию либо зигзагообразной цепи, либо замкнутого кольца (Рис.4). Наименьшее кольцо, по-видимому, может состоять из четырёх молекул, но величина угла 90° делает водородные связи крайне напряжёнными. Практически ненапряжёнными должны быть пятизвенные кольца (угол 108°), а шестизвенные (угол 120°), также как и семизвенные - напряжённые.
Рис.3Зигзагообразная цепь молекул воды.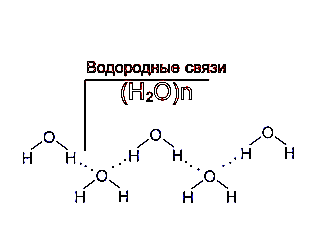
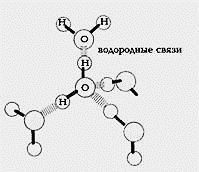
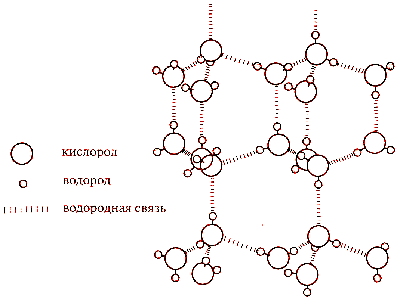
Рис.4 Замкнутые кольца, образованные водородными связями.
Рассмотрение реальных структур гидратов показывает, что, действительно, наиболее устойчиво шестизвенное кольцо, находимое в структурах льдов. Плоские кольца являются привилегией клатратных гидратов, причём во всех известных структурах чаще всего встречаются плоские пятизвенные кольца из молекул воды. Они, как правило, чередуются во всех структурах клатратных гидратов с шестизвенными кольцами, очень редко с четырёхзвенными, а в одном случае - с плоским семизвенным.
В целом структура воды представляется как смесь всевозможных гидратных структур, которые могут в ней образоваться.
Учитывая данную особенность воды, мы можем теперь перейти к рассмотрению ее свойств.
- Химические свойства воды
Вода является наиболее распространённым растворителем на планете Земля, во многом определяющим характер земной химии, как науки. Большая часть химии, при её зарождении как науки, начиналась именно как химия водных растворов веществ.
Роль воды как универсального растворителя определяется прежде всего полярностью её молекул и, как следствие, её чрезвычайно высокой диэлектрической проницаемостью. Разноимённые электрические заряды, и в частности ионы, притягиваются друг к другу в воде в 80 раз слабее, чем притягивались бы в воздухе. Силы взаимного притяжения между молекулами или атомами погружённого в воду тела также слабее, чем в воздухе. Тепловому движению в этом случае легче разбить молекулы. Оттого и происходит растворение, в том числе многих труднорастворимых веществ: капля камень точит.
Вода — химически активное вещество. Сильно полярные молекулы воды образуют гидраты и кристаллогидраты. Гидролиз происходит в живой и неживой природе, и широко используется в химической промышленности.
Воду можно получить в ходе реакций:
Разложение перекиси водорода
2H2O2→2H2O+O2↑
Взаимодействие гидрокарбоната натрия с уксусной кислотой
NaHCO3+CH3COOH→CH3COONa+H2O+CO2↑
Взаимодействие карбоната кальция с уксусной кислотой
2CH3COOH+CaCO3→Ca(CH3COO)2+H2O+CO2↑
В ходе реакций нейтрализации:
Серной кислоты гидроксидом калия
H2SO4+2KOH→K2SO4+2H2O
Азотной кислоты гидроксидом аммония
HNO3+NH4OH→NH4NO3+H2O
Уксусной кислоты гидроксидом бария
2CH3COOH+Ba(OH)2→Ba(CH3COO)2+2H2O
Восстановлением оксидов металлов водородом:
CuO+H2→Cu+H2O
Под воздействием очень высоких температур или электрического тока (при электролизе), а также под воздействием ионизирующего излучения, как установил в 1902 году Фридрих Гизель при исследовании в одного раствора бромида радия, вода разлагается на молекулярный кислород и молекулярный водород:
2H2O→2H2↑+O2↑
Вода реагирует при комнатной температуре:
С активными металлами (натрий, калий, кальций, барий и др.)
2H2O+2Na→2NaOH+H2↑
Со фтором и межгалоидными соединениями
2H2O+2F2→4HF+O2
H2O+F2→HF+HOF
(при низких температурах)
3H2O+2IF5→5HF+HIO3
9H2O+5BrF3→15HF+Br2+3HBrO3
С солями, образованными слабой кислотой и слабым основанием, вызывая их полный гидролиз:
Al2S3+6H2O→2Al(OH)3↓+3H2S↑
С ангидридами и галогенангидридами карбоновых и неорганических кислот
С активными металлорганическими соединениями (диэтилцинк, реактивы Гриньяра, метилнатрий и т.д.)
С карбидами, нитридами, фосфидами, силицидами, гидридами активных металлов (кальция, натрия, лития и др.)
Со многими солями, образуя гидраты
С боранами, силанами
С кетенами, недоокисью углерода
С фторидами благородных газов
Вода реагирует при нагревании:
С железом, магнием:
4H2O+3Fe→Fe3O4+4H2
С углем, метаном:
H2O+C⇄CO+H2
С некоторыми алкилгалогенидами
Менее активные металлы разлагают воду при повышенной температуре, например, Мg и Zn – выше 1000 ºС; Fe – выше 6000 ºС:
2Fe + 3H2O = Fe2O3 + 3H2
Вода реагирует в присутствии катализатора:
С амидами, эфирами карбоновых кислот;
С ацетиленом и другими алкинами;
С алкенами;
С нитрилами.
Вода может служить катализатором, например, щелочные металлы и водород реагируют с CI2 только в присутствии следов воды.
Иногда вода – каталитический яд, например, для железного катализатора при синтезе NH3.
Способность молекул воды образовывать трёхмерные сетки водородных связей позволяет ей давать с инертными газами, углеводородами, СО2, CI2, (CH2)2O, CHCI3 и многими другими веществами газовые гидраты.
- Физические свойства
Вода при нормальных условиях находится в жидком состоянии, тогда как аналогичные водородные соединения других элементов являются газами (H2S, CH4, HF). Из-за большой разности электроотрицательностей атомов водорода и кислорода электронные облака сильно смещены в сторону кислорода. Каждая молекула воды образует до четырёх водородных связей — две из них образует атом кислорода и две — атомы водорода. Количество водородных связей и их разветвлённая структура определяют высокую температуру кипения воды и её удельную теплоту парообразования. Если бы не было водородных связей, вода, на основании места кислорода в таблице Менделеева и температур кипения гидридов аналогичных кислороду элементов (серы, селена, теллура), кипела бы при −80 °С, а замерзала при −100 °С.
При переходе в твёрдое состояние молекулы воды упорядочиваются, при этом объёмы пустот между молекулами увеличиваются, и общая плотность воды падает, что и объясняет меньшую плотность (больший объём) воды в фазе льда. При испарении, напротив, все водородные связи рвутся. Разрыв связей требует много энергии, отчего у воды самая большая удельная теплоёмкость среди прочих жидкостей и твёрдых веществ. Для того чтобы нагреть один литр воды на один градус, требуется затратить 4,1868 кДж энергии. Благодаря этому свойству вода нередко используется как теплоноситель. Помимо большой удельной теплоёмкости, вода также имеет большие значения удельной теплоты плавления и парообразования (Диаграмма 3).
Табл. 3 Удельная теплоемкость воды при различной температуре.
![]()
Вода обладает также высоким поверхностным натяжением, уступая в этом только ртути (Диаграмма 4). Относительно высокая вязкость воды обусловлена тем, что водородные связи мешают молекулам воды двигаться с разными скоростями.
Диаграмма 4. Поверхностное натяжение жидкостей при температуре 20 ºС.
![]()
Вода является хорошим растворителем полярных веществ. Каждая молекула растворяемого вещества окружается молекулами воды, причём положительно заряженные участки молекулы растворяемого вещества притягивают атомы кислорода, а отрицательно заряженные — атомы водорода. Поскольку молекула воды мала по размерам, много молекул воды могут окружить каждую молекулу растворяемого вещества.
Это свойство воды используется живыми существами. В живой клетке и в межклеточном пространстве вступают во взаимодействие растворы различных веществ в воде. Вода необходима для жизни всех без исключения одноклеточных и многоклеточных живых существ на Земле.
Вода обладает отрицательным электрическим потенциалом поверхности.
Чистая вода — хороший изолятор. При нормальных условиях вода слабо диссоциирована и концентрация протонов (точнее, ионов гидроксония H3O+) и гидроксильных ионов OH− составляет 10-7 моль/л. Но поскольку вода — хороший растворитель, в ней практически всегда растворены те или иные соли, то есть присутствуют другие положительные и отрицательные ионы. Благодаря этому вода проводит электричество. По электропроводности воды можно определить её чистоту.
Вода имеет показатель преломления n=1,33 в оптическом диапазоне. Однако она сильно поглощает инфракрасное излучение, и поэтому водяной пар является основным естественным парниковым газом, отвечающим более чем за 60% парникового эффекта. Благодаря большому дипольному моменту молекул, вода также поглощает микроволновое излучение, на чём основан принцип действия микроволновой печи.
По состоянию различают три агрегатные состояния воды:
«Твёрдое» — лёд
«Жидкое» — вода
«Газообразное» — водяной пар
При нормальном атмосферном давлении (760 мм рт. ст., 101 325 Па) вода переходит в твёрдое состояние при температуре в 0 °C и кипит (превращается в водяной пар) при температуре 100 °C (значения 0 °C и 100 °C были выбраны как соответствующие температурам таяния льда и кипения воды при создании температурной шкалы «по Цельсию»). При снижении давления температура таяния (плавления) льда медленно растёт, а температура кипения воды — падает. При давлении в 611,73 Па (около 0,006 атм.) температура кипения и плавления совпадает и становится равной 0,01 °C. Такие давление и температура называются тройной точкой воды. При более низком давлении вода не может находиться в жидком состоянии, и лёд превращается непосредственно в пар. Температура возгонки (сублимации) льда падает со снижением давления. При высоком давлении существуют модификации льда с температурами плавления выше комнатной (Диаграмма 5).
Диаграмма 5. Фазовая диаграмма воды: по вертикальной оси — давление в Па, по горизонтальной — температура в Кельвинах.
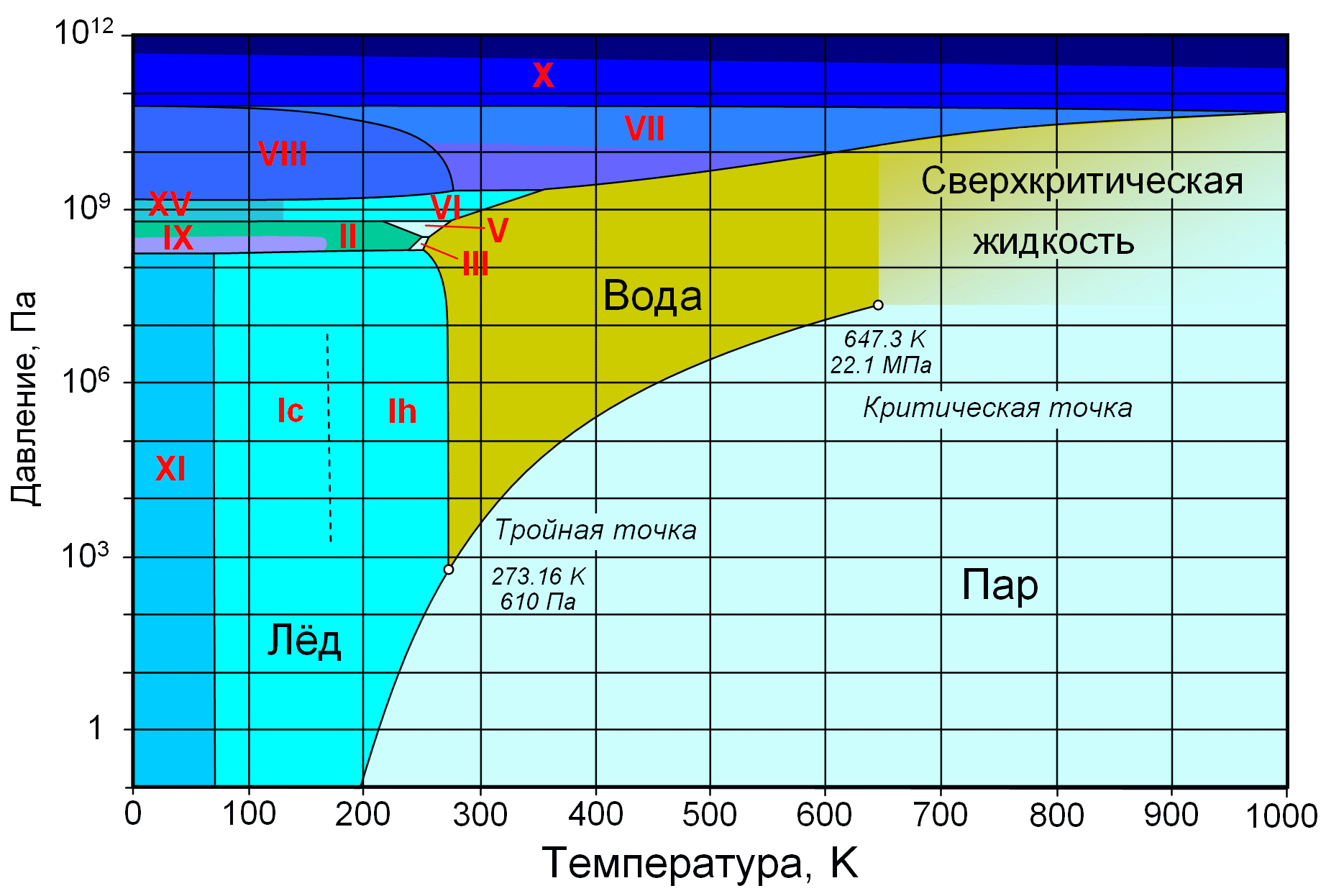 Отмечены критическая (647,3 K; 22,1 МПа) и тройная (273,16 K; 610 Па) точки.
Отмечены критическая (647,3 K; 22,1 МПа) и тройная (273,16 K; 610 Па) точки.
Римскими цифрами отмечены различные структурные модификации (фазы) льда
С ростом давления температура кипения воды растёт (Диаграмма 6):
Диаграмма 6. Зависимость температуры кипения от давления.
![]()
При росте давления плотность насыщенного водяного пара в точке кипения тоже растёт, а жидкой воды — падает. При температуре 374 °C (647 K) и давлении 22,064 МПа (218 атм) вода проходит критическую точку. В этой точке плотность и другие свойства жидкой и газообразной воды совпадают. При более высоком давлении и/или температуре исчезает разница между жидкой водой и водяным паром. Такое агрегатное состояние называют «сверхкритическая жидкость».
Вода может находиться в метастабильных состояниях — пересыщенный пар, перегретая жидкость, переохлаждённая жидкость. Эти состояния могут существовать длительное время, однако они неустойчивы и при соприкосновении с более устойчивой фазой происходит переход. Например, можно получить переохлаждённую жидкость, охладив чистую воду в чистом сосуде ниже 0 °C, однако при появлении центра кристаллизации жидкая вода быстро превращается в лёд.
Оптические свойства
Оптические свойства воды оцениваются по её прозрачности, которая в свою очередь зависит от длины волны излучения, проходящего через воду. Вследствие поглощения оранжевых и красных компонентов света вода приобретает голубоватую окраску. Вода прозрачна только для видимого света и сильно поглощает инфракрасное излучение, поэтому на инфракрасных фотографиях водная поверхность всегда получается чёрной. Ультрафиолетовые лучи легко проходят через воду, поэтому растительные организмы способны развиваться в толще воды и на дне водоёмов, инфракрасные лучи проникают только в поверхностный слой. Вода отражает 5% солнечных лучей, в то время как снег — около 85%. Под лёд океана проникает только 2% солнечного света.
Оптические свойства водяного пара, поглощающего инфракрасные лучи с длиной волны от 5,5 до 7 микрон, играют существенную роль в жизни растений. Дело в том, что водяной пар предохраняет почву от заморозков. Еще более действенным средством от заморозков является выпадение росы и образование тумана: конденсация влаги сопровождается выделением большого количества тепла, задерживающего дальнейшее охлаждение почвы.
Зная физические свойства воды и льда, человек давно использует их в своей практической деятельности. Так, например, иногда применяется прокладка голых электрических проводов прямо по льду, так как электропроводность сухого льда и снега очень мала. Она во много раз меньше электропроводности воды.
Изотопный состав воды.
И кислород, и водород имеют природные и искусственные изотопы. В зависимости от типа изотопов водорода, входящих в молекулу, выделяют следующие виды воды:
Лёгкая вода (основная составляющая привычной людям воды): H2O
Тяжёлая вода (дейтериевая): D2O
Сверхтяжёлая вода (тритиевая): T2O
Тритий-дейтериевая вода: TDO
Тритий-протиевая вода: THO
Дейтерий-протиевая вода: DHO
Последние три вида возможны, так как молекула воды содержит два атома водорода. Протий — самый лёгкий изотоп водорода, дейтерий имеет атомную массу 2,0141017778 а.е.м., тритий — самый тяжёлый, атомная масса 3,0160492777 а.е.м. В воде из-под крана тяжелокислородной воды (H2O17 и H2O18) содержится больше, чем воды D2O16: их содержание, соответственно, 1,8 кг и 0,15 кг на тонну.
Хотя тяжёлая вода часто считается мёртвой водой, так как живые организмы в ней жить не могут, некоторые микроорганизмы могут быть приучены к существованию в ней.
По стабильным изотопам кислорода 16O, 17O и 18O существуют три разновидности молекул воды. Таким образом, по изотопному составу существуют 18 различных молекул воды. В действительности любая вода содержит все разновидности молекул.
ГЛАВА II. БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ ВОДЫ
- Популяционно-видовой и биогеоценотический уровни организации жизни
Исходя из строения воды и ее свойств, описанных в данной работе, складывается и ее биологическое значение, которое я рассмотрю на эволюционно – обусловленных уровнях организации жизни, часть из них будут объединены в группы и рассмотрены совместно, часть будет рассмотрена индивидуально (клеточный, молекулярный).
При рассмотрении популяционно-видового и биогеоценотического уровней важно рассмотреть среду обитания живых организмов.
Ввиду важности биологических функций воды она очень часто является лимитирующим фактором для наряду с температурой и составом почв определяет типы экосистем (степи, саванны, сухие леса, влажные леса).
Наибольшее количество осадков выпадает в тропическом поясе. Это объясняется максимальным поступлением туда энергии Солнца. Благодаря высокой температуре тропический воздух вбирает в себя намного больше воды, чем прохладный в более высоких широтах. Таким образом, влажный климат тропиков обусловлен большим количеством энергии Солнца.
На количество осадков оказывает влияние соотношение площадей суши и моря: в Южном полушарии, где больше площадь океанов и меньше площадь материков, осадков выпадает больше, чем в Северном.
Важное значение имеет не только общее количество осадков, выпадающих на местности, но и их интенсивность и распределение во времени.
Очень сильные дожди, особенно при отсутствии растительного покрова, вызывают эрозию почвы, гибель проростков растений и мелких животных. Сильнейшее повреждающее действие имеют осадки в виде града, размер частиц которого может быть с куриное яйцо. Длительные периоды моросящих дождей неблагоприятны для насекомых и насекомоядных птиц, особенно в период выкармливания ими птенцов. При отсутствии осадков организмам приходится переносить длительные периоды засухи.
В тропическом поясе режим выпадения осадков служит фактором, определяющим сезонную активность организмов – их биологические ритмы. В умеренных широтах главными сигналами смены сезонов года являются длительность светового дня (фотопериод) и режим температур.
Показатель влажности воздуха характеризует степень его насыщенности водяными парами. Абсолютной влажностью воздуха называют количество водяных паров на единицу его массы, а относительной – отношение количества имеющихся водяных паров к максимально возможному при данной температуре (в%).
Влажность воздуха имеет большое биологическое значение.
От количества влаги в воздухе зависит интенсивность ее испарения с поверхностей тел организмов. При низкой влажности испарение идет очень сильно и может привести к дегидратации (обезвоживанию) организмов. Для защиты от обезвоживания многие из них приобрели специальные адаптации:
– растения — толстую кутикулу, способность сбрасывать листья в сухой сезон, способность сворачивать листья, утрату (редукцию) листьев, опушенность и восковой налет на листьях, погруженные в ткань листа устьица — отверстия, через которые испаряется вода;
– животные — роговые чешуи, хитиновые покровы и др.
Иссушающие свойства воздуха зависят от дефицита его насыщения водяными парами — разницы между абсолютной и максимально возможной влажностью при данной температуре.
Адаптации организмов к разным уровням увлажнения
В зависимости от потребности в воде все растения делят на три экологические группы.
1. Гидрофиты (от греч. hydor – вода, влага) – влаголюбивые растения, ими являются:
– растения, полностью находящиеся в воде, — элодея;
– растения, у которых в воду погружены только корни, — камыш, рогоз, осоки, папирус;
– растения, произрастающие во влажных местах, — мхи, папоротники, плауны и др.
2. Мезофиты (от греч. mesos – средний, промежуточный) — растения умеренно влажных мест (полей, лесов, лугов) имеют приспособления для добывания воды — развитую корневую систему, покровные и проводящие ткани, механизмы регуляции уровня испарения.
3. Ксерофиты (от греч. xeros – сухой) — растения сухих мест (сухих степей, саванн, полупустынь, пустынь) способны переносить недостаток влаги.
Ксерофиты преодолевают недостаток влаги следующими способами:
– повышают ее поглощение с помощью мощного развития корневых систем: у некоторых растений пустынь масса корней превышает массу наземных органов в 9—10 раз;
– сокращают потери воды снижением испарения листьями;
– накапливают воду в мясистых стеблях (кактусы и африканские молочаи) или в листьях (алоэ, агавы);
– вырабатывают механизмы, позволяющие переносить недостаток воды.
Растения, накапливающие воду в мясистых стеблях или листьях, называют стеблевыми и листовыми суккулентами (от лат. succulentus – сочный). Для защиты от испарения они имеют толстую покровную ткань, а кактусы – устьица (отверстия, через которые происходит испарение), глубоко погруженные в ткань листа и открывающиеся только ночью, когда температура воздуха снижается. В то же время корневые системы суккулентов развиты слабо, поскольку они произрастают в местностях хотя и с редкими, но обильными осадками.
Растения, не накапливающие влагу, а добывающие ее с больших глубин и имеющие строение для максимального снижения испарения, называют склерофитами (от греч. skleros — твердый, жесткий). Склерофиты имеют жесткие сухие стебли, мелкие жесткие листья, которые часто сбрасывают во время сухого сезона. У многих склерофитов листья редуцированы (саксаул) или представляют собой колючки.
Адаптации животных. Существуют три вида адаптации животных к засухе.
1. Поведенческие – миграции в места, где есть вода, посещение водопоев, ночной образ жизни, укрытие в норах.
2. Морфологические - наличие защитных покровов.
3. Физиологические:
– наличие механизмов обратного всасывания воды в пищеварительной и выделительной системах;
– выделение высококонцентрированной или твердой мочи;
– синтез метаболической воды;
– способность переносить сильное обезвоживание.
- Организменный, органный и тканевой уровни.
Организменный, органный и тканевой уровни будут рассмотрены совместно. Все живое на нашей планете состоит на 2/3 из воды. Без воды невозможно существование живых организмов. На организм животных вода как важнейший компонент среды обитания оказывает значительное влияние, начиная с периода эмбрионального развития. Она может поменять их свойства, качества, что оказывает положительное или отрицательное влияние на организм животных.
Например, корова выпивает за сутки до 100-110 л воды, следовательно, за год ей необходимо до 36500 л воды. Это превышает ее массу тела в 50-60 раз. Итак, можно четко констатировать, что животный организм, как и растительный, не может жить при отсутствии воды.
Содержание воды в организме в значительной степени зависит от вида, возраста, пола и типа тканей животных. Так, в организме собак вода составляет 65%, лошадей – 55%, крупного рогатого скота – около 60%, морских свинок и кроликов – 72%, рыб – 80% от массы тела. В наземных растениях содержание воды составляет 50-75%, в водорослях – 95-99%. В организме молодого животного, особенно новорожденного, содержание воды значительно выше, чем у взрослого. В теле новорожденного теленка вода составляет 72%, полуторагодовалого – 61%, взрослого быка – 52%. В организме жирных животных воды содержится относительно меньше, чем у тощих, т.к. жировая ткань бедна водой. Организм истощенной овцы содержит 60%, а жирной – 46% воды. Содержание воды в эмбрионах животных может достигать 97% их массы. Доля воды в отдельных тканях организма неодинакова. Любопытно, что, несмотря на высокое содержание воды, ткани представляют собой плотную массу. Объясняется это способностью воды вызывать набухание коллоидов в отличие от крови, которая, как известно, сама является тканью, только жидкой. Содержание воды в крови (80%) лишь незначительно больше, чем, например, в сердечной мышце (78%). Таким образом, вода является основной биологической жидкостью. Она содержится в виде внутриклеточной воды, находящейся в клетках, и внеклеточной, находящейся внутри сосудистого русла (плазма) и в тканях (тканевая жидкость). В зрелом организме отношение объемов внутриклеточной воды и внеклеточной составляет 2:1. Внутриклеточная вода составляет 45% от массы тела. Внеклеточная вода, входящая в состав плазмы крови, лимфы, жидкости – тканевой, спинномозговой и серозных полостей, составляет около 20% (в т.ч. вода плазмы крови и лимфы – 4%) от массы тела. Вода, содержащаяся в крови, служит источником, из которого организм черпает воду, необходимую для построения клеток.
Содержание воды в тканях тесно связано с активностью обмена веществ в ней. Так, например, серое вещество мозга содержит 86%, почки – 80%, печень – 70%, костная ткань – 20% воды.
Вот почему в организме животных с мощным отложением жировой ткани содержание воды обычно на 10-20% ниже по сравнению с истощенными животными. Часть воды связана абсорбционно с молекулами белка, 1 грамм которого связывает 0,5 грамм воды, что при содержании 18% белка в мышечной ткани дает 9% связанной воды. Поэтому, у ожиревшего организма животного уменьшение массы тела более опасно для здоровья, т.к. потеря 1/5 части внутриклеточной воды отмечается при снижении массы тела на 1/10 у животного, содержащего 5% жира, и только на 1/15 животного, организм которого содержит 35% жира.
Вода в организм животных поступает при питье, в составе еды и отчасти за счет внутриклеточного распада органических веществ. Больше всего воды задерживается в коже (до 10% от всего количества воды в теле), соединительной ткани и мышцах: они являются как бы депо воды. Кожу в данном случае следует рассматривать как орган, играющий особую роль в водном обмене, благодаря своей водонепроницаемости, а также защищающий живую материю от внезапных изменений температуры благодаря высокой теплоемкости и высоким значением теплоты парообразования. Однако кожа способна выделять воду из организма путем диффузии через эпидермис и потение, что позволяет организму, уменьшить мочеотделение.
Кожа защищает организм от опасного обезвоживания и потери большого количества соли. Обладает способностью накапливать большое количество воды. Установлено, что около 10% общего количества воды в организме млекопитающих удерживает кожа благодаря содержанию в ней хлористого натрия (1/3 от общего количества его в организме). Хлористый натрий накапливается в основном в эпидермисе. При нарушении выделения хлористого натрия (почечная недостаточность) соль накапливается в коже, что ведет к появлению отеков. Минеральный обмен в организме не возможен без участия воды.
Недостаток воды животное ощущает чрезвычайно остро. Так, потеря организмом воды в количестве 10% сопровождается ослаблением сердечной деятельности, повышением температуры тела, снижением аппетита и секреции желудочного сока, возбуждением нервной системы, мышечной дрожью, сухостью и желтушностью слизистых оболочек.
При потере воды организмом в количестве 20% и более наступает смерть. Следует указать, что жажда во много раз мучительнее голода и обуславливает быструю гибель животных. Установлено, что при общем голодании, но при даче воды животное в состоянии прожить 30-40 суток, хотя при этом теряет 50% жиров, углеводов, белков. При лишении воды животные погибают через 4-8 суток.
При дефиците воды в теле животного наступает расстройство многих физиологических функций организма: нарушается обмен веществ и нарастает количество молочной кислоты, снижаются окислительные процессы, увеличивается вязкость крови, повышается температура тела, учащается дыхание, происходит обеднение органов и тканей водой; нарушается секреция пищеварительных желез, исчезает аппетит и резко падает продуктивность. Водное голодание приводит к интоксикации организма, так как происходят существенные изменения в печени, почках, составе крови (увеличение ее плотности); регистрируют усиленный расход белков.
Избыток воды в жидкостях организма вызывает значительное разбавление электролитов. Это приводит к повреждению клеток, вследствие этого к так называемому водному отравлению. Вода, потребленная в чрезмерном количестве, проникает в кровяные и другие клетки организма, вызывая их набухание. Кровяное давление повышается. Пища, чрезмерно разбавленная водой в кишечнике, плохо усваивается организмом.
Вода является прекрасным растворителем, а все процессы в организме (ассимиляция, диссимиляция, резорбция, диффузия, осмос и др.) протекают в водных растворах органических и неорганических веществ. Вода не только инертная среда, она может также вступать в соединения с другими компонентами живой материи. Только в жидкой водной среде совершаются процессы пищеварения и усвоения пищи в желудочно-кишечном тракте и синтез живого вещества в клетках организма. Вода является непосредственным участником процессов окисления, гидролиза и других реакций межклеточного обмена.
Вода необходима также для выведения различных вредных веществ из организма, образующихся в результате обмена. Питьевая вода попадает в организм через пищеварительный канал, откуда кровью и лимфой разносится в межтканевые пространства и ткани. Одновременно в стенках пищеварительного канала, главным образом тонкой и отчасти толстой кишок, происходит обратное всасывание воды с пищеварительными соками. Таким образом, движение воды происходит в 2-х направлениях. Почти вся вода всасывается при нормальном функционировании органов пищеварения. Лишь небольшое количество воды выделяется наружу с калом. При заболевании желудочно-кишечного тракта (например, во время диареи) потери воды значительно возрастают.
Вода всасывается через кишечные ворсинки, представляющие собой выпячивание слизистой оболочки кишки. Интенсивность всасывания воды отдельными отрезками пищеварительного канала у плотоядных и травоядных различна. Так, например, из 160 л воды (в том числе 70 л составляет вода кишечных соков), проходящей в течение суток через пищеварительный канал крупного травоядного, около 145 л всасывается в тонкой и толстой кишках, и лишь около 15 л выделяется с калом.
Из пищеварительного канала вода с кровью воротной вены попадает в печень. Вода проникает в кровь благодаря более высокому осмотическому давлению последней.
Обезвоживание организма – это такое состояние, когда выведение воды из организма значительно превышает поступление. Этим термином обозначается болезненное состояние, при котором объем жидкостей тела, в особенности внеклеточной воды, сильно уменьшается по сравнению с содержанием электролитов. Обезвоживание встречается при различных расстройствах, чаще всего как последствие длительных поносов, непроходимости кишечника, затруднениях при глотании, потере солей, рвоте и др. Клинически обезвоживание проявляется в жажде, сухости языка и слизистых оболочек, снижении напряжения (тонуса) кожи и внутриглазового давления, сильном сгущении мочи (олигурия), вздутии живота, нарушениях кровообращения и общей слабости.
Для растений вода имеет так же огромное биологическое значение. Вода поступает в растение из почвы через корневые волоски и молодые части корней и по сосудам разносится по всей его надземной части. В вакуолях растительных клеток растворены различные вещества. Давление растворенных в воде веществ на цитоплазму называется осмотическим давлением. Вода, поглощенная растворенными в клеточном соке веществами, также оказывает давление на цитоплазму и растягивает до известного предела эластичную оболочку клетки. Клеточный сок с растворенными в нем веществами постоянно поддерживает растительную ткань в напряженном состоянии, и лишь при большой потере воды, при завядании, это напряжение (тургор) в растении исчезает.
Выделение растением капелек воды — гуттация — демонстрирует наличие корневого давления.
Когда осмотическое давление уравновешено растянувшейся оболочкой, вода не может поступать в клетку. Но стоит клетке потерять часть воды, как оболочка спадается, находящийся в клетке клеточный сок становится более концентрированным и начинает насасывать воду в клетку, пока оболочка снова не растянется и не уравновесится осмотическое давление. Чем больше воды потеряло растение, тем с большей силой вода поступает в клетки. Сила, с которой растение всасывает воду, представляет собой разность между осмотическим и тургорным давлением.
Растение непрерывно испаряет воду через устьица. Этим создается возможность нового притока воды к листьям. Присасывающее действие испарения играет большую роль в передвижении воды по растению. Устьица могут раскрываться и закрываться, образовывать то широкую, то узкую щель. На свету устьица раскрываются, а в темноте и при слишком большой потере воды закрываются. В зависимости от этого испарение воды то идет интенсивно, то сильно сокращается. Часть воды все время испаряется через кутикулу, однако это испарение идет гораздо слабее, чем через устьица.
Если срезать стебель растения около самого корня, из пенька начинает сочиться сок. Это показывает, что корень и сам нагнетает воду в стебель. Следовательно, поступление воды в растение зависит не только от испарения воды через листья, но и от корневого давления. Оно перегоняет воду из живых клеток корня в полые трубки омертвевших сосудов. Так как в клетках этих сосудов нет цитоплазмы, вода беспрепятственно движется по ним к листьям, где испаряется через устьица.
Испарение очень важно для растения. С передвигающейся водой разносятся по растению поглощенные корнем минеральные вещества. Испарение снижает температуру растения и тем самым предохраняет его от перегрева. Из каждой тысячи частей поглощенной из почвы воды растение усваивает лишь 2—3 части, а остальные 997—998 частей испаряются. Чтобы образовать 1 г сухого вещества, растение в нашем климате испаряет от 300 г до 1 кг воды.
Пока в почве есть влага, растение растет и развивается нормально. Но вот перестали выпадать дожди, наступает засуха, и растение испытывает недостаток воды и растворимых в ней минеральных веществ; в нем перестает образовываться новое вещество, рост и развитие прекращаются. Кроме того, растение начинает повреждаться от перегрева: на листьях и стебле появляются пятна ожогов. Особенно сильно повреждается растение от ожогов при суховее — сухом горячем ветре. Растение увядает и, если погода не изменится к лучшему, гибнет.
Из описанного выше можно сделать вывод о том, что, несмотря на способы ее получения, расходования и выведения из организма воды, для организмов животных и растений вода имеет ключевое значение.
- Клеточный уровень.
Все органы и ткани состоят из клеток, по окончании описания биологического значения я рассмотрел клеточный уровень организации жизни.
Содержание воды в растительных тканях представляет исключительно изменчивую и динамическую величину. Оно различно у разных видов растений, органах, претерпевает сезонные и суточные изменения, обуславливается возрастом ткани, доступностью почвенной влаги и соотношением поглощения воды и испарения.
Больше всего воды в растительной клетке концентрируется в вакуоли – до 98%. Содержание воды в цитоплазме может достигать 95% от ее массы. Оводненность органелл в среднем равна 50%. В ядре содержится 20 – 30% воды. вода является важным структурным компонентом мембран, которые могут содержать до 25% воды. содержание воды в клеточных стенках тургесцентных клеток может составлять более 50%. В клетках меристем, имеющих лишь малочисленные мелкие вакуоли и тонкие клеточные оболочки, основная масса воды заключена в цитоплазме.
Для функционирования живых организмов важны не только и даже не столько их общая оводненность, сколько то состояние, в котором находится содержащаяся в них вода – ее концентрация (как всякое другое вещество, вода в гетерогенной среде обладает той или иной концентрацией), подвижность и т.д. Должно быть совершенно очевидным, что свойства внутриклеточной воды, в том числе структурные и физико-химические, изменены по сравнению с дистиллированной (чистой) водой, что в клетке существуют различные по своей подвижности и другим параметрам водные фракции. Иными словами, наряду со свободной существует и связанная вода. Понятие о свободной и связанной воде заимствовано из физической химии. Свободная – это чистая, лишенная каких-либо примесей вода с высокой подвижностью. Под связанной понимают содержащуюся в гетерогенных системах воду, которая не может служить растворителем, имеет ограниченную подвижность, более плотную упаковку (то есть повышенную упорядоченность пространственной организации) молекул, пониженную температуру замерзания и повышенную температуру кипения.
Вследствие своей большой теплоемкости вода обеспечивает примерное постоянство температуры внутри клетки. Вода может переносить большое количество теплоты, отдавая ее там, где температура тканей ниже, и забирая там, где температура более высокая. Также при испарении воды происходит значительное охлаждение из-за того, что много энергии тратится на разрыв водородных связей при переходе из одного агрегатного состояния (жидкость) в другое (газ).
Вода является дисперсионной средой, играющей важную роль в коллоидной системе цитоплазмы, определяет структуру и функциональную активность многих макромолекул, служит основной средой для протекания химических реакций и непосредственным участником реакций синтеза и расщепления органических веществ, обеспечивает транспортировку веществ в клетке (диффузия).
Вода практически не сжимаема (в жидком состоянии), и поэтому служит гидростатическим скелетом клетки. За счет осмоса вода создает избыточное давление внутри вакуолей растительных клеток, это тургорное давление обеспечивает упругость клеточной стенки и поддержание формы органов у растений (например, листьев).
Вода обладает рядом свойств, имеющих исключительно важное значение для живых организмов. Исключительные свойства воды определяются структурой ее молекул. Молекула воды является диполем. Атом кислорода в ней ковалентно связан с двумя атомами водорода. Положительные заряды сосредоточены у атомов водорода, т.к. кислород электроотрицательнее водорода.
Из-за высокой полярности молекул вода является лучшим из известных растворителей. Вещества, хорошо растворимые в воде называют гидрофильными. К ним относят многие кристаллические соли, ряд органических веществ – спирты, сахара, некоторые белки (например, альбумины, гистоны). Вещества, плохо или совсем нерастворимые в воде, называют гидрофобными. К ним относятся жиры, нуклеиновые кислоты, некоторые белки (глобулины, фибриллярные белки).
- Молекулярный уровень
Любая живая система, как бы сложно она ни была организована, состоит из биологических макромолекул: нуклеиновых кислот, белков, полисахаридов, а также других важных органических веществ, которые составляют начальный уровень организации живого - молекулярный. С этого уровня начинаются разнообразные процессы жизнедеятельности организма: обмен веществ и превращение энергии, передача наследственной информации и др.
Вода – непосредственный участник многих химических превращений. Ее реакционная способность исключительно высока. Гидролиз - один из важнейших способов распада высокомолекулярных полимеров (полисахаридов, липидов, белков, нуклеотидов) на мономеры. Но чтобы гидролиз прошел, должна разделиться на две части и сама молекула воды. Значит, эффективность расщепления пищевых полимерных молекул зависит не только от их состава и структуры, не только от ферментов, которые их расщепляют, но и от того, достаточно ли там, где идет гидролиз, именно той воды, которая обладает необходимой для осуществления гидролиза структурной организацией. Путём гидролиза устраняются старые, отработавшие своё биополимеры или те, что в данный момент не нужны.
На место разобранных на мелкие кусочки биополимеров должны поступить новые. Они собираются в клетке из молекулярных кирпичиков, которые в нужной последовательности стыкуются друг к другу. Когда к растущей цепи биополимера пришивается новое звено, освобождается одна молекула воды. Эта химическая реакция носит название поликонденсации, и она, по существу, противоположна гидролизу.
Гидратация непредельных органических молекул может предшествовать их биологическому окислению (например, в цикле трикарбоновых кислот, при β-окислении жирных кислот). С помощью дегидратации образуется один из макроэргов в процессе гликолиза. Гидратация и дегидратация непременно сопутствуют изомерным превращениям различных веществ организма. Многие реакции биосинтеза осуществляются с поглощением или выделением воды.
Одним из важнейших свойств воды на молекулярном уровне является участие воды ет в биосинтезе глюкозы, в результате, которого образуется кислород:
6nCO2 + 5nH2O = (C6H10O5)n + 6nO2 (при действии света).
ЗАКЛЮЧЕНИЕ
По итогу данной работы можно сделать вывод о том, что биологическое значение воды для живых организмов переоценить сложно. Вода является основой жизни всех живых существ. Ей принадлежит важнейшая роль в зарождении, жизнедеятельности и развитии организмов:
– вода составляет основу тел живых организмов;
– вода является средой и участницей идущих в телах живых организмов биохимических реакций;
– вода является средой, в составе которой организмы получают многие необходимые им вещества и избавляются от продуктов обмена (шлаков);
– у растений вода участвует в фотосинтезе – на него расходуется 5% всей потребляемой ими воды, а 95% ее уходит на транспирацию (испарение листьями, что создает восходящий ток минеральных солей) и поддержание тургора (упругости) тканей;
– вода является средой жизни водных организмов;
– высокая теплоемкость воды позволяет теплокровным животным поддерживать постоянство температуры их тел;
– медленное нагревание и медленное охлаждение воды смягчают колебания температур, из-за чего климат побережий называют «мягким», или морским;
– высокая температура испарения воды дает возможность организмам избавляться от излишков тепла;
– другие важные функции.
Вода — сверх-значимое вещество для нашей планеты. Великий ученый и мыслитель Владимир Иванович Вернадский в своих работах писал, что не существует такого компонента, значение которого могло бы «сравниться с ней по влиянию на ход основных, самых грозных геологических процессов». Вода присутствует не только в организме всех живых существ нашей планеты, но и во всех веществах на Земле – в минералах, в горных породах … Изучение уникальных свойств воды постоянно открывает нам все новые и новые тайны, задает нам новые загадки и бросает новые вызовы.
СПИСОК ЛИТЕРАТУРЫ
Ахметов Н.С., Общая и неорганическая химия, М., Высшая школа», 2008 г.
Биология для поступающих в ВУЗы. Москва «Высшая школа» 1998 г.
Большая Советская Энциклопедия (Электронный вариант).
Ершов Ю. А., Попков В. А., Берлянд А. C., Общая химия, М., Высшая школа», 2007 г.
Коробкин, В.И. Экология: Учеб.для студ. вузов / В.И. Коробкин, Л.В. Передельский. - Ростов н/Д: Феникс, 2000 г.
Ленский А. С., Белавин И. Ю., Быликин С. Ю. Биофизическая и бионеорганическая химия. Учебник для студентов медицинских ВУЗов. М.: МИА. 2008 г.
Малая Медицинская Энциклопедия (Электронный вариант).
Под редакцией А.С. Степановских . Общая экология. М., 2001 г.
Хомченко Г.П. Пособие по химии для поступающих в вузы. 4-е изд., испр. и доп. - М.: Новая волна, 2002 г.
Чебышев Н.В., Филиппова А.В. Основы экологии. – Москва, 2004 г.
http://medicalplanet.su/
http://www.vodainfo.com
http://studopedia.ru/
http://www.studfiles.ru/
http://studbooks.net/










 Рис.1. Строение молекулы воды
Рис.1. Строение молекулы воды



 Отмечены критическая (647,3 K; 22,1 МПа) и тройная (273,16 K; 610 Па) точки.
Отмечены критическая (647,3 K; 22,1 МПа) и тройная (273,16 K; 610 Па) точки. 


















