ДЕПАРТАМЕНТ ОБРАЗОВАНИЯ МЕСТНОЙ АДМИНИСТРАЦИИ Г.О. НАЛЬЧИК
МУНИЦИПАЛЬНОЕ КАЗЁННОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
«СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА С УГЛУБЛЕННЫМ ИЗУЧЕНИЕМ ОТДЕЛЬНЫХ ПРЕДМЕТОВ № 5 ИМЕНИ А.С. ПУШКИНА Г.О. НАЛЬЧИК»
ОТКРЫТЫЙ УРОК ПО ХИМИИ
в 9 классе
на тему:
Практическая работа №5
«Получение аммиака и изучение его свойств»
Выполнил:
учитель химии
Добрынина И.Г.
Г.Нальчик 2023г
Практическая работа № 5.
Получение аммиака и изучение его свойств.
Цель:
1. овладеть одним из способов получения аммиака реакцией ионного обмена, которая используется и как качественная реакция на соли аммония;
2. рассмотреть процесс сбора прибора для получения газа, который легче воздуха;
3. ознакомиться со свойствами водного раствора аммиака;
4. закреплять умение наблюдать за явлениями, описывать их и делать
умозаключения – выводы.
Оборудование: для изучения данной практической работы используем видео «ЛАБОРАТОРНЫЕ ОПЫТЫ»
Ход урока.
I. Постановка целей и задач урока.
На уроке рассмотрим получение аммиака реакцией ионного обмена и изучим свойства этого газа и его водного раствора – гидроксида аммония.
II. Практическая работа
Получение аммиака (просмотр видеоопыта).
Рассмотрим опыт получения аммиака: на лист бумаги или в небольшую фарфоровую чашку (можно ступку) насыпьте хлорид аммония и гидроксид кальция объемом по одной ложечке (ложечка для сжигания веществ).
Смесь перемешивается стеклянной палочкой и высыпается в сухую пробирку. Пробирка закрывается пробкой с газоотводной трубкой и укрепляется в лапке штатива.
При укреплении прибора в лапке штатива обратите внимание на наклон пробирки относительно ее отверстия. На газоотводную трубку надевается сухая пробирка для собирания аммиака.
Пробирку со смесью хлорида аммония и гидроксида кальция прогревают сначала всю (2—3 движения пламени), а затем в том месте, где находится смесь.
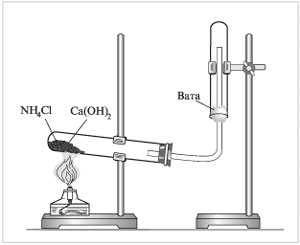
Почему пробирка вверх дном? ( NH3 легче воздуха в 2 раз).
Как вы узнаете, что получили NH3?
1)по запаху (резкий запах);
2)поднесят к отверстию перевёрнутой вверх дном пробирки влажную фенолфталеиновую бумажку(она стала малиновой).
1). 2NH4CI + Ca (OH )2 = CaCI2 + 2NH3↑ + 2H2O
2)Не переворачивая пробирку, быстро опускают её в чашку с водой отверствием вниз и капают фенолфталеин. Что произошло? Какое вещество получается?
Аммиак очень хорошо растворим в воде!
NH3 + H2O = NH4OH
аммиачная вода,
нашатырный спирт,
среда щелочная,
3)Получение „дыма без огня”
NH3 + HCI = NH4Cl
NH3 + HNO3 = NH4NO3
В результате этих реакций получаются какие вещества? (соли аммония).
Вывод:
Мы рассмотрели получение аммиак, обнаружение по резкому запаху, определили, что он имеет основнойхарактер, хорошо растворим в воде, образуя основание, аммиачнуюводу, взаимодействует с кислотами, образуя соли.
2.Рассмотрим свойства водного раствора аммиака.
1.NH4OH + 2,3 капли фенолфталеина → малиновая окраска
Почему?
NH4OH → NH3 ↑+H2O
NH4OH + 2,3 капли фенолфталеина → малиновая окраска, + HCI
Как изменился цвет? Почему?
NH4OH +HCI = NH4CI + H2O
N
 H4 + + OH- + H+ + CI- = NH4 + + CI- + Н2О
H4 + + OH- + H+ + CI- = NH4 + + CI- + Н2О
Н+ + ОН- = Н2О реакция нейтрализации
АICI3 + 3NH4OH = 3NH4CI + AI (OH)3↓
AI3+ + 3CI- + 3NH4+ + 3OH- = 3NH4+ + 3CI- + AI (OH)3↓
A
 I3+ + 3OH- = AI (OH)3↓
I3+ + 3OH- = AI (OH)3↓
Вывод:
при изучении свойств водного раствора NH3с помощью просмотра лабораторных опытов, выяснили, что этооснование, разлагается при нагревании, взаимодействуетс кислотами и солями.
III. Подведение итога урока.
Вывод по уроку: чему научились?
Получили аммиак, изучили его свойства, а также свойства нашатырного спирта.
Домашнее задание: Оформите просмотренные опыты в тетрадях.

















