План – конспекта урока
Предмет: Химия
Учитель: Аппазова Д.С.
Класс: 9
Учебник: Химия. 9 класс - Рудзитис Г.Е., Фельдман Ф.Г.
Тема урока: «Азотная кислота»
Цели:
изучить свойства азотной кислоты, отметить ее особенности взаимодействия с металлами. Рассмотреть применение азотной кислоты.
Задачи:
образовательные: расширить знания учащихся о химических свойствах азотной кислоты и составление электронных балансов в окислительно-восстановительных уравнениях.
развивающие: продолжить совершенствование умений составления химических уравнений и навыков самостоятельной работы учащихся; умений сравнивать; продолжить работу по развитию коммуникативных способностей ребят и навыков сотрудничества;
воспитательные: формирование культуры работы с реактивами.
Оборудование: медь, разбавленная азотная кислота, пробирки, штатив для пробирок.
Ход урока:
1.Организационный момент
2. Проверка д/з
Экспресс-тест:
«Аммиак. Соли аммония»
1. (2 балла) Азот входит в главную подгруппу:
a) IV группы; б) V группы в) VI группы; г) VII группы.
2. (2 балла) Раствор аммиака в воде окрашивает лакмус в:
a) Красный цвет; б) Синий цвет; в) Фиолетовый цвет; г) Не окрашивает совсем.
3. (2 балла) Аммиак горит в кислороде без катализатора с образованием:
a) Азота; б) Оксида азота (II); в) Оксида азота (III) г) Азотной кислоты.
4. (2 балла) Степень окисления азота в аммиаке может быть равна: а) +1; б) 0; в) +4; г) -3;
5. (2 балла) Нашатырный спирт – это:
а) Р-р аммиака в воде; б) Р-р аммиака в спирте; в) Хлорид аммония; г) Медицинский спирт.
6. (2 балла) При взаимодействии аммиака с кислотами образуются:
а) соли азотной кислоты б) соли аммония в) соли азотистой кислоты
г) аммиачная вода
7. (2 балла) Назовите формулу – NH4Cl:
а) сульфат аммония б) хлорид аммония в) нитрат аммония г) нитрит аммония
8. (2 балла) Все соли аммония вступают в реакции:
а) разложения и горения б) разложения и обмена с щелочами
в) горения и обмена с щелочами г) разложения и замещения металлами
9. (15 баллов) Запишите уравнения реакций, взаимодействия:
А) аммиака и соляной кислоты
Б) аммиака и кислорода (без катализатора)
В) хлорида аммония и гидроксида натрия
Г) разложения нитрата аммония
Д) карбоната аммония и соляной кислоты
10. (4 балла) Назовите области применения солей аммония.
Критерии оценивания:
0-10 баллов – «2» 21-31 балл – «4»
32-35 баллов – «5» 11-20 баллов – «3»
3. Мотивация.
Девиз урока: «Не получай знания в готовом виде, а добывай их самостоятельно».
Класс разбивается на 3 группы и пытается отгадать о каком веществе идет речь, используя минимальное количество утверждений? Какая группа выигрывает – тем добавляется дополнительный балл за работу на уроке.
Факты об азотной кислоте:
Это вещество имеет длинную историю, восходящую к IX в. Первым, кто ее получил, был арабский химик Гебер.
До середины XX в. это соединение в обиходе называли «крепкая водка», хоть ничего общего с классом спиртов оно не имеет.
Данное вещество входит в состав многих удобрений, необходимых агрономам для получения высокого урожая. Хранят это соединение в виде растворов, т.к. в концентрированном виде оно не стабильно и при нагревании до высоких температур распадается на воду и диоксид азота.
Ответ: речь идет об азотной кислоте.
Тема урока: «Азотная кислота»
Постановка темы и целей урока (слайд 5)
Сегодня мы с вами на уроке должны:
записать молекулярную и структурную формулы азотной кислоты;
изучить химические свойства азотной кислоты;
выяснить признаки взаимодействия концентрированной азотной кислоты с металлами;
Рассмотрим основные сферы применения азотной кислоты
Актуализация опорных знаний.
Назовите формулу азотной кислоты? (HNO3)
Какую степень окисления проявляет N в азотной кислоте?(+5)
Какой тип химической связи реализуется в азотной ксилоте?(ковалентная полярная, т.к. относится к классу сильных кислот)
К слабым или сильным кислотам относится эта кислота?(Сильным)
Изучение нового материала
А) Строение молекулы азотной кислоты.
Азотная кислота – НNO3
Графическая формула 

Модель
Валентность – V, С.О. = +5, тип связи – ковалентная полярная
Б) Физические свойства
Безводная азотная кислота – бесцветная летучая жидкость с резким раздражающим запахом. Концентрированная азотная кислота имеет желтую окраску, за счет наличия в составе оксида азота (IV), который образуется вследствие частичного разложения кислоты и растворяется в ней. На воздухе «дымит», хорошо растворима в воде, плотность 1,5 г/см3, t кип =86 0С.
В) Химические свойства
Типичные свойства азотной кислоты:
Азотная кислота – сильная кислота, в водных растворах она полностью диссоциирует:
HNO3 → H+ + NO-3.
азотная кислота взаимодействует с основными оксидами, с основаниями, с солями слабых кислот:
Работа в парах. Написать уравнения реакций взаимодействия азотной кислоты с оксидом натрия, гидроксидом железа (III), силикатом калия.
Na2O+ 2 HNO3 = 2 NaNO3 + H2O
Fe(OH)3 + 3 HNO3 = Fe(NO3)3 + 3 H2O
K2SiO3 + 2HNO3 = 2 KNO3 + HSiO3
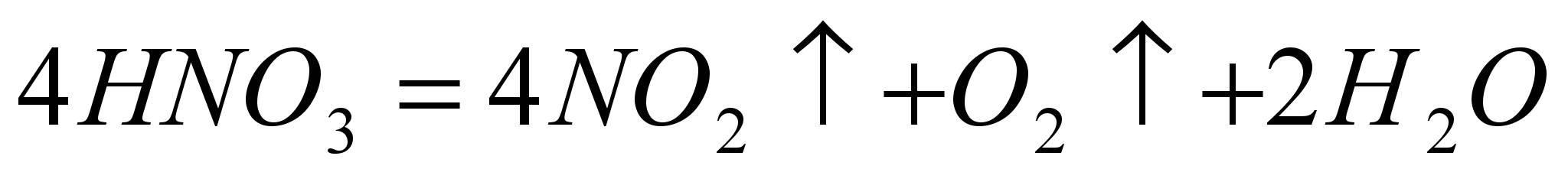
Физкультминутка
Cпецифические свойства азотной кислоты:
Поэтому для азотной кислоты характерны исключительно окислительные свойства.
Запомни! При взаимодействии азотной кислоты с металлами водород не выделяется, а образуются иные продукты:


Демонстрационный опыт!!!(соблюдение правил техники безопасности)
При взаимодействии разбавленной азотной кислоты с малоактивным металлом Cu образуются нитрат металла, оксид азота (II) и вода:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
При взаимодействии концентрированной азотной кислоты с медью образуется оксид азота (IV), нитрат металла и вода:
Cu + 4HNO3 = Cu(NO3)2 + 2NO2↑ + 2H2O
Просмотр видеоопыта «Взаимодействие концентрированной азотной кислоты с медью»
4Zn + 10HNO3 (раствор горячий) =t˚C= 4Zn(NO3)2 + N2O + 5H2O
4Zn + 10HNO3 (оч. разб. горячий) =t˚C= 4Zn(NO3)2 + NH4NO3 + 3H2O
Zn + 4HNO3 (конц. горячий) =t˚C= Zn(NO3)2 + 2NO2 + 2H2O
Холодная концентрированная азотная кислота не реагирует с Al, Cr, Fe – происходит пассивация, а при нагревании образуется NO2.
Fe + 4HNO3 (конц.) холод≠ пассивация
6HNO3(конц.) + Fe =t˚C= 3H2O + 3NO2 + Fe(NO3)3
при взаимодействии с белками образуются вещества ярко-желтого цвета.Поэтому при поподании нитратной кислоты на кожу появляются желтые пятна.
Применение.
Азотная кислота используется в промышленности для получения нитратов, органических нитросоединений, в других производствах.
Селитры используются в сельском хозяйстве в качестве минеральных удобрений. Нитраты калия, аммония и натрия применяют для производства черного пороха и взрывчатых веществ, нитрат серебра – в медицинских целях.
Просмотр видеоролика «Получение азотной кислоты» .
Закрепление.
Выполнить задания из сборника «Дидактический материал. 8-9 класс» под ред. А.М. Радецкого.
Работа №2 В1-В2 стр.79
РЕФЛЕКСИЯ:
Красный – восторг, оранжевый – радость, веселье, желтый – светлое, приятное настроение, зеленый – спокойное, уравновешенное состояние, синий – грустное настроение, фиолетовый – тревожное, напряженное настроение, черный – упадок сил, уныние, белый – равнодушие (трудно сказать)






















