
Рекомендации по решению задач по теме
«Приготовление растворов»
Понятие раствор и растворимость
Как в качественном, так и в количественном анализе основная работа проводится с растворами.
Раствор - гомогенная (однородная) смесь, состоящая из частиц растворённого вещества, растворителя и продуктов их взаимодействия.
При растворении твердого вещества в воде или другом растворителе молекулы поверхностного слоя переходят в растворитель и в результате диффузии распределяются по всему объему растворителя.
Одновременно с растворением происходит и обратный процесс - выделение молекул из раствора.
Растворимость - способность вещества образовывать с другими веществами однородные системы - растворы, в которых вещество находится в виде отдельных атомов, ионов, молекул или частиц.
Количество вещества в насыщенном растворе определяет растворимость вещества при данных условиях.
Растворимость различных веществ в тех или иных растворителях различна.
В определенном количестве каждого растворителя может быть растворено не более определенного количества данного вещества.
Растворимость выражают количеством граммов вещества в 100 г растворителя в насыщенном растворе, при данной температуре.
Практически нерастворимые вещества часто называют нерастворимыми, хотя абсолютно нерастворимых веществ нет.
Нерастворимыми обычно называют такие вещества, растворимость которых чрезвычайно мала (1 весовая часть вещества растворяется в 10000 частей растворителя).
Обычно растворимость твердых веществ увеличивается с повышением температуры.
Если приготовить при нагревании раствор, близкий к насыщенному, а затем быстро, но осторожно охладить его, образуется так называемый пересыщенный раствор.
Если в такой раствор бросить кристаллик растворенного вещества или перемешать его, то из раствора начнут выпадать кристаллы.
Следовательно, в охлажденном растворе вещества содержится больше, чем это возможно для насыщенного раствора при данной температуре.
Поэтому при внесении кристалла растворенного вещества весь излишек вещества выкристаллизовывается.
Свойства растворов всегда отличаются от свойств растворителя.
Раствор кипит при более высокой температуре, чем чистый растворитель.
Температура замерзания, наоборот, у раствора ниже, чем у растворителя.
По характеру растворителя растворы делятся на
К неводным растворам принадлежат растворы веществ в таких органических растворителях, как спирт, ацетон, бензол, хлороформ и так далее.
Растворы большинства солей, кислот, щелочей готовятся водные.
Способы выражения концентрации растворов. Понятие эквивалента
Каждый раствор характеризуется концентрацией растворенного вещества: количеством вещества, содержащегося в определенном количестве раствора.
Концентрация растворов может выражаться в
Концентрацию веществ в растворах можно выразить разными способами:
Массовая доля растворённого вещества W — это безразмерная величина, равная отношению массы растворённого вещества к общей массе раствора
W = mр.в. / mр.
или иначе называют - процентная концентрация раствора, которая определяется количеством граммов вещества в 100 г раствора.
Например, 5 % раствор содержит 5 г вещества в 100 г раствора, то есть 5 г вещества и 100–5 = 95 г растворителя.
Молярная концентрация CМ показывает, сколько молей растворённого вещества содержится в 1 литре раствора.
CМ = nр.в. / V = mр.в. / (Mр.в. · V),
где Мр.в. - молярная масса растворенного вещества, г/моль.
Молярная концентрация измеряется в моль/л и обозначается M.
Например, 2 M NaOH - двумолярный раствор гидроксида натрия; одномолярные (1 М) растворы содержат 1 моль вещества в 1 л раствора, двумолярные (2 М) - 2 моля в 1 л и так далее.
Для того чтобы установить, какое количество граммов данного вещества находится в 1 л раствора заданной молярной концентрации, необходимо знать его мольную массу, то есть массу 1 моля.
Мольная масса вещества, выраженная в граммах, численно равна молекулярной массе данного вещества.
Например, молекулярная масса NaCl равна 58,45, следовательно, мольная масса тоже равна 58,45 г.
Таким образом, 1 М раствор NaCl содержит 58,45 г хлорида натрия в 1 л раствора.
Нормальность раствора обозначает число моль - эквивалентов данного вещества в одном литре раствора или число миллимоль - эквивалентов в одном миллилитре раствора.
Моль - эквивалент вещества — это количество граммов вещества, численно равное его эквиваленту.
Эквивалентом сложного вещества называют такое его количество, которое в данной реакции соответствует (эквивалентно) 1 молю водорода.
Фактор эквивалентности определяется:
а) в обменных реакциях:
Кислоты
Величина эквивалента кислот определяется числом атомов водорода, которые могут быть замещены в молекуле кислоты на атомы металла.
Пример 1. Определить эквивалент для кислот
а) НСl
б) Н2SO4
в) Н3РО4
г) Н4[Fe (CN)6]
Решение:
а) Э = М/1
б) Э = М/2
в) Э = М/3
г) Э = М/4
В случае многоосновных кислот эквивалент зависит от конкретной реакции:
а) H2SO4 + 2KOH → K2SO4 + 2H2O
в этой реакции в молекуле серной кислоты замещается два атома водорода, следовательно, Э = М/2
б) H2SO4 + KOH → KHSO4 + H2O
В этом случае в молекуле серной кислоты замещается один атом водорода
Э = М/1
Для фосфорной кислоты, в зависимости от реакции, значения
а) Э = М/1
б) Э = М/2
в) Э = М/3
Основания
Эквивалент основания определяется числом гидроксильных групп, которые могут быть замещены на кислотный остаток.
Пример 2. Определить эквивалент оснований:
а) КОН
б) Cu(OH)2
в) La(OH)3
Решение:
а) Э = М.М/1
б) Э = М.М/2
в) Э = М.М/3
Соли
Значения эквивалента солей определяются по катиону.
Число, на которое должна быть разделена М.М (молярная масса) в случае солей равна
q·n,
где q - заряд катиона металла
n - число катионов в формуле соли
Пример 3. Определить эквивалент солей:
а) KNO3
б) Na3PO4
в) Cr2(SO4)3
г) Al (NO3)3
Решение:
а) q·n = 1
б) 1·3 = 3
в) z = 3·2 = 6
г) z = 3·1 = 3
Значение факторов эквивалентности для солей зависит также и от реакции, аналогично зависимости его для кислот и оснований.
б) в окислительно-восстановительных реакциях для определения эквивалента используют схему электронного баланса.
Число, на которое должна быть разделена М.М (молекулярная масса) для вещества в этом случае равно числу принятых или отданных молекулой или атомом вещества электронов.
К2Cr2O7 + HCl → CrCl3 + Cl2 + KCl + H2O
(K2Cr2O7) = 6; (Cr) = 6; (HCl) =1; (Cl) =1; (Cl2) =2; (Cl) =1.
Нормальная концентрация обозначается буквой Н (в расчетных формулах) или буквой н - при обозначении концентрации данного раствора.
Если в 1л раствора содержится 0,1 эквивалента вещества, он называется децинормальным и обозначается 0,1 н.
Раствор, содержащий 0,01 эквивалента вещества в 1 л раствора, называется сантинормальным и обозначается 0,01 н.
В любой реакции вещества реагируют в эквивалентных количествах.
Титрованными называют растворы, концентрация которых выражается молярностью, нормальностью или титром, то есть количеством граммов вещества, растворенного в 1 мл (см3) раствора.
Очень часто в аналитических лабораториях титры раствора пересчитывают непосредственно на определяемое вещество.
Тогда титр раствора показывает, какому количеству граммов определяемого вещества соответствует 1 мл данного раствора.
Для приготовления растворов молярной и нормальной концентрации навеску вещества отвешивают на аналитических весах, а растворы готовятся в мерной колбе.
При приготовлении растворов кислот нужный объем концентрированного раствора кислоты отмеряют бюреткой со стеклянным краном.
Навеска растворяемого вещества подсчитывается с точностью до четвертого десятичного знака, а молекулярные массы берутся с точностью, с которой они приведены в справочных таблицах.
Объем концентрированной кислоты подсчитывается с точностью до второго десятичного знака.
При приготовлении растворов процентной концентрации вещество отвешивают на технохимических весах, а жидкости отмеривают мерным цилиндром.
Поэтому навеску вещества рассчитывают с точностью до 0,1 г, а объем жидкости с точностью до 1 мл.
Прежде чем приступить к приготовлению раствора, необходимо произвести расчет, то есть рассчитать количество растворяемого вещества и растворителя для приготовления определенного количества раствора заданной концентрации.
1 Расчеты при приготовлении растворов с массовой процентной концентрацией
1.1. Растворы солей
Пример 1. Надо приготовить 500 г 5 % раствора нитрата калия.
100 г такого раствора содержат 5 г KN03
Составляем пропорцию:
100 г раствора - 5 г KN03
500 г раствора - х г KN03
х = 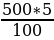 = 25 г
= 25 г
Воды нужно взять 500–25 = 475 г (мл).
Пример 2. Надо приготовить 500 г 5 % раствора СаСI2 из соли СаС12•6Н20.
Вначале производим расчет для безводной соли.
100 г раствора - 5 г СаС12
500 г раствора - х г СаС12
х = 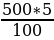 = 25 г
= 25 г
Мольная масса СаС12 = 111, мольная масса СаС12•6Н20 = 219.
Следовательно,
219 г СаС12•6Н20 содержат 111 г СаС12
Составляем пропорцию:
219 г СаС12•6Н20 - 111 г СаС12
х г СаС12•6Н20 - 25 г CaCI2
х = 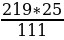 = 49,3 г
= 49,3 г
Количество воды равно 500 - 49,3 = 450,7 г или 450,7 мл.
Так как воду отмеривают мерным цилиндром, то десятые доли миллилитра в расчет не принимают.
Следовательно, нужно отмерить 451 мл воды.
1.2 Расчеты при приготовлении растворов кислот
При приготовлении растворов кислот необходимо учитывать, что концентрированные растворы кислот не являются 100 % - ными и содержат воду.
Кроме того, нужное количество кислоты не отвешивают, а отмеривают мерным цилиндром.
Пример 1. Нужно приготовить 500 г 10 % раствора соляной кислоты, исходя из имеющейся 58 % кислоты, плотность которой ρ = l,19 г/см3.
1. Находим количество чистого хлористого водорода, которое должно быть в приготовленном растворе кислоты:
100 г раствора -10 г НС1
500 г раствора - х г НС1
х = 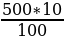 = 50 г
= 50 г
Для расчета растворов процентной концентрации мольную массу округляют до целых чисел.
2. Находим количество граммов концентрированной кислоты, в котором будет содержаться 50 г НС1:
100 г кислоты - 38 г НС1
х г кислоты - 50 г НС1
х = 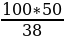 = 131,6 г
= 131,6 г
3. Находим объем, который занимает это количество кислоты:
V = 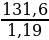 = 110, 6 мл (округляем до 111)
= 110, 6 мл (округляем до 111)
4. Количество растворителя (воды) равно
500–131,6 = 368,4 г, или 368,4 мл
Так как необходимое количество воды и кислоты отмеривают мерным цилиндром, то десятые доли миллилитра в расчет не принимают.
Следовательно, для приготовления 500 г 10 % раствора соляной кислоты необходимо взять 111 мл соляной кислоты и 368 мл воды.
Пример 2. Обычно при расчетах для приготовления кислот пользуются стандартными таблицами, в которых указаны
процент раствора кислоты
плотность данного раствора при определенной температуре и
количество граммов этой кислоты, содержащееся в 1 л раствора данной концентрации.
В этом случае расчет упрощается. Количество приготовляемого раствора кислоты может быть рассчитано на определенный объем.
Например, нужно приготовить 500 мл 10 % раствора соляной кислоты, исходя из концентрированного 38 % - ного раствора.
По таблицам находим, что 10 % - ный раствор соляной кислоты содержит 104,7 г НС1 в 1 л раствора.
Нам нужно приготовить 500 мл, следовательно, в растворе должно быть 104,7:2 = 52,35 г НС1.
Вычислим, сколько нужно взять концентрированной кислоты.
По таблице 1 л концентрированной НС1 содержит 451,6 г НС1.
Составляем пропорцию:
1000 мл - 451,6 г НС1
х мл - 52,35г НС1
х = 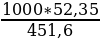 = 115,9 мл
= 115,9 мл
Количество воды равно 500–116 = 384 мл.
Следовательно, для приготовления 500 мл 10 % раствора соляной кислоты нужно взять 116 мл концентрированного раствора НС1 и 384 мл воды.
1.3 Приготовление растворов молярной и нормальной концентрации
Пример 1. Сколько граммов хлорида бария необходимо для
приготовления 2 л 0,2 М раствора?
Решение. Молекулярная масса хлорида бария равна 208,27.
Следовательно, 1л 0,2 М раствора должен содержать 208,27*0,2 = 41,654 г ВаСI2.
Для приготовления 2 л потребуется 41,654*2 = 83,308 г ВаСI2
Пример 2. Сколько граммов безводной соды Na2C03 потребуется для приготовления 500 мл 0,1 н. раствора?
Решение. Молекулярная масса соды равна 106,004; эквивалентная масса Na2C03 = М: 2 = 106,004: 2 = 53,002; 0,1 экв. = 5,3002 г.
1000 мл 0,1 н. раствора содержат 5,3002 г Na2C03
500 мл 0,1 н. раствора содержат х г Na2C03
х = 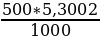 = 2,6501 г Na2C03
= 2,6501 г Na2C03
Пример 3. Сколько концентрированной серной кислоты (96 %,
ρ = l,84 г/см3) требуется для приготовления 2 л 0,05 н. раствора серной кислоты?
Решение. Молекулярная масса серной кислоты равна 98,08.
Эквивалентная масса серной кислоты Эн2so4 = М: 2 = 98,08: 2 = 49,04 г. Масса 0,05 экв. = 49,04*0,05 = 2,452 г.
Найдем, сколько H2S04 должно содержаться в 2 л 0,05 н. раствора:
1 л - 2,452 г H2S04
2 л - х г H2S04
х = 2,452*2 = 4,904 г H2S04
Чтобы определить, сколько для этого надо взять 96 %-ного раствора H2S04, составим пропорцию:
в 100 г конц. H2S04 - 96 г H2S04
в х г конц. H2S04 - 4,904 г H2S04
х = 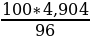 = 5,11 г H2S04
= 5,11 г H2S04
Пересчитываем это количество на объем:
5,11:1,84=2,77 мл
Таким образом, для приготовления 2 л 0,05 н. раствора надо взять 2,77 мл концентрированной серной кислоты.
Техника определения концентрации растворов
Концентрацию вещества в растворе определяют денсиметрией и титриметрическими методами.
Денсиметрией измеряют величину плотности раствора, зная которую по таблицам определяют весовую % концентрацию.
Титриметрический анализ - метод количественного анализа, в котором измеряют количество реактива, затраченного в ходе химической реакции.
1. Определение концентрации денсиметрией. Понятие плотности
Плотность - физическая величина, определяемая для однородного вещества массой его единичного объёма.
Для неоднородного вещества плотность в определённой точке вычисляется как предел отношения массы тела (m) к его объёму (V), когда объём стягивается к этой точке.
Средняя плотность неоднородного вещества есть отношение m/V.
Плотность вещества зависит от массы атомов, из которых оно состоит, и от плотности упаковки атомов и молекул в веществе. Чем больше масса атомов, тем больше плотность.
Виды плотности и единицы измерения
Плотность измеряется в кг/м³ в системе СИ и в г/см³ в системе СГС, остальные (г/мл, кг/л, 1 т/м3) - производные.
Для сыпучих и пористых тел различают:
- истинную плотность, определяемую без учёта пустот;
- кажущуюся плотность, рассчитываемую как отношение массы вещества ко всему занимаемому им объёму.
Зависимость плотности от температуры
Как правило, при уменьшении температуры плотность увеличивается, хотя встречаются вещества, чья плотность ведет себя иначе, например, вода, бронза и чугун.
Так, плотность воды имеет максимальное значение при 4 °C и уменьшается как с повышением, так и с понижением температуры.
2. Определение концентрации титриметрическим анализом
В титриметрическом анализе заставляют реагировать два раствора и как можно точнее определяют момент окончания реакции.
Зная концентрацию одного раствора, можно установить и точную концентрацию другого.
В каждом методе используются свои рабочие растворы, индикаторы, решаются соответствующие типовые задачи.
В зависимости от типа реакции, которая происходит во время титрования, различают несколько методов объемного анализа.
Из них наиболее часто применяют:
1. Метод нейтрализации
Основной реакцией служит реакция нейтрализации - взаимодействие кислоты с основанием.
2. Метод оксидиметрии, включающий методы перманганатометрии и йодометрии.
В основе лежат реакции окисления-восстановления.
3. Метод осаждения
В основе лежат реакции образования малорастворимых соединений.
4. Метод комплексонометрии
Основан на образовании малодиссоциирующих комплексных ионов и молекул.
Основные понятия и термины титриметрического анализа
Титрант - раствор реагента известной концентрации (стандартный раствор).
Стандартный раствор - по способу приготовления различают первичные и вторичные стандартные растворы.
Первичный готовят растворением точного количества чистого химического вещества в определенном количестве растворителя.
Вторичный готовят приблизительной концентрации и определяют его концентрацию по первичному стандарту.
Точка эквивалентности - момент, когда в добавленном объеме рабочего раствора содержится количество вещества эквивалентное количеству определяемого вещества.
Цель титрования - точное измерение объемов двух растворов, в которых содержится эквивалентное количество вещества.
Прямое титрование — это титрование определенного вещества «А» непосредственно титрантом «Б».
Его применяют в том случае, если реакция между «А» и «Б» протекает быстро.
Схема титриметрического определения
Для проведения титриметрического определения необходимы стандартные (рабочие) растворы, то есть растворы с точной нормальностью или титром.
Такие растворы готовят по точной навеске или приблизительной, но тогда точную концентрацию устанавливают титрованием, используя растворы установочных веществ.
Для кислот установочными растворами являются: тетраборат натрия (бура), оксалат натрия, оксалат аммония.
Для щелочей: щавелевая кислота, янтарная кислота приготовление раствора включает три этапа:
расчет навески
взятие навески
растворение навески
Если концентрацию устанавливают по точной навеске, её взвешивают на аналитических весах.
Если концентрация не может быть установлена по точной навеске, то её берут на технохимических весах, а в случае жидких веществ отмеривают рассчитанный объем.
Для определения точной концентрации проводят титрование, которое заключается в том, что два раствора реагируют между собой и с помощью индикатора фиксируется точка эквивалентности.
Концентрация одного из растворов (рабочего) точно известна.
Как правило, он помещается в бюретку.
Второй раствор с неизвестной концентрацией отбирают в конические колбы пипеткой в строго определенных объемах (метод пипетирования), либо растворяют точную навеску в произвольном количестве растворителя (метод отдельных навесок).
В каждую колбу добавляют индикатор.
Проводят титрование не менее 3 раз, до сходящихся результатов, разница между результатами не должна превышать 0,1 мл.
Заканчивается определение расчетом результатов анализа.
Важнейшим моментом является фиксирование точки эквивалентности.
Шесть правил титрования
1. Титрование проводят в конических стеклянных колбах.
2. Содержимое колбы перемешивают вращательными движениями, не убирая колбу из-под бюретки.
3. Оттянутый конец бюретки должен быть на 1 см ниже верхнего края колбы.
Уровень жидкости в бюретке устанавливают на нулевой отметке перед каждым титрованием.
4. Титруют малыми порциям - по каплям.
5. Титрование повторяют не менее 3 раз, до получения сходящихся результатов с отличием не более чем 0,1 мл.
6. После окончания титрования отсчет делений проводят через 20–30 секунд, чтобы дать возможность стечь жидкости, оставшейся на стенках бюретки.
Условия титриметрического определения концентрации вещества
В объемном анализе основной операцией является измерение объема двух взаимодействующих растворов, один из которых содержит анализируемое вещество, а концентрация второго заранее известна.
Неизвестную концентрацию анализируемого раствора определяют, зная соотношение объемов реагирующих растворов и концентрацию одного из них.
Для успешного проведения объемного анализа необходимо соблюдение следующих условий - реакция между реагирующими веществами должна идти до конца и протекать быстро и количественно.
Так как при титровании нужно точно установить момент эквивалентности или конец реакции между растворами, то это должно быть хорошо заметно по изменению окраски раствора или по появлению окрашенного осадка.
Для установления точки эквивалентности при объемном анализе часто применяют индикаторы.
Концентрация раствора одного из растворов (рабочего раствора) должна быть точно известна. Другие вещества, находящиеся в растворе, не должны мешать основной реакции.
Приготовление стандартных растворов
1. Приготовление титрованного раствора по точной навеске исходного вещества
Основным раствором в объемном анализе является титрованный, или стандартный - раствор исходного реактива, при титровании которым определяют содержание вещества в анализируемом растворе.
Самым простым способом приготовления раствора точно известной концентрации, т. е. характеризующегося определенным титром, является растворение точной навески исходного химически чистого вещества в воде или в другом растворителе и разбавление полученного раствора до требуемого объема.
Зная массу (а) растворенного в воде химически чистого соединения и объем (V) полученного раствора, легко вычислить титр (Т) приготовленного реактива
T = a/V (г/мл)
Этим способом готовят титрованные растворы таких веществ, которые можно легко получить в чистом виде, и состав которых отвечает точно определенной формуле и не изменяется в процессе хранения.
Прямой метод приготовления титрованных растворов применяют лишь в отдельных случаях.
Таким путем нельзя приготовить титрованные растворы веществ, которые отличаются
большой гигроскопичностью
легко теряют кристаллизационную воду
подвергаются действию диоксида углерода воздуха и т. д.
2. Установка титра раствора при помощи установочного вещества
Этот способ установки титров основан на приготовлении раствора реактива приблизительно требуемой нормальности и последующем точном определении концентрации полученного.
Титр или нормальность приготовленного раствора определяют, титруя им растворы так называемых установочных веществ.
Установочным веществом называют химически чистое соединение точно известного состава, применяемое для установки титра раствора другого вещества.
На основании данных титрования установочного вещества вычисляют точный титр или нормальность приготовленного раствора.
Раствор химически чистого установочного вещества готовят растворением в воде вычисленного его количества (взвешенного на аналитических весах) и последующим доведением объема раствора до определенной величины в мерной колбе. Отдельные (аликвотные) части приготовленного таким образом раствора отбирают из мерной колбы пипеткой в конические колбы и титруют их раствором, титр которого устанавливают.
Титрование проводят несколько раз и берут средний результат.
Вычисления в объемном анализе
1. Вычисление нормальности анализируемого раствора по нормальности рабочего раствора
При взаимодействии двух веществ эквивалент одного вещества реагирует с эквивалентом другого.
Растворы различных веществ одной и той же нормальности содержат в равных объемах одинаковое число грамм-эквивалентов растворенного вещества.
Следовательно, одинаковые объемы таких растворов содержат эквивалентные количества вещества.
Поэтому, например, для нейтрализации 10 мл 1н. HCI требуется затратить ровно 10 мл 1н. раствора NaOH.
Растворы одинаковой нормальности вступают в реакцию в равных объемах.
Зная нормальность одного из двух реагирующих растворов и их объемы, расходуемые на титрование друг друга, легко определить неизвестную нормальность второго раствора.
Обозначим нормальность первого раствора через N2 и его объем
через V2.
Тогда на основании сказанного можно составить равенство
V1N1=V2N2
2. Вычисление титра по рабочему веществу
Титр — это выраженная в граммах масса растворённого вещества, содержащаяся в одном миллилитре раствора.
Вычисляют титр как отношение массы растворенного вещества к объему раствора (г/мл).
Т= m/ V
где: m - масса растворённого вещества г;
V - общий объём раствора, мл
Т = Э*N/1000, (г/мл)
Иногда для обозначения точной концентрации титрованных растворов пользуются так называемым поправочным коэффициентом или
поправкой К.
К = фактически взятая навеска/рассчитанная навеска.
Поправка показывает, на какое число нужно умножить объем данного раствора, чтобы привести ее к объему раствора определенной нормальности.
Очевидно, что если поправка для данного раствора больше единицы, то действительная нормальность его больше нормальности, принимаемой за эталон; если же поправка меньше единицы, то фактическая нормальность раствора меньше эталонной нормальности.
Пример.
Из 1,3400 г х. ч. («химически чистый» -содержание основного компонента более 99 %) NaCl приготовлено 200 мл раствора.
Вычислите поправку для приведения концентрации приготовленного раствора к точно 0,1 н.
Решение.
В 200 мл 0,1н раствора NaCl должно содержаться
58,44*0,1*200/1000 =1,1688г
Отсюда: К=1,3400/1,1688=1,146
Можно вычислить поправку как отношение титра приготовленного раствора к титру раствора определенной нормальности.
К = Титр приготовленного раствора/титр раствора определенной нормальности
В нашем примере титр приготовленного раствора равен
1,340/200= 0,00670 г/мл
Титр 0,1 н раствора NaCl равен 0,005844 г/мл
Отсюда К = 0,00670/0,005844=1,146
Вывод.
Если поправка для данного раствора больше единицы, то действительная нормальность его больше нормальности, принимаемой за эталон.
Если поправка меньше единицы, то действительная нормальность его меньше эталонной.
3. Вычисление количества определяемого вещества по титру рабочего раствора, выраженному в граммах определяемого вещества
Титр рабочего раствора в граммах определяемого вещества равен числу граммов определяемого вещества, которое эквивалентно количеству вещества, содержащегося в 1 мл рабочего раствора.
Зная титр рабочего раствора по определяемому веществу T и объем рабочего раствора, израсходованного на титрование, можно вычислить число граммов (массу) определяемого вещества.
Пример.
Вычислить процентное содержание Na2CO3 в образце, если для титрования навески 0, 100 гр. израсходовано 15,00 мл 0,1н. HCI.
Решение.
М (Na2CO3) =106,00 гр. Э(Na2CO3) =53,00 гр.
Т (HCI/ Na2CO3)= Э(Na2CO3)* N HCI./1000 г/мл
m(Na2CO3) = Т (HCI/ Na2CO3) VHCI=0,0053*15,00=0,0795 г.
Процентное содержание Na2CO3 равно 79, 5%
4. Вычисление числа миллиграмм-эквивалентов исследуемого вещества
Помножив нормальность рабочего раствора на объем его, израсходованный на титрование исследуемого вещества, получим число миллиграмм-эквивалентов растворенного вещества в оттитрованной части исследуемого вещества.
Пример.
Вычислить титр раствора NaOH, если известно, что его точная концентрация равна 0,0520 н.
Решение.
Напомним, что титром называется содержание в 1 мл раствора вещества в граммах.
Эквивалентная масса NaOH = 40,01 г. (40,01/1, где 1 – число гидроксильных групп кислоты).
Найдем, сколько граммов NaOH содержится в 1 л данного раствора:
40,01*0,0520 = 2,0805 г.
1литр раствора содержит 1000 мл
Т = 0,002081 г/мл
Можно воспользоваться также формулой:
Т = Э*N/1000 г/л
где Т - титр, г/мл
Э - эквивалентная масса
N - нормальность раствора
Тогда титр данного раствора:
40,01 0,0520/1000 = 0,00208 г/мл
Пример.
Вычислить нормальную концентрацию раствора HN03, если известно, что титр данного раствора равен 0,0065
Для расчета воспользуемся формулой:
Т = Э*N/1000 г/л, отсюда:
N =Т*1000/Э
0,0065*1000/63,05 = 0,1030 н.
Пример.
Какова нормальная концентрация раствора, если известно, что в 200 мл этого раствора содержится 2,6501 г Na2C03
Решение.
Э Na2C03 = 53,002
Найдем, сколько эквивалентов составляет 2,6501 г Na2C03
2,6501:53,002 = 0,05 экв.
Для того чтобы вычислить нормальную концентрацию раствора, составим пропорцию:
200 мл содержат - 0,05 экв.
1000 мл содержат - х экв.
х = 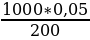 = 0,25 экв.
= 0,25 экв.
В 1 л данного раствора будет содержаться 0,25 эквивалентов, т. е. раствор будет 0,25 н.
Для такого расчета можно воспользоваться формулой:
N =Р 1000/Э V
где Р - количество вещества в граммах
Э - эквивалентная масса вещества
V - объем раствора в миллилитрах
Э Na2CO3 = 53,002, тогда нормальная концентрация данного раствора
2,6501 * 1000 /53,002 * 200 = 0,25
5. Перерасчет концентрации из одного вида в другой
В лабораторной практике часто приходится проводить пересчет концентрации имеющихся растворов из одних единиц в другие.
При пересчете процентной концентрации в молярную и наоборот необходимо помнить, что процентная концентрация рассчитывается на определенную массу раствора, а молярная и нормальная - на объем, поэтому для пересчета необходимо знать плотность раствора.
Плотность раствора приводится в справочниках в соответствующих таблицах или измеряется ареометром.
Если мы обозначим:
С - процентная концентрация
М - молярная концентрация
N - нормальная концентрация
d - плотность раствора
Э - эквивалентная масса
m - мольная масса,
то формулы для пересчета из процентной концентрации в молярную и нормальную будут следующими:
M = 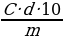 (1)
(1)
M = 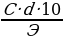 (2)
(2)
Пример.
Какова молярная и нормальная концентрация 12 % раствора серной кислоты, плотность которого d = l,08 г/см?
Решение. Мольная масса серной кислоты равна 98.
Следовательно,
Э н2so4 = 98:2 = 49
Подставляя необходимые значения в формулы, получим:
1) молярная концентрация 12 % раствора серной кислоты равна
М = 12*1,08*10/98 = 1,32 М
2) нормальная концентрация 12 % раствора серной кислоты равна
N = 12*1,08*10/49= 2,64 н.
Пример.
Какова процентная концентрация 1 н. раствора соляной кислоты, плотность которого 1,013?
Решение.
Мольная масса НСI равна 36,5, следовательно, Энсl = 36,5.
Из приведенной выше формулы (2) получим:
C = N * Э/10d
следовательно, процентная концентрация 1 н. раствора соляной кислоты равна
36,5*1/1,013*10 =3,6 %
Иногда в лабораторной практике приходится пересчитывать молярную концентрацию в нормальную и наоборот.
Если эквивалентная масса вещества равна мольной массе (например, КОН), то нормальная концентрация равна молярной концентрации.
Так, 1 н. раствор соляной кислоты будет одновременно 1 М раствором.
Однако для большинства соединений эквивалентная масса не равна мольной и, следовательно, нормальная концентрация растворов этих веществ не равна молярной концентрации.
Для пересчета из одной концентрации в другую мы можем пользоваться формулами:
М = (NЭ)/m
N = M(m/Э)
Пример.
Нормальная концентрация 1М раствора серной кислоты
Ответ - 2М
Пример.
Молярная концентрация 0,5 н. раствора Na2CО3
Ответ - 0,25 н.
6. Смешение и разбавление растворов
Если раствор разбавить водой, то его концентрация изменится обратно пропорционально изменению объема.
Если от разбавления объем раствора увеличится в два раза, то и его концентрация уменьшится в два раза.
При смешении нескольких растворов уменьшаются концентрации всех смешиваемых растворов.
При смешении двух растворов одного и того же вещества, но разных концентраций, получается раствор новой концентрации.
Если смешать А % и Б % растворы, то получим раствор С % концентрации, причем если А Б, то А С Б.
Новая концентрация ближе к концентрации того раствора, которого при смешении было взято большее количество.
7. Закон смешения растворов
Количества смешиваемых растворов обратно пропорциональны абсолютным разностям между их концентрациями и концентрацией получившегося раствора.
Закон смешения можно выразить математической формулой:
mA/mB = С - b/а - с
где mA, mB - количества растворов А и В, взятые для смешения;
a, b, c - соответственно концентрации растворов А и В и раствора, полученного в результате смешения
Если концентрация выражена в %, то количества смешиваемых растворов нужно брать в весовых единицах; если концентрации взяты в молях или нормалях, то количества смешиваемых растворов нужно выражать только в литрах.
Для облегчения использования правила смешивания применяют правило креста:
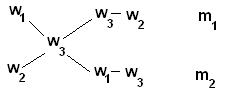
m1 / m2 = (w3 – w2) / (w1 – w3)
Для этого по диагонали из большего значения концентрации вычитают меньшую, получают (w1 - w3), w1 w3 и (w3 - w2), w3 w2.
Затем составляют отношение масс исходных растворов m1 / m2 и вычисляют.
Пример.
Определите массы исходных растворов с массовыми долями гидроксида натрия 5 % и 40 %, если при их смешивании образовался раствор массой 210 г с массовой долей гидроксида натрия 10 %.
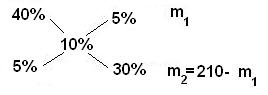
5/30 = m1/ (210 - m1)
1/6 = m1/ (210 - m1)
210 - m1 = 6m1
7m1 = 210
m1 =30 г;
m2 = 210 - m1 = 210–30 = 180 г






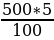 = 25 г
= 25 г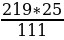 = 49,3 г
= 49,3 г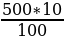 = 50 г
= 50 г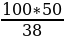 = 131,6 г
= 131,6 г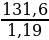 = 110, 6 мл (округляем до 111)
= 110, 6 мл (округляем до 111)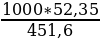 = 115,9 мл
= 115,9 мл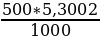 = 2,6501 г Na2C03
= 2,6501 г Na2C03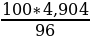 = 5,11 г H2S04
= 5,11 г H2S04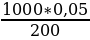 = 0,25 экв.
= 0,25 экв.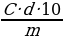 (1)
(1)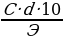 (2)
(2)











