Спецификация
проверочной работы для проведения промежуточной аттестации
по химии за курс 9 класса по химии в 2021 – 2022 учебном году
Назначение работы - оценить уровень освоения образовательной программы по химии за курс 9 класса.
Документы, определяющие содержание КИМ - содержание контрольной работы определяется на основе:
Примерной основной образовательной программы основного общего образования образовательного учреждения Основная школа, рекомендованной МОиН РФ;
Федерального Государственного Образовательного стандарта основного общего образования;
Учебного плана МБОУ Песчано – Ковалинской СОШ Лаишевского муниципального района РТ на 2021 - 2022 учебный год.
Федерального перечня учебников, рекомендованных (допущенных) к использованию в образовательном процессе в образовательных учреждениях, реализующих программы общего образования.
Критерии оценивания:
За верные ответы к заданиям под номерами 2,3,4,5,7,8,9,11,13,14,15 оцениваются в 1 балл; задания 1, 6, 10,12 оцениваются максимум в 2 балла. Если учащиеся допускаете в них 1 ошибку, то получают 1 балл, если ошибок будет больше, - 0 баллов. Задания 16-17 оцениваются максимум в 3 балла, если в заданиях правильно записаны два элемента ответа, задание оценивается в 2 балла, правильно записан один элемент ответа- 1балл, все элементы ответа записаны неверно или отсутствуют- 0 баллов.
Оценивание работы:
| Оценка | Количество баллов |
| «5» | 23-25 баллов |
| «4» | 19 -22 баллов |
| «3» | 15 -18 баллов |
| «2» | менее 15 баллов |
По содержанию работа позволит проверить успешность усвоения тем:
1. Периодический закон и периодическая система химических элементов.
2. Соединения химических элементов.
3. Химические реакции. Электролитическая диссоциация.
4. Химические свойства металлов и неметаллов и их соединений.
5. Способы получения веществ, применение веществ и химических реакций.
6. Количество вещества. Моль.
7. Окислительно-восстановительные реакции.
8. Реакции ионного обмена.
9. Расчеты по уравнению химической реакции.
Работа позволит выявить сформированность следующих предметных умений:
1. Описывать свойства элементов и их соединений по положению в периодической системе.
2.Определять степень окисления химических элементов.
3. Называть вещества, классифицировать их, описывать свойства и способы получения.
4. Составлять уравнения химических реакций разных типов, уравнения ЭД.
5. Проводить вычисления по химическим формулам и уравнениям.
Работа позволит выявить усвоение содержания на базовом уровне (Б), повышенном (П) и высоком (В).
На выполнение итоговой контрольной работы отводится 40 минут.
Промежуточная аттестация
по химии
учени … 9 класса
ФИ________________________________________
Дата ______________________________________
Выберите два высказывания, в которых говорится о сере как о химическом элементе:
1) Сера входит в состав некоторых аминокислот
2) Сера — это порошок жёлтого цвета, который не смачивается водой
3) Молекула сероводорода состоит из двух атомов водорода и одного атома серы
4) Сера не притягивается магнитом
5) Серу применяют для вулканизации каучука
Сколько электронов находится во внешнем электронном слое атома, в ядре которого 14 протонов?
1) 2 2) 4 3) 8 4) 14
Наиболее сильными кислотными свойствами обладает высший оксид
1) фосфора 2) кремния 3) хлора 4) алюминия
В ряду веществ: NaCl; HClO; Cl2O; ССl4; КСlO3 — количество веществ, в которых степень окисления атомов хлора −1, равно
1) 1 2) 2 3) 3 4) 4
Какой вид химической связи в оксиде бария?
1) ковалентная неполярная 2) металлическая 3) ковалентная полярная 4) ионная
Какие два утверждения верны для характеристики как германия, так и олова?
Число протонов в ядре атома химического элемента равно 41
Химический элемент имеет 4 валентных электронов
Химический элемент образует высший оксид вида ЭО2
Химический элемент является металлом
Электроны в атоме расположены на четырёх электронных слоях
К сложным веществам относится
1) йод 2) графит 3) воздух 4) сода
Кислород непосредственно не взаимодействует
1) хлором 2) фосфором 3) серой 4) железом
Оксид железа (III) реагирует с
1) гидроксидом меди (II) 2) хлоридом магния
3) серной кислотой 4) оксидом алюминия
Установите соответствие между реагирующими веществами и продуктами(-ом) их взаимодействия: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРОДУКТЫ ВЗАИМОДЕЙСТВИЯ |
| A) Na2CO3 + HCl = | 1) NaCl + CO2 + H2O |
| Б) Na2CO3 + CO2 + H2O = | 2) NaHCO3 + HCl |
| B) Na2CO3 + CaCl2 = | 3) NaOH + NaHCO3 |
|
| 4) NaHCO3 |
|
| 5) NaCl + CaCO3 |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
В реакцию замещения вступают между собой
1) SO2 и O2
2) CaO и CO2
3) Na и H2O
4) Fe2O3 и CO
Установите соответствие между реагирующими веществами и признаком протекающей между ними реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | | ПРИЗНАК РЕАКЦИИ |
| А) AgNO3 и KCl Б) AgNO3 и KBr В) AgNO3 и KI | | 1) выпадение красного осадка 2) выпадение бледно-жёлтого осадка 3) выпадение насыщенно-жёлтого осадка 4) выпадение белого творожистого осадка |
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
3 моль анионов образуется при полной диссоциации 1 моль
1) фосфата калия 2) нитрата натрия 3) сульфата меди (II) 4) хлорида железа (III)
Верны ли следующие суждения о чистых веществах и смесях и способах их разделения?
А. Чистые вещества имеют постоянный состав.
Б. Смесь поваренной соли с речным песком можно разделить с помощью добавления воды и последующего фильтрования и выпаривания.
1) верно только А 2) верно только Б
3) верны оба суждения 4) оба суждения неверны
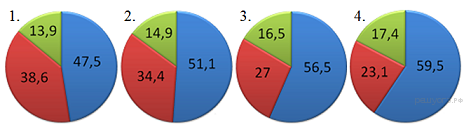
15.На какой диаграмме распределение массовых долей элементов соответствует количественному составу нитрата калия?
16. Используя метод электронного баланса, составьте уравнение реакции по схеме:
H2S + KClO3=S+KCL+H2O
Определите окислитель и восстановитель.
17. К раствору сульфата алюминия массой 68,4 г и массовой долей 8% прилили избыток раствора хлорида бария. Вычислите массу образовавшегося осадка.
Критерии и нормы оценки
Критерии оценивания: За верные ответы к заданиям под номерами 2,3,4,5,7,8,9,11,13,14,15 оцениваются в 1 балл; задания 1, 6, 10,12 оцениваются максимум в 2 балла. Если учащиеся допускаете в них 1 ошибку, то получают 1 балл, если ошибок будет больше, - 0 баллов. Задания 16-17 оцениваются максимум в 3 балла, если в заданиях правильно записаны два элемента ответа, задание оценивается в 2 балла, правильно записан один элемент ответа- 1балл, все элементы ответа записаны неверно или отсутствуют- 0 баллов.
Максимальное количество баллов – 25.
| № задания | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| ответ | 13 | 2 | 3 | 2 | 4 | 23 | 4 | 1 | 3 | 145 | 3 | 423 | 4 | 3 | 1 |
| баллы | 2 | 1 | 1 | 1 | 1 | 2 | 1 | 1 | 1 | 2 | 1 | 2 | 1 | 1 | 1 |
Задание 16.
H2S+KClO3=S+KCL+H2O
S2- -2e=S0/6/3/восстановитель
Cl+5 +6e=Cl/2/1 окислитель
3H2S+KClO3=3S+KCL+3H2O
| Критерии оценивания выполнения задания | Баллы |
| Ответ правильный и полный, включает все выше названные элементы | 3 |
| Правильно записаны два элемента ответа | 2 |
| Правильно записан один элемент ответа | 1 |
| Все элементы ответа записаны неверно или отсутствуют | 0 |
| Максимальный балл | 3 |
Составим уравнение реакции
Al2(SO4)3+3BaSO4+2AlCl3
Рассчитаем массу и количество вещества сульфата алюминия, содержащегося в растворе
m(Al2(SO4)3)= mр-ра*W/100=68.4*0.08=5.47г
n(Al2(SO4)3)= m(Al2(SO4)3)/M(Al2(SO4)3)=5.47/342=0.016моль
Определим массу осадка по уравнению реакции.
n(BaSO4)=3n(Al2(SO4)3)=0.048моль
m(BaSO4)=n(BaSO4)*M=0.048*233=11.184г
Ответ: 11.184г
Задание 17.
| Критерии оценивания выполнения задания | Баллы |
| Ответ правильный и полный, включает все названные элементы | 3 |
| Правильно записаны два первых из названных выше элементов | 2 |
| Правильно записан один из названных выше элементов | 1 |
| Все элементы ответа записаны неверно или отсутствуют | 0 |
| Максимальный балл | 3 |


















