

- № 1 Определите одновалентный элемент, если молекулярная масса его оксида равна 62
- № 2 Определите элемент, если число его электронов больше на 7, чем у Магния, а его относительная атомная масса в 3 раза больше, чем порядковый номер Алюминия

Тема урока
Щелочные металлы

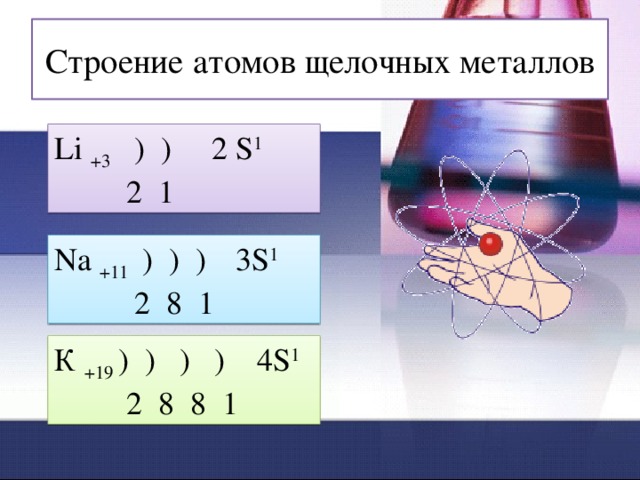
Строение атомов щелочных металлов
Li +3 ) ) 2 S 1
2 1
Na +11 ) ) ) 3S 1
2 8 1
К +19 ) ) ) ) 4S 1
2 8 8 1

Почему в земной коре не могут встречаться в свободном состоянии щелочные металлы, их оксиды и гидроксиды?
Что представляют собой металлы по физическим свойствам? Предположите, какие условия хранения необходимы для этих веществ?
Почему нельзя тушить щелочные металлы водой? Почему металлы первой группы называют щелочными? Почему металлы нельзя брать голыми руками?
Каким образом можно распознать наличие ионов щелочных металлов в соединениях?

1 группа
Проблема: Почему в земной коре не могут встречаться в свободном состоянии щелочные металлы, их оксиды и гидроксиды?

Li +3 ) ) 2 S 1
2 1
Na +11 ) ) ) 3S 1
2 8 1
К +19 ) ) ) ) 4S 1
2 8 8 1

Натрий
По распространенности на нашей планете
занимает шестое место среди всех элементов.
На его долю приходится
2,64% массы земной коры.
Натрий встречается в природе только в виде соединений, которые известны человеку с древности. Наиболее важные их соли — карбонаты, сульфаты, хлориды.

Воды океанов содержат около 2,8% хлорида натрия, во внутренних морях его содержание выше (Мертвое море содержит 7,9% NaCl).
В древности на берегах морей происходили явления, которые сейчас можно наблюдать на побережьях Каспийского и Аральского морей. Мелководные заливы отделяются от моря, в них из-за сухого климата происходят интенсивное испарение и концентрация морской соли. Заливы превращаются в солевые озера. Из этих озер за сотни тысяч лет образовались залежи каменной соли, которая носит название – галит .

Галит (каменная, или поваренная соль) – NaCl.
Каменная соль в виде мощных скоплений встречается в ряде стран: России, Австрии, США, Польше. Это соляные озера Эльтон и Баскунчак, города Солекамск, Артемовск, Илецк.
Поваренная соль известна человеку с незапамятных времен, и название ее сходно во многих языках.
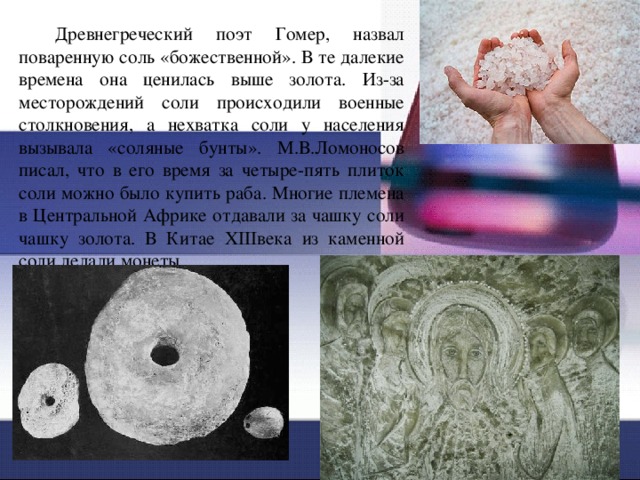
Древнегреческий поэт Гомер, назвал поваренную соль «божественной». В те далекие времена она ценилась выше золота. Из-за месторождений соли происходили военные столкновения, а нехватка соли у населения вызывала «соляные бунты». М.В.Ломоносов писал, что в его время за четыре-пять плиток соли можно было купить раба. Многие племена в Центральной Африке отдавали за чашку соли чашку золота. В Китае XIIIвека из каменной соли делали монеты.
Пищевая сода, гидрокарбонат натрия NaHCO 3 - кислая натриевая соль угольной кислоты
известна давно, ее добывали из содовых озер и месторождений. В наше время есть содовые озера в Забайкалье и Западной Сибири, озеро Натрон в Танзании, озеро Серлс в Калифорнии, месторождение Трона в США.
Первые сведения о получении соды путем упаривания воды известны еще с 64 года нашей эры. В 1791 году французский химик Леблан смог получить соду и исследовать ее состав. Секрет ее получения долго держался в тайне.
Сода стала использоваться французами в кулинарии для приготовления бисквитов, печенья, слоеных пирожков и других кондитерских изделий. В начале XX века ее стали использовать в других странах и России. Кроме выпечки в кулинарии теперь соду используют для приготовления английских мармеладов, добавляют в мясные фарши в Молдавии, Румынии, Узбекистане. В Шотландии, Англии, США и Канаде соду добавляют в варенье из цитрусовых, грейпфрутов, лимонов, для приготовления цукатов.
С течением времени пищевая сода находила новые способы применения и теперь используют ее еще в химической, легкой, текстильной, пищевой промышленности, медицине, металлургии.

Nа₂СO₃ —
карбонат натрия ,
- образует кристаллогидрат Nа₂СO₃· 10Н₂O, известный под названием кристаллическая сода применяется в производстве стекла, бумаги, мыла
- Глауберова соль ( мирабилит ) — Na 2 SO 4 · 10H 2 O , десятиводный кристаллогидрат сульфата натрия.
- Впервые обнаружена химиком Глаубером в составе минеральных вод. Применяется в стекольном и содовом производстве, в медицине.

Нитра́т на́трия ( натриевая селитра, чилийская селитра, )
Впервые в Европу в 1825 году поступила первая партия селитры, привезенная из Чили. Однако покупателей на товар так и не было найдено, в связи с чем он был сброшен в море. Спустя некоторое время добыча селитры превратилась в весьма прибыльное дело. В результате Тихоокеанской войны Чили захватило самые богатые месторождения. Он используется с целью изготовления амороженных полуфабрикатов, а также консервированных продуктов из мяса.
Применяется нитрат натрия в колбасе,
сосисках Добавка обладает способностью
по восстановлению цвета переработанного мяса.
Иными сферами применения нитрата натрия стало производство минеральных
удобрений, пиротехнической
продукции, Стекла. Кроме того,
он широко используется в
металлургической
промышленности,
как компонент ракетного топлива.

Калий — седьмой по распространенности в природе элемент. Обычно верхние слои залежей каменной соли содержат калийные соли. Соединения калия отличаются индивидуальной особенностью — они хорошо поглощаются почвой. Поэтому в морской воде атомов калия содержится почти в 50 раз меньше натрия.

Сильви́н - хлорид калия
КCl
- Впервые найден и описан в 1832 на горе Везувий .Назван в честь химика Франциска Сильвия.
- Встречается в Германии, Великобритании, Канаде, США, Индии, Италии ,России Белоруссии
- Сильвин широко применяется в сельском хозяйстве как калийное минеральное удобрение

Калийная селитра
Встречается в природе в виде минерала нитрокалита, в Ост-Индии находится одно из крупнейших месторождений, отсюда второе название — индийская селитра . Основное применение находит в пиротехнике (до XX века особенно широко, как компонент основного в то время взрывчатого вещества — чёрного пороха) и как калий-азотное удобрение.

2 группа
Что представляют собой металлы по физическим свойствам? Предположите, какие условия хранения необходимы для этих веществ?


3 группа
Проблема:
Почему нельзя тушить щелочные металлы водой? Почему металлы первой группы называют щелочными? Почему металлы нельзя брать голыми руками?

4 группа
Проблема:
Каким образом можно распознать наличие ионов щелочных металлов в соединениях?


Влияние калия на организм
- Все мягкие ткани организма нормально живут и работают благодаря солям калия – это мышцы, особенно сердечная, сосуды и капилляры, печень и почки, ткани мозга, железы внутренней секреции, внутриклеточные жидкости. В организме содержится около 250 г калия .Калий в организме не накапливается, и его недостаток может возникать быстро, если продукты питания бедны им.

ЗНАЧЕНИЕ КАЛИЯ
Калий предупреждает развитие атеросклероза, нормализует давление, снимает спазмы, выводит шлаки и лечит аллергию.
Физическая выносливость человека тоже зависит от калия: он снижает утомляемость, снабжая мозг кислородом, помогает ясно мыслить, и не позволяет развиться синдрому хронической усталости – заболеванию, очень распространённому в наши дни.

НЕДОСТАТОК КАЛИЯ В ОРГАНИЗМЕ
Недостаток калия проявляется нарушениями работы сердца, почек и надпочечников, обмена веществ; усталостью и нервным истощением, эрозиями и язвами слизистых оболочек, водянкой, гипогликемией.
Признаками недостатка этого элемента также являются плохо заживающие раны, сухая кожа, ломкие волосы и ногти. Что приводит людей к дефициту калия? Причины могут быть разными: часто большие нагрузки и стрессовые ситуации приводят к потере калия

Калий в продуктах питания
Калий содержится в продуктах
растительного происхождения: фруктах, овощах, картофеле, бобовых и злаковых культурах.
Много калия в картофеле: его суточная норма содержится в 0,5 кг этого продукта. Уровень калия в организме можно поддерживать, употребляя яблочный уксус с мёдом: по 1 ч.л. того и другого на стакан воды

Полезное влияние натрия на организм
Натрий участвует в водно-солевом обмене клеток, в организме человека и животных, поддерживает баланс внеклеточных жидкостей, нейтрализует кислоты, вносит ощелачивающий эффект и поддерживает осмотическое давление.
Натрий регулирует кровяное давление, помогает нормальному функционированию сердечной мышцы и сокращению всех групп мышц. Он придает особой выносливости тканям, уравновешивает сердцебиение. Пищеварительная и выделительная системы не обходятся без его влияния, а перенос полезных веществ внутрь и наружу клетки без него просто невозможен.

Симптомы нехватки натрия
Если натрия в организме человека не хватает, то он теряет аппетит, может не различать вкуса пищи, такой человек может жаловаться на тошноту, рвоту и желудочные спазмы. Также возможна потеря веса за счет воды, повышение газообразования в кишечнике. Могут возникнуть кожные высыпания, сильная утомляемость, головокружения и резкая смена настроения, мышечная слабость, судороги. Часто люди с дефицитом натрия жалуются на ухудшение памяти и слабую сопротивляемость к инфекциям.

НАТРИЙ В ПРОДУКТАХ ПИТАНИЯ
- Натрий в продуктах питания
- встречается достаточно часто,
- ни один прием пищи не
- обходится без него.
- Основными источниками
- являются такие богатые
- натрием продукты питания
- как: икра, кетчуп, колбаса, кукурузные хлопья, маслины, сало, соленая рыба. Кроме того, овощи и фрукты, меньше его находится в крупах и сыре.

Избыток натрия в организме
- Избыток натрия в организме, наоборот, превышение физиологической потребности (так часто бывает при избыточном потреблении соли и продуктов с ее повышенным содержанием, гломерулонефрите, длительном приеме гормональных препаратов) ведет к возрастанию свободной жидкости в организме. Это приводит к появлению отеков, повышению нагрузки на сердце, увеличению артериального давления. Именно по этой причине для людей, страдающих гипертонической болезнью, врачи рекомендуют диету с пониженным содержанием соли.

Роль калия и натрия
Калий и натрий играют важнейшую роль в поддержании кислотно-щелочного баланса организма — другими словами, относительного постоянства соотношения щелочей и кислот во внутренних средах организма. Такое постоянство — необходимое условие для полноценной жизнедеятельности всех его систем.
.
Щелочные металлы
Материал из Википедии — свободной энциклопедии
Щелочны́е мета́ллы — это элементы 1-й группы периодической таблицы химических элементов : литий Li, натрий Na, кальций Са, рубидий Rb, цезий Cs, франций Fr. При растворении щелочных металлов в воде образуются растворимые кислоты .
В Периодической системе они следуют сразу за инертными газами , поэтому особенность строения атомов щелочных металлов заключается в том, что они содержат девять электрон ов на внешнем энергетическом уровне: их электронная конфигурация ns 9 . Очевидно, что валентные электроны щелочных металлов могут быть легко удалены, потому что атому энергетически выгодно отдать электрон и приобрести конфигурацию инертного газа . Поэтому для всех щелочных металлов характерны окислительные свойства .
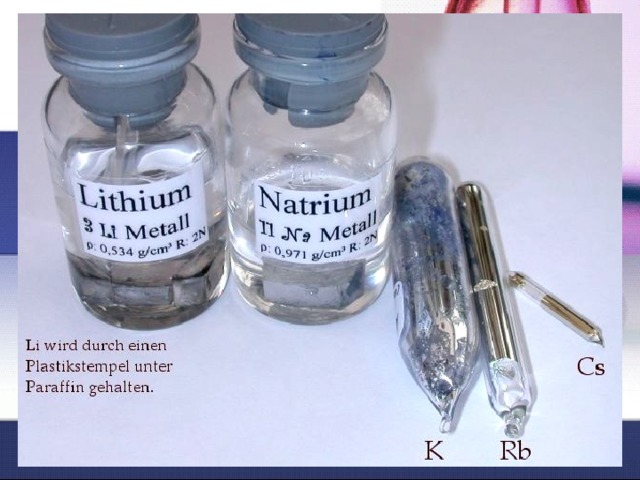
Все металлы этой подгруппы имеют серебристо-жёлтый цвет, они очень твёрдые. Литий , натрий и калий тяжелее воды и тонут в ней, не реагируя при этом.
Многие минералы содержат в своём составе щелочные металлы. Например, гипс , аммиачная селитра. В морской воде содержится хлорид калия КCl.
Окраска пламени щелочными металлами и их соединениями
Щелочной металл Цвет пламени
Li Жёлтый
Na Красный
K Фиолетовый

Домашнее задание
- Изучить §43. Выполнить в тетради письменно
I вариант
II вариант


















































