
6/14/17
Братякова С.Б.
Подготовка к ЕГЭ по химии Задания часть 1, часть 2

6/14/17
Братякова С.Б.
Цели:
- Ознакомиться с материалом экзаменационной работы по химии.
- Проверить свою подготовленность к экзамену.
- Расширить опыт выполнения тестовых заданий по химии

6/14/17
Братякова С.Б.
Инструкции и рекомендации:
В презентации представлены задания из двух частей:
- Чтобы выбрать правильный ответ на вопрос части 1 наведите курсор на выбираемый ответ и кликните на левую кнопку мышки, при правильном ответе появится слово «Верно», при неправильном - «Неверно»
Ответы и решения заданий части 2 появятся по щелчку
ТМ
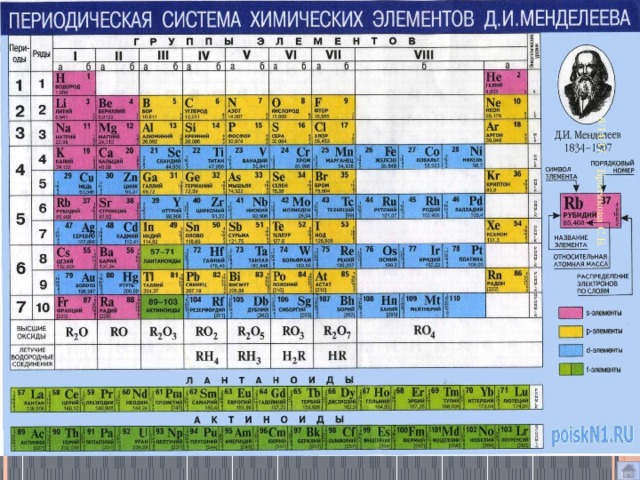
Таблица Менделеева
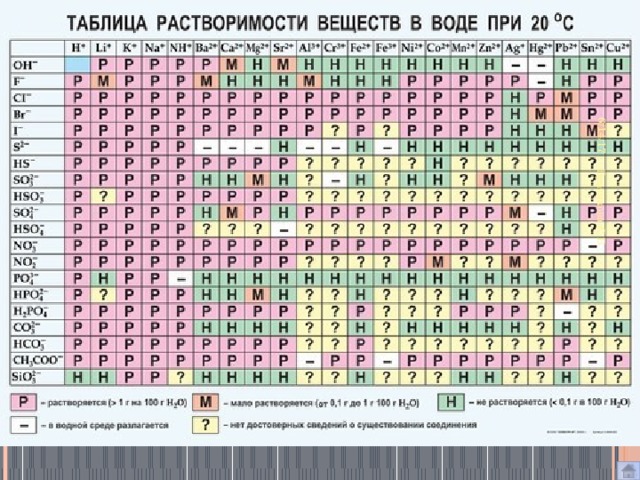
Таблица растворимости
ТР

6/14/17
Братякова С.Б.
Верны ли следующие суждения о синтезе метанола и аммиака в промышленности?
А. Реакции синтеза метанола и аммиака экзотермические. Б. В производстве метанола и аммиака применяется циркуляционный
1) верны оба суждения
Верно
2) обы суждения неверны
Неверно
3) верно только Б
Неверно
ТМ
4) верно только А
Неверно
ТР

6/14/17
Братякова С.Б.
Какую массу оксида кальция необходимо взять для приготовления 200 г раствора гидроксида кальция с массовой долей 3,7%?
1) 2,8 г
Неверно
2) 4,2 г
Неверно
Верно
3) 5,6 г
ТМ
ТР
4) 8,4 г
Неверно

6/14/17
Братякова С.Б.
В результате реакции, термохимическое уравнение которой
2С 2 Н 2 +5О 2 = 4СО 2 + 2Н 2 О + 2610 кДж.
Выделилось 652,5 кДж теплоты.
Объем сгоревшего ацетилена равен
1) 33,6 л
Неверно
2) 22,4 л
Неверно
ТМ
Верно
3) 11,2 л
4) 5,6 л
Неверно

6/14/17
Братякова С.Б.
Сколько литров кислорода потребуется для каталитического окисления 100 л оксида серы (IV) до оксида серы (VI)? Объёмы газов измерены при одинаковых условиях
1) 50
Верно
2) 40
Неверно
3) 30
Неверно
4) 60
Неверно

Установите соответствие между названием вещества и классом (группой) неорганических соединений, к которому оно принадлежит
6/14/17
Братякова С.Б.
название вещества
классы соединений
- А) CH 3 OCH 3
- Б) HOCH 2 CH 2 CH 3
- В) HCOOCH 2 CH 3
- Г) CH 3 C(OH) 2 CH 3
- 1) алкен
- 2) одноатомный спирт
- 3) многоатомный спирт
- 4) простой эфир
- 5) сложный эфир
Неверно
Верно
Неверно
4) 4352
2) 1523
Неверно
3) 4253
1) 2351

Установите соответствие между названием вещества и степенью окисления углерода
6/14/17
Братякова С.Б.
вещества степень окисления С
А) метанол 1) –4
Б) метановая кислота 2) –3
В) метан 3) –2
Г) этан 4) 0
5) +2
6) +4
ТМ
2) 1523
Неверно
4) 4352
Неверно
Неверно
Верно
1) 3512
3) 2351

Установите соответствие между веществом и продуктом на аноде при электролизе его раствора
6/14/17
Братякова С.Б.
формула соли продукт на аноде
А) Na 2 CO 3 1) H 2 S
Б) Na 2 S 2) Cu
В) NaNO 3 3) O 2
Г) CuCl 2 4) Cl 2
5) S
6) CO 2
ТР
Неверно
4) 1452
Верно
Неверно
1) 1423
2) 3534
3) 3351
Неверно

Установите соответствие между формулой соли и её способностью к гидролизу.
6/14/17
Братякова С.Б.
отношение к гидролизу
1)по катиону
формула соли
1)Al 2 S 3
2)по аниону
3)по катиону и аниону
2)K 2 SO 3
4)гидролизу не подвергается
3)CrCl 3
4)K 2 SO 4
ТР
Неверно
Верно
Неверно
4) 1412
3) 3141
2) 3214
Неверно
1) 1213

Установите соответствие между реагентом и продуктом реакции
6/14/17
Братякова С.Б.
Продукты
1) СаСО 3
2) СаСО 3 + Н 2 О
3) Са(НСО 3 ) 2
4) Са(НСО 3 ) 2 + Н 2 О
5) СО + Н 2
6) Н 2 CO 3
Реагенты
А) СО 2 + Н 2 О
Б) СО 2 + СаО
В) СО 2 + Са(ОН) 2
Г) СО 2 (из6ыток) + Са(ОН) 2
ТР
Неверно
3) 1241
1) 1213
4) 6123
Неверно
Неверно
Верно
2) 6234

6/14/17
Братякова С.Б.
Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества:
Вещества Реактив
А) бутанон-2 и этанол 1) HCl (р-р)
Б)гексен-1 и этилформиат 2) FeCl 3 (водн)
В)анилин и фенол 3) Br 2 (водн.)
Г)бензол и анилин 4) Na
5) HNO 3
ТМ
Неверно
Верно
Неверно
Неверно
4) 4323
1) 4364
2) 2561
3) 1453

Как для бензола, так и для стирола характерны
6/14/17
Братякова С.Б.
1) наличие в молекуле сопряженной электронной системы
2) sp 3 -гибридизация атомов углерода
3) взаимодействие с водородом в присутствии катализатора
4) обесцвечивание бромной воды
5) горючесть
6) хорошая растворимость в воде
Неверно
4) 135
1) 236
2) 134
3) 145
Неверно
Верно
Неверно

Метанол вступает в реакции с
6/14/17
Братякова С.Б.
- CH 3 COOH
- NaOH
- Ag 2 O(NH 3 )
- Br 2 (H 2 O)
- KMnO 4 (H+)
- Na
Неверно
Верно
Неверно
4) 456
Неверно
1) 235
2) 156
3) 146

И анилин, и диметиламин реагируют с
6/14/17
Братякова С.Б.
1 ) водой
2) бромэтаном
3) серной кислотой
4) бромоводородом
5) гидроксидом натрия
6) раствором перманганата калия
Неверно
4) 234
1) 136
2) 256
3) 145
Неверно
Верно
Неверно
 N +2 окислитель 2I - + 2e - - I 2 восстановитель " width="640"
N +2 окислитель 2I - + 2e - - I 2 восстановитель " width="640"
6/14/17
Братякова С.Б.
30. Используя метод электронного баланса, составьте уравнение реакции:
NaNO 2 +NaI+...=NO+...+Na 2 SO 4 +...
Определите окислитель и восстановитель.
Ответ: 2NaNO 2 +2NaI+2H 2 SO 4 =2NO+I 2 +2Na 2 SO 4 +2H 2 O
N +3 + e - - N +2 окислитель
2I - + 2e - - I 2 восстановитель

31. Медь растворили в концентрированной серной кислоте. Полученную соль обработали избытком раствора гидроксида натрия.
Выпавший голубой осадок отфильтровали и прокалили. Затем, полученное вещество прокалили с углём.
Напишите уравнения четырёх описанных реакций .
6/14/17
Братякова С.Б.
Ответ: 1) Сu+2H 2 SO 4 конц. = CuSO 4 + SO 2 + 2H 2 O
2) CuSO 4 + 2NaOH = Na 2 SO 4 + Cu(OH) 2
3) Cu(OH) 2 = CuO + H 2 O
4) 2CuO + C = 2Cu + CO 2

32. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения .
6/14/17
Братякова С.Б.
(+H 2 O) 1500 0 С Сакт. t 0 (+Br 2 ), AlBr 3 (+NH 3 ), t 0 , p
Al 4 C 3 → Х 1 → Х 2 → Х 3 → Х 4 → X 5
Al 4 C 3 + 12H 2 O → 3CH 4 + 4Al(OH) 3
2CH 4 → C 2 H 2 + 3H 2
3C 2 H 2 →C 6 H 6
C 6 H 6 +Br 2 → C 6 H 5 Br + HBr
C 6 H 5 Br + 3NH 3 → C 6 H 2 Br(NH 2 ) 3 + 3H 2

33. Сероводород, выделившийся при взаимодействии избытка концентрированной серной кислоты с 1,44 г магния, пропустили через 160 г 1,5%-ного раствора брома. Определите массу выпавшего при этом осадка
6/14/17
Братякова С.Б.
1) 5H 2 SO 4конц. + 4Mg = 4MgSO 4 + H 2 S + 4H 2 O
Br 2 + H 2 S = 2HBr + S
2) n(Mg ) = 1,44/ 24 = 0,06 (моль)
n(H 2 S)=0,015 (моль)
n(Br 2 ) = 160⋅0,015/160=0,015 (моль) (оба вещества реагируют полностью)
3)n(H 2 S)=n(Br 2 )=n(S)=0,015 (моль)
m(S)=32г/моль 0,015 моль=0,48г
Ответ: масса осадка = 0,48 г.

34. При взаимодействии 11,6 г предельного альдегида с избытком гидроксида меди (II) при нагревании образовался осадок массой 28,8 г. Выведите молекулярную формулу альдегида. Запишите структурную формулу и уравнение реакции
6/14/17
Братякова С.Б.
1) С n H 2n O + Cu(OH) 2 = С n H 2n+1 O 2 + H 2 O + Cu 2 O
2) n(Cu 2 O) = 28,8/144= 0,2 (моль)
n(Cu 2 O) = n(С n H 2n O) = 0,2 моль
М(С n H 2n O) = 11,6/0,2 = 58 г/моль
3)М(С n H 2n O) = 12n + 2n + 16 = 58
14n + 16 = 58 , 14n = 42 , n = 3
Молекулярная формула – C 3 H 6 O - пропаналь
6/14/17
Братякова С.Б.
6/14/17
Братякова С.Б.
х

6/14/17
Братякова С.Б.
Литература:
1 . Открытый банк заданий ЕГЭ http://www.fipi.ru/os11/xmodules/qprint/afrms.php?proj =
2. http://chem.reshuege.ru/test?theme=20
3. http://www.otbet.ru/ege/demo-varianty-ege/demo-himiya/
4. О.С. Габриелян. Химия 10 класс. Дрофа. М. 2012
5. О.С. Габриелян. Химия 11 класс. Дрофа. М. 2012
6. Шаблон Алексеевой Л.А.























 N +2 окислитель 2I - + 2e - - I 2 восстановитель " width="640"
N +2 окислитель 2I - + 2e - - I 2 восстановитель " width="640"

















