© 2020, Извекова Татьяна Геннадиевна 1366 37


СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Скидки до 50 % на комплекты
только до
Готовые ключевые этапы урока всегда будут у вас под рукой
Организационный момент
Проверка знаний
Объяснение материала
Закрепление изученного
Итоги урока


«Система подготовки учащихся к ОГЭ и ЕГЭ и химии»
Трансляция педагогического опыта, наработанного за время преподавания предмета химии в общеобразовательных классах и внеурочной деятельности, создание условий для реализации прав учащихся на качественное образование в ходе подготовки и проведения итоговой аттестации.
Просмотр содержимого документа
««Система подготовки учащихся к ОГЭ и ЕГЭ и химии»»
Тема: «Система подготовки учащихся к ОГЭ и ЕГЭ и химии»
Цель: Трансляция педагогического опыта, наработанного за время преподавания предмета химии в общеобразовательных классах и внеурочной деятельности, создание условий для реализации прав учащихся на качественное образование в ходе подготовки и проведения итоговой аттестации.
Задачи: - формирование интереса к изучению предметов естественно - научного цикла;
- осуществление информационного, методического, психолого-педагогического обеспечение итоговой аттестации выпускников 9 и 11 классов;
- выявление соответствия подготовки выпускников требованиям образовательных стандартов;
- обеспечение психологического комфорта и правовой защищенности всех участников образовательного процесса в ходе проведения итоговой аттестации.
- апробация новых технологий обучения;
- разработка методик урочной и самостоятельной работы учащихся по подготовке к ГИА (9 класс) и ЕГЭ (11 класс).
Пояснительная записка
Таким образом, работа мастер-класса имеет более широкие возможности и спектр передачи опыта работы в обозначенном направлении. При этом учитываются возможности школы для формирования у учащихся интереса к предметам естественно - научного цикла, возможности тесного контактирования между учащимися разных школ для создания хорошей конкуренции в направлении получения и использования знаний по химии. Это даст более высокий уровень подготовленности учащихся к сдаче выпускных экзаменов в форме ОГЭ и ЕГЭ и успешного поступления старшеклассников в ВУЗы.
Подготовка учащихся к ОГЭ и ЕГЭ - это длительная и кропотливая работа учителя. В нашей школе эта работа реализуется в рамках программы, которая предусматривает различные направления деятельности: организационно-методическая работа, повышение профессиональной компетентности учителя, изучение нормативных документов различного уровня, работа с учащимися и их родителями, аналитическая работа по результативности проведения итоговой аттестации.
Главной организационной формой обучения в средней школе является урок, потому что только на нем реализуется учебная программа.
Для того чтобы подготовиться и успешно сдать ОГЭ (ЕГЭ), необходимо представлять уровень требований, возможную его структуру и особенности тестовых заданий. Варианты заданий ОГЭ и ЕГЭ по химии предполагают знания у выпускников базового и повышенного уровня, требуемого для подготовки абитуриентов, предусмотренных современным образовательным стандартом и программами по химии, рекомендованными Министерством образования РФ.
Работа проводится в соответствие с составленным и утвержденным планом.
На протяжении 2017 -2018 учебного года были проведены следующие мероприятия:
1. План подготовки к ГИА по химии 9 классах. План работы учителя химии 11 класса по подготовке к ЕГЭ. (приложение 1). Был проведен круглый стол. Учителя химии школ города Пятигорска приняли участие в обсуждении данного вопроса.
2. Система подготовки учащихся к новой форме государственной итоговой аттестации (ОГЭ) и ЕГЭ. При проведении круглова стола были использованы различные презентации, на которых были представлены тесты, которые используются на уроках и программа курсов по подготовке к ГИА (9 класс)
3. Окислительно – восстановительные реакции в органической химии. Генетическая связь между классами органических соединений. (Задание 33) (приложение 3). Было проведено практическое занятие по составлению ОВР.
4. Учебный химический эксперимент (демонстрационные и лабораторные опыты, практические работы, виртуальные) при подготовке к ГИА (9 класс) и ЕГЭ (11 класс) (приложение 4).
Приложение 1
Тема: «План подготовки к ГИА по химии 9 классах.
План работы учителя химии 11 класса по подготовке к ЕГЭ»
«Важнейшее условие духовного роста педагога- это прежде всего время- свободное время учителя. Пора понять, что чем меньше у учителя свободного времени, чем больше он загружен всевозможными планами, отчетами, заседаниями, тем больше опустошается его духовный мир, тем скорее наступит та фаза его жизни, когда учителю уже нечего будет отдавать воспитанникам
(В.А. Сухомлинский)
Значимый учитель сегодня – это одновременно профессионал и личность. Учитель постоянно находится между практикой и теорией, наращивая свой опыт преимущественно практическими умениями. Проблема профессиональной компетентности учителя давно находится в центре внимания педагогической науки. Ей посвящен широкий круг исследований, в которых подняты и проанализированы вопросы о сущности и структуре профессиональной компетентности педагога, влиянии профессиональной компетентности и ее составляющих на характер и результаты деятельности учителя.
Важнейшим показателем качества образования является объективная оценка учебных достижений учащихся. Этот показатель важен как для всей системы образования, так и для каждого отдельного ученика.
При подготовки обучающихся к ЕГЭ и ГИА учитель часто сталкивается с различными проблемами.
Анализ трудностей при подготовке учащихся к экзаменам помогает найти наиболее эффективные пути их решения.
Психолого-педагогическое просвещение всех участников итоговой аттестации состоит в предоставлении информации о цели, задачах, принципах, требованиях, правилах и сроках проведения и т.д.
Психолого-педагогическая подготовка всех участников ГИА и ЕГЭ, заключающаяся в работе с учителями, учениками и их родителями, состоящей из формирования положительного отношения всех участников экзамена, разрешения прогнозируемых трудностей, формирования и развития определенных знаний, умений и навыков, необходимых для ЕГЭ и ГИА.
Подготовка учащихся к тестированию связана с развитием у учащихся умения работать с различными видами тестовых заданий, а у педагогов умения разрабатывать и использовать тесты школьных достижений в учебном процессе.
Каждому учителю важно помнить, что на результаты ЕГЭ влияют:
- уровень предметной подготовки;
- уровень тестовой культуры выпускника;
- психологическая готовность демонстрировать сформированные знания и умения в непривычной обстановке.
Задачами учителя являются:
- адекватная оценка в течение учебного периода знаний, умений и навыков учащихся в соответствии с их индивидуальными особенностями и возможностями;
- не «натаскивание» старшеклассников на выполнение заданий различного уровня сложности, а организация системной продуманной работы в течение всех лет обучения предмету (должна быть преемственность между учителями-предметниками и периодом обучения);
- индивидуальное выполнение самими учителями экзаменационных работ ЕГЭ по предмету с последующей фиксацией возникающих при выполнении заданий трудностей;
- проведение анализа собственных затруднений при выполнении тестовых заданий и наметить пути их устранения.
- составление плана собственной работы по подготовке обучающихся к итоговой аттестации в форме ЕГЭ в процессе преподавания предмета;
- проведение обсуждения этих планов со всеми участниками образовательного процесса;
- проведение практикумов, целью которых является прогнозирование и предупреждение возможных ошибок учащихся, определение методических приемов по предупреждению этих ошибок (групповая работа учащихся);
- анализ результатов собственных, муниципальных, региональных, федеральных тестирований, пробного тестирования и т.д.
Учителю, преподающему в 9-м классе, приходится решать тройную задачу: обеспечивать полноценное изучение тем по программе; постоянно поддерживать на необходимом уровне уже сформированные знания и умения; готовить учащихся к сдаче экзамена в новой форме. Чтобы добиться успеха по всем трём направлениям, на мой взгляд, целесообразно проводить комплексную работу. Подготовка к ОГЭ – это всегда ответственный процесс. И от того, насколько грамотно будет построен этот процесс, зависит результат наших учеников.
У меня сложилась определенная система подготовки учащихся к итоговой аттестации. Программа подготовки к ОГЭ предусматривает различные виды деятельности: организационно-методическую работу, повышение профессиональной компетентности педагога, изучение документов федеральных, региональных, муниципальных органов образования, федерального института педагогических измерений, работу с учащимися и их родителями.
В век современных информационных технологий большую помощь в подготовке к ГИА оказывают Интернет-ресурсы. Сейчас на сайтах (http://www.fipi.ru/) можно найти всю справочную информацию, образцы бланков, инструкции по их заполнению, правила поведения на ОГЭ, права учащихся во время проведения ГИА, порядок проведения апелляции, советы учащимся и их родителям, демонстрационные варианты, кодификаторы, спецификации. Педагог сейчас должен научить учащихся умению анализировать полученную информацию, отсеивать лишнее.
Большое внимание нужно уделять умению детей работать с тестовыми заданиями: с выбором ответов и без выбора ответов, с развёрнутым ответом, на соответствие, на заполнение пропусков, на установление истинности или ложности. Поэтому в своей учебной практике часто вместо стандартных контрольных работ использую различные тесты. С учащимися мы пытаемся находить заведомо неправильные ответы (т.е. если ученик не уверен в правильности своего ответа, он должен проанализировать, какие из ответов не подходят точно). Это облегчает выбор верного ответа.
Одним из направлений организационно-методической работы является создание банка тестовых заданий, подбор учебно-методической литературы. Сейчас благодаря интернету (сайтам http://www.fipi.ru/, http://reshuege.ru/, http://egeigia.ru/ и т.д.) накопилась большая база заданий, которые входят в состав экзаменационных контрольно-измерительных материалов (КИМов). Теперь учащимся уже не нужно покупать большое количество тестового материала, а можно в режиме он-лайн решить диагностическую работу или полный вариант теста.
Это дает возможность учащимся:
Во-первых, выявить темы, по которым имеются наибольшие пробелы в знаниях. Сначала необходимо отработать по ним теоретический материал, а потом прорешать типовые задания, выработав практические навыки.
Во-вторых, учащийся сможет сориентироваться по времени. На выполнение заданий по химии в 9 классе отводится 120 минут, а в 11 классе 210 минут. Если объективно оценивать сложность заданий, разноуровневую подготовку детей, то многим из них просто не хватает времени на выполнение всех заданий. Поэтому сначала нужно начинать с самых простых вопросов. Помните: эти баллы упускать нельзя. Заработать 1 балл на сложных заданиях труднее, чем 4-5 баллов на простых, обидно будет ошибиться в простых заданиях. Также учащиеся не должны бояться приступать к сложным заданиям потому что за каждую верно написанную реакцию, они получают баллы. Это же касается и задачи.
При подготовке учащихся 9 классов к сдаче ОГЭ очень помогают консультативные занятия по группам. Они охватывают как сильных учащихся, с которыми разбираем задания повышенной сложности, так и слабоуспевающих учащихся, с которыми отрабатываем базовые знания умения и навыки. Разбираем демонстрационный вариант и задачи из открытого банка, а также тестовые задания. Знакомимся с системой оценивания, учимся работать с тестом. Провожу тренировочные работы в классе, затем ученики самостоятельно работают над вариантами тестов дома, после проверки происходит разбор заданий, вызвавших затруднения.
Основной метод подготовки – решение типовых и тренировочных заданий (их можно найти в разнообразных пособиях по ОГЭ или на сайтах http://www.fipi.ru/, http://reshuege.ru/) с выявлением имеющихся пробелов в знаниях. Работа с детьми по ликвидации пробелов знаний повышает успешность изучения химии.
Однако в условиях недостатка времени не всегда удается провести полноценную самостоятельную подготовку – перегруженному старшекласснику сложно каждый день выделять по нескольку часов на решение заданий. Но необходимо, чтобы подготовка была ежедневной, и в этом помогают дополнительные способы освоения теории, рассчитанные на занятия-пятиминутки. В своей работе активно использую ИКТ – технологии (цифровые образовательные ресурсы, а также Интернет – ресурсы), которые очень эффективно помогают в подготовке к экзамену и мне, как учителю и моим ученикам.
В течение года мы проводим тренировочные, репетиционные работы внутри школы. Стараемся создать реальные условия проведения ОГЭ. Опыт свидетельствует о том, что такая организация деятельности позволяет выпускникам регулировать темп своей работы над тестом, снижает уровень тревожности перед экзаменом, вселяет веру в свои силы, позволяет адаптироваться в условиях аттестации.
Подытожив выше сказанное, можно сделать следующие выводы, что положительная динамика при изучении химии и сдачи ОГЭ происходит за счет высокого профессионализма, хорошо сорганизованной работы учащихся, активного внедрения новейших технологий, таких как интерактивное обучение, информационно-коммуникативные технологии, а также некоторые приемы и методики из коллективно-учебных занятий, индивидуально-ориентированного обучения.
Эффективные методы и формы подготовки, обучающихся к успешной сдаче экзамена по химии:
Бесплатные On-line тесты ГИА 9 класс
Различные пособия для подготовки к ОГЭ и ЕГЭ
Интерактивные тесты на http://nsportal.ru/
Видеоуроки для подготовки к ГИА.
Крайне эффективной становится работа накануне экзамена. Она выстраивается следующим образом: в преддверии экзамена проводить ежедневные консультации в течение 5 дней по 1 часу. На них выпускники смогут получить последние наставления, советы, прояснить те вопросы, которые представляют наибольшую трудность.
Школьный курс является основой основ, однако подготовка к ГИА предполагает более углубленный и осмысленный подход. Систематическая самостоятельная работа по повторению и детальному изучению пройденного в школе или по какой-либо причине пропущенного материала во многом гарантирует успех. Следует отметить, что важен также метод освоения и способ подачи информации, так как неорганическая и органическая химия предполагают особый подход.
В качестве закрепления материала и самоконтроля при подготовке к ГИА рекомендуется выполнять практические задания по темам. Также стоит отметить, что структура экзаменационного задания ГИА по химии продумана наилучшим образом для более эффективного усвоения материала и возможности постепенного перехода от простого к сложному. Кроме того, заниматься регулярно по плану, основанному на многолетнем опыте, и иметь возможность детального изучения интересующего вопроса сегодня можно и онлайн, в удобное время и не выходя из дома. Все это значительно облегчает процесс обучения, особенно с учетом того, что вы можете не переживать за интерес ребенка к учебе. Рекомендуются элективные курсы по подготовке к ГИА
ЕГЭ по химии в современных условиях совмещает в себе две функции: итоговую аттестацию выпускников за курс средней общеобразовательной школы и представление им возможности продолжить образование по избранной специальности в высшей школе. Анализ результатов экзамена, проводимого в рамках эксперимента в разных регионах России, свидетельствует о том, что его успешная задача зависит от степени владения учащимся теоретическими знаниями за курс средней школы и умениями их использовать в нестандартных ситуациях.
Опыт проведения ЕГЭ свидетельствует о том, что выпускники недостаточно успешно справляются с такой формой проведения экзамена. Для повышения эффективности результатов необходимо осуществлять так же и дополнительную подготовку учащихся к экзамену. Поверхностное изучение химии не облегчает, а затрудняет ее усвоение. К тому же не все темы, усвоение которых необходимо для успешной сдачи экзамена достаточно и полно рассматриваются в рамках школьной программы. Особенно это касается заданий части с развернутым ответом. В связи с этим, элективный курс, предназначенный для учащихся 11 классов, подается на более глубоком уровне и направлен, прежде всего, на расширение, обобщение и пополнение знаний школьников по химии.
ЕГЭ по химии в современных условиях совмещает в себе две функции: итоговую аттестацию выпускников за курс средней общеобразовательной школы и представление им возможности продолжить образование по избранной специальности в высшей школе. Анализ результатов экзамена, проводимого в рамках эксперимента в разных регионах России, свидетельствует о том, что его успешная задача зависит от степени владения учащимся теоретическими знаниями за курс средней школы и умениями их использовать в нестандартных ситуациях.
Задачи:
1. Подготовить выпускников к единому государственному экзамену по химии;
2. Развить умения самостоятельно работать с литературой, систематически заниматься решением задач, работать с тестами различных типов.
3. Выявить основные затруднения и ошибки при выполнении заданий ЕГЭ по химии.
4. Подобрать задания, преимущественно части С, вызывающие наибольшие затруднения у учащихся при сдаче ЕГЭ по химии, включая задания, недостаточно изучаемых в рамках школьной программы.
5. Проводить информационную работу с учащимися и их родителями.
План самостоятельной подготовки к ЕГЭ.
Познакомиться со структурой экзаменационных работ прошлых лет.
Проанализировать материал, который в них входит, и наметить последовательность его изучения.
Выбрать учебные пособия, по которым необходимо заниматься.
Определить наиболее простые и наиболее сложные разделы курса.
Работать с курсом, обращая внимание на трудные разделы.
Работая с текстом, обязательно задумываться над тем, что в нем говорится.
Составить самостоятельные вопросы к отдельным фрагментам текста.
Сначала работать с заданиями, позволяющими последовательно изучить курс, затем переходить к тренировочному тексту ЕГЭ.
Проработать как можно больше вариантов текстов.
Кроме традиционных методов подготовки к экзамену и самоподготовки в настоящее время не обойтись без ресурсов Интернета и использования ИКТ. Задача учителя в данном случае – информировать и рекомендовать учащимся необходимые Интернет-ресурсы, консультировать и контролировать их при работе с этими сайтами. В каждом кабинете учителя – предметника в современной школе есть уголок подготовки к ГИА и ЕГЭ. На этот стенд я вывешиваю обзор Интернет – ресурсов и сервисов онлайн – тестирования ЕГЭ и ГИА и обращаю внимание учащихся на эту информацию. В ходе подготовки к ЕГЭ провожу консультации по использованию этих сайтов. Кроме этого, на официальном сайте ФИПИ в этом году был создан открытый банк заданий ЕГЭ, которым учащиеся могут пользоваться в своей подготовке.
Приложение 2
Система подготовки учащихся к новой форме государственной итоговой аттестации (ОГЭ) и ЕГЭ
Подготовка учащихся к ОГЭ и ЕГЭ - это длительная и кропотливая работа учителя. В нашей школе эта работа реализуется в рамках программы, которая предусматривает различные направления деятельности: организационно-методическая работа, повышение профессиональной компетентности учителя, изучение нормативных документов различного уровня, работа с учащимися и их родителями, аналитическая работа по результативности проведения итоговой аттестации.
Главной организационной формой обучения в средней школе является урок, потому что только на нем реализуется учебная программа. Для того чтобы подготовиться и успешно сдать ОГЭ (ЕГЭ), необходимо представлять уровень требований, возможную его структуру и особенности тестовых заданий.
Варианты заданий ОГЭ по химии предполагают знания у выпускников базового и повышенного уровня, требуемого для подготовки абитуриентов, предусмотренных современным образовательным стандартом и программами по химии, рекомендованными Министерством образования РФ.
Подготовку к ЕГЭ целесообразно начинать с первого года изучения предмета, с момента освоения алгоритма решения расчетных задач. В контрольно-измерительных материалах Единого государственного экзамена содержится 5-6 расчетных задач в каждом варианте, большая часть из них повышенного и высокого уровня сложности. Поэтому я постепенно знакомлю учащихся с различными видами усложненных задач, предлагая им дифференцированные домашние задачи.
При подготовке учащихся к экзамену в 9 классе стоит попытаться сделать их соучастниками работы, для чего можно порекомендовать план самостоятельной подготовки к ОГЭ.
После итогового повторения проводятся репетиционные работы в условиях, приближенных к экзаменационным. Важно, чтобы ученики сдали обязательную часть зачетной работы. Информация о выполнении работ доводится до сведения родителей. Для этого используется диагностическая карта.
Повторение пройденного материала надо начинать с первых дней занятий в выпускном классе, ибо успех старшеклассников на экзамене во многом определяется организацией повторения учебного материала. Повторение – обязательное и основное средство достижения глубоких, прочных и осознанных знаний учащихся. Особое значение для повторения и систематизации учебного материала имеют повторительно-обобщающие уроки, которые целесообразно проводить после изучения нескольких тем. Например, при изучении органической химии обобщающие уроки я провожу после изучения углеводородов, кислородсодержащих органических веществ и азотсодержащих органических веществ. Это позволяет сопоставить изученные понятия, рассмотреть логические связи, углубить знания на основе новых взаимосвязей.
В связи с введением ЕГЭ все большее значение приобретает такая форма контроля и учета знаний учащихся, как тестирование. Тесты как инструмент оценивания существенно отличаются от контрольных работ, поскольку кроме контролирующей функции они имеют и обучающее - тренировочную.
Тестирование может применяться не только в итоговой проверке, но и в текущей, промежуточной. Я использую тесты в своей работе на всех этапах обучения: мотивации, уяснения информации, закрепления и контроля.
В нашей школе проводятся консультации и курсы в течение всего учебного года. Используются сборники для подготовки к экзаменам, рекомендованные ФИПИ. В своей работе активно использую ИКТ технологии, тесты в режиме он-лайн. Неотъемлемым элементом подготовки к ОГЭ (ЕГЭ) является обучение заполнению бланков. Учащиеся даже к концу 11 класса допускают ошибки при их заполнении во время предэкзаменационных работ, кто от волнения, кто по невнимательности. Поэтому работа в этом направлении ведётся с учащимися 9 класса на консультациях.
Приложение 3
Окислительно – восстановительные реакции в органической химии. Генетическая связь между классами органических соединений.
Органическая химия располагает громадным числом реакций, большинство из которых имеет окислительно-восстановительную природу. Одной из сложных тем школьного курса химии является составление уравнений окислительно-восстановительных реакций органических веществ. В ряде заданий единого государственного экзамена по химии части C требуется не только привести схему реакции, а составить именно уравнение реакции окисления органического соединения с правильно подобранными коэффициентами. В органической химии термин «реакция окисления» подразумевает, что окисляется именно органическое соединение, при этом окислителем в большинстве случаев является неорганический реагент.
Окислительно-восстановительные реакции с участием органических веществ встречаются в заданиях ЕГЭ С3 (38), олимпиадных заданиях, и, как правило вызывают наибольшие затруднения у школьников. У большинства вызывает затруднение составление уравнения электронного баланса и расстановка коэффициентов в органических ОВР.
Типичные ошибки при выполнении задания 33:
незнание условий протекания химических реакций, генетической связи классов органических соединений;
незнание механизмов, сущности и условий реакций c участием органических веществ, свойств и формул органических соединений;
неумение предсказать свойства органического соединения на основе представлений о взаимном влиянии атомов в молекуле;
незнание окислительно-восстановительных реакций (например, с перманганатом калия).
1. Любая окислительно-восстановительная реакция начинается с определения степени окисления. Во многих случаях степень окисления атома элемента не совпадает с числом образуемых им связей, т.е. не равна валентности данного элемента. Известно, что в органических соединениях валентность углерода равна 4 (образует четыре связи), однако степень окисления углерода, как легко подсчитать, в метане СН4 равна -4, метаноле СНзОН -2, в формальдегиде СН2О 0, в муравьиной кислоте НСООН +2, в СО2 +4. Это достаточно просто. А как быть со степенью окисления в таком веществе как С6Н5-С≡СН (фенилацетилен)? Для определения степени окисления атомов в молекулах органических веществ существуют разные приёмы.
Я использую графический метод определения степени окисления в органических веществах.
В органических веществах можно определять степени окисления элементов алгебраическим методом, при этом получается усредненное значение степени окисления. Этот метод наиболее применим в том случае, если все атомы углерода органического вещества по окончании реакции приобрели одинаковую степень окисления (реакции горения или полного окисления). Но я использую его и для других органических соединений.
С5Н10О4
Найдём степень окисления углерода (х) в:
а) дезоксирибозе (С5Н10О4):
5х + 10 – 8 = 0;
х = - 2/5
б) фенилацетилене С6Н5-С≡СН (С8Н6)
8х + 6 = 0
Х = - 6/8
2. Наиболее часто в качестве окислителя используются KMnO4 и K2Cr2O7, поэтому я предлагаю схему восстановления KMnO4 и K2Cr2O7, в разных средах.
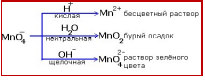
в кислой среде восстанавливается до Cr3+
К2Сr2O7 в нейтральной среде до Сr2O3
в щелочной среде до CrO42-
Все ОВР в органике можно условно разделить на 3 группы:
Полное окисление и горение. В качестве окислителей используются кислород (другие вещества, поддерживающие горение, например, оксиды азота), концентрированные азотная и серная кислота, можно использовать твердые соли, при нагревании которых выделяется кислород (хлораты, нитраты, перманганаты и т.п.), другие окислители (например, оксид меди (II)). В этих реакциях наблюдается разрушение всех химических связей в органическом веществе. Продуктами окисления органического вещества являются углекислый газ и вода.
2.Мягкое окисление. В этом случае не происходит разрыва углеродной цепи. К мягкому окислению относится окисление спиртов до альдегидов и кетонов, окисление альдегидов до карбоновых кислот, окисление алкенов до двухатомных спиртов (Реакция Вагнера), окисление ацетилена до оксалата калия, толуола – до бензойной кислоты и т.д. В качестве окислителей в этих случаях используются разбавленные растворы перманганата калия, дихромата калия, азотной кислоты, аммиачный раствор оксида серебра, оксид меди (II), гидроксид меди (II).
3. Деструктивное окисление. Происходит в более жестких условиях, чем мягкое окисление, сопровождается разрывом некоторых углерод-углеродных связей. В качестве окислителей используются более концентрированные растворы перманганата калия, дихромата калия при нагревании. Среда этих реакций может быть кислой, нейтральной и щелочной. От этого будут зависеть продукты реакций.
Деструкция (разрыв углеродной цепи) происходит у алкенов и алкинов – по кратной связи, у производных бензола – между первым и вторым атомами углерода, если считать от кольца, у третичных спиртов – у атома, содержащего гидроксильную группу, у кетонов – у атома при карбонильной группе.
Если при деструкции оторвался фрагмент, содержащий 1 атом углерода, то он окисляется до углекислого газа (в кислой среде), гидрокарбоната и (или) карбоната (в нейтральной среде), карбоната (в щелочной среде). Все более длинные фрагменты превращаются в кислоты (в кислой среде) и соли этих кислот (в нейтральной и щелочной среде). В некоторых случаях получаются не кислоты, а кетоны (при окислении третичных спиртов, разветвленных радикалов у гомологов бензола, у кетонов, алкенов).
Алкены. При мягком окислении алкены превращаются в гликоли (двухатомные спирты). Атомы-восстановители в этих реакциях – атомы углерода, связанные двойной связью.
Реакция с раствором перманганата калия протекает в нейтральной или слабо щелочной среде следующим образом при t от 0о до 20о:
СН2 = СН2 + 2 KMnO4 + 2Н2О![]() 3СН2(ОН) - СН2(ОН) +2КОН + 2МnО2
3СН2(ОН) - СН2(ОН) +2КОН + 2МnО2
| 2С-2 – 2е- → 2С-1 Мn+7 + 3е- → Мn+4 | 3 2 |
6 С2 + 2Мn+7 → 6С-1 + 2Мn+4
Окисление бутена-1 водным раствором перманганата калия при нагревании. При этой реакции происходит деструкция по двойной связи, образуется пропионат калия, оксид марганца (IV), КОН и КНСО3.
3CH3-CH2-CH=CH2 +10KMnO4 3С2Н5-СООК + 10MnO2 + KOH+ 3К2СО3 +4H2O
Окисление алкенов в жестких условиях (кипящий раствор, кислая среда) приводит к разрыву углерод-углеродной цепи по месту расположения двойной связи с образованием в качестве продуктов кислородсодержащих соединений. Продукты окисления зависят от строения исходного алкена.
1. Если алкен симметричный (двойная связь не находится у крайнего атома углерода), то образуется карбоновая кислота:
5СН3-СН=СН-СН3+8КМnО4+12Н2SО4 →10СН3-СООН+4К2SО4+ 8МnSО4 + 12Н2О
2. Если алкен несимметричный (двойная связь не находится у крайнего атома углерода), то образуется смесь карбоновых кислот:
5СН3-СН= СН-СН2-СН3+8КМnО4+12Н2SО4 → 5СН3СООН + 5СН3СН2СООН + + 4К2SО4 + 8МnSО4 + 12Н2О
3. Если двойная связь находится у крайнего атома углерода, то образуется муравьиная кислота, которая далее легко окисляется с образованием угольной кислоты, т.е. реакция заканчивается образованием углекислого газа:
СН2= СН-СН3 + 2КМnО4 + 3Н2SО4 → СО2 + СН3 СООН + К2SО4 + 2МnSО4 + 4Н2О
4. Если у атома углерода при двойной связи имеется радикал, то образуется кетон и карбоновая кислота:
5СН3-С(СН3)=СН-СН3+6КМnО4 +9Н2SО4→
→5СН3-СО-СН3+5СН3СООН+3К2SО4+6МnSО4+9Н2О
5.Если у атомов углерода при двойной связи имеются два радикала, то образуется смесь кетонов:
5СН3-С(СН3) =С(СН3)-СН2-СН3+4КМnО4 +6Н2SО4→
→5СН3-СО-СН3+5СН3СО-СН2-СН3+2К2SО4+4МnSО4+6Н2О
Окисление дихроматом калия в сернокислой среде идет по той же схеме (он аналогичен перманганату).
В щелочной среде деструкция приводит к образованию в зависимости от расположения двойной связи к образованию смеси солей карбоновых кислот, манганата марганца, карбонат калия и вода.
CH3-CH=CH-CH2-CH3 +6KMnO4+10KOH ![]() CH3COOK +C2H5COOK+6H2O + 6K2MnO4 (нагревание)
CH3COOK +C2H5COOK+6H2O + 6K2MnO4 (нагревание)
CH3-CH=CH2 +10KMnO4 +13KOH![]() CH3COOK+K2CO3+ 8H2O+ 10K2MnO4
CH3COOK+K2CO3+ 8H2O+ 10K2MnO4
(нагревание)
Алкины начинают окисляются в несколько более жестких условиях, чем алкены, поэтому они обычно окисляются с разрывом углеродной цепи по тройной связи. Как и в случае алкенов, атомы-восстановители здесь – атомы углерода, связанные в данном случае тройной связью.
Продукты реакции окисления гомологического ряда алкинов зависит от их строения, т.е. от положения тройной связи в углеродной цепи и от ее длины.
Окисление ацетилена подкисленным раствором перманганата калия приводит к образованию двухосновной щавелевой кислоты (этандиовой).
5CН ![]() CH + 8КМnО4 + Н2SО4 → 5НООС – СООН + 4К2SО4 + 8МnSО4 + 12Н2О
CH + 8КМnО4 + Н2SО4 → 5НООС – СООН + 4К2SО4 + 8МnSО4 + 12Н2О
Окисление ацетилена в нейтральной или щелочной среде приводит к образованию солей (оксалатов):
-нейтральная среда:
3CН ![]() CH + 8КМnО4 → 3КООС – СООК + 8МnО2 + 2КОН + 2Н2О
CH + 8КМnО4 → 3КООС – СООК + 8МnО2 + 2КОН + 2Н2О
- щелочная среда:
CН ![]() CH +8КМnО4 + 10КОН → КООС – СООК + 8К2МnО2 + 6Н2О
CH +8КМnО4 + 10КОН → КООС – СООК + 8К2МnО2 + 6Н2О
При окислении алкина, содержащего тройную связь у крайнего атома углерода, образуется углекислый газ и карбоновая кислота в кислой среде. В щелочной или нейтральной среде образуется углекислый газ и соль карбоновой кислоты. (нагревание)
- кислая среда:
5CH3- C ![]() CH+8КМnО4 +12Н2SО4→5СО2 + 5СН3СООН+4К2SО4+8МnSО4 + 12Н2О
CH+8КМnО4 +12Н2SО4→5СО2 + 5СН3СООН+4К2SО4+8МnSО4 + 12Н2О
- щелочная среда:
CH3 - C ![]() CH + 6КМnО4 + 8КОН → 6К2МnО4 + К2СО3 + СН3СООК + 3Н2О
CH + 6КМnО4 + 8КОН → 6К2МnО4 + К2СО3 + СН3СООК + 3Н2О
В нейтральной среде образуется углекислый газ, который при взаимодействии со щелочью может дать смесь солей в зависимости от количественных соотношений:
CH3 - C ![]() C-СН3 + 8КМnО4 + 4Н2О → 3КНСО3 + 3СН3СООК + 8МnО2 + 2КОН
C-СН3 + 8КМnО4 + 4Н2О → 3КНСО3 + 3СН3СООК + 8МnО2 + 2КОН
При окислении симметричного алкина (тройная связь не должна находиться у крайнего атома углерода), образуется карбоновая кислота, если среда кислая. Если среда щелочная или нейтральная, то образуется соль этой кислоты.
- кислая среда:
5CH3- C ![]() CH- СН3+ 6КМnО4 + 9Н2SО4 → 5СН3СООН + 3К2SО4 + 6МnSО4 + 14Н2О
CH- СН3+ 6КМnО4 + 9Н2SО4 → 5СН3СООН + 3К2SО4 + 6МnSО4 + 14Н2О
-нейтральная среда
CH3- C ![]() CH-СН2 –СН3 + 2КМnО4 → 2СН3 - СН2 - СООК + 2МnО2
CH-СН2 –СН3 + 2КМnО4 → 2СН3 - СН2 - СООК + 2МnО2
- щелочная среда
CH3- C ![]() CH- СН3 + 6КМnО4 + 8КОН → 2СН3-СООК + 6К2МnО4 + 4Н2О
CH- СН3 + 6КМnО4 + 8КОН → 2СН3-СООК + 6К2МnО4 + 4Н2О
Окисление несимметричных алкинов (тройная связь не находится у крайнего атома углерода) перманганатом калия в кислой среде приводит к образованию смеси двух разных карбоновых кислот, а в щелочной или нейтральной среде – смеси их солей.
- кислая среда:
CH3- C ![]() CH-СН2 –СН3 + 6КМnО4 + 9Н2SО4 →
CH-СН2 –СН3 + 6КМnО4 + 9Н2SО4 →
5СН3СООН + 5СН3СН2СООН + 3К2SО4 + 6МnSО4 + 4Н2О
- нейтральная среда:
CH3- C ![]() CH -СН2 –СН3 + 2КМnО4 → СН3СООК + СН3СН2СООК + 2МnО2
CH -СН2 –СН3 + 2КМnО4 → СН3СООК + СН3СН2СООК + 2МnО2
- щелочная среда:
CH3- C ![]() CH-СН2 –СН3 + 6КМnО4 + 8КОН → СН3СООК + СН3СН2СООК + 6К2МnО4 + 4Н2О
CH-СН2 –СН3 + 6КМnО4 + 8КОН → СН3СООК + СН3СН2СООК + 6К2МnО4 + 4Н2О
Какой бы алкин не вступал в реакцию окисления с перманганатом калия в одинаковой среде коэффициенты в уравнении всегда одни и те же.
Гомологи бензола могут быть окислены раствором перманганата калия в нейтральной среде до бензоата калия:
C6H5CH3 +2KMnO4 = C6H5COOK + 2MnO2 + KOH + H2O
C6H5CH2CH3 + 4KMnO4 = C6H5COOK + K2CO3 + 2H2O + 4MnO2 + KOH
Окисление этих веществ дихроматом или перманганатом калия в кислотной среде приводит к образованию бензойной кислоты.
5С6Н5СН3+6КMnO4-+9H2SO4→5С6Н5СООН+6MnSO4 +3K2SO4 + 14H2O
5C6H5–C2H5 + 12KMnO4 + 18H2SO4 = 5C6H5COOH + 5CO2 + 12MnSO4 + 6K2SO4 + 28H2O,
C6H5CH(CH3)2 + 18KMnO4 + 27H2SO4 → 5C6H5COOH + 42H2O + 18MnSO4+ + 10CO2 + K2SO4
При взаимодействии стирола с водным раствором перманганата калия без нагревания образуют гликоли (двухатомные спирты)
ЗС6Н5СН=СН2 + 2КМnО4 + 4Н2О ЗС6Н5СН(ОН)-СН2ОН + MnO2 + 2KOH
Спирты.
Непосредственным продуктом окисления первичных спиртов являются альдегиды, а вторичных – кетоны.
Образующиеся при окислении спиртов альдегиды легко окисляются до кислот, поэтому альдегиды из первичных спиртов получают окислением дихроматом калия в кислотной среде при температуре кипения альдегида. Испаряясь, альдегиды не успевают окислиться.
3C2H5OH + K2Cr2O7 + 4H2SO4 = 3CH3CHO + K2SO4 + Cr2(SO4)3 + 7H2O (нагревание)
+ K2SO4 + Cr2(SO4)3 + 7H2O (нагревание)
С избытком окислителя (KMnO4, K2Cr2O7) в любой среде первичные спирты окисляются до карбоновых кислот или их солей, а вторичные – до кетонов. Третичные спирты в этих условиях не окисляются, а метиловый спирт окисляется до углекислого газа. Все реакции идут при нагревании.
Двухатомный спирт, этиленгликоль HOCH2–CH2OH, при нагревании в кислотной среде с раствором KMnO4 или K2Cr2O7 легко окисляется до углекислого газа и воды, но иногда удается выделить и промежуточные продукты (HOCH2–COOH, HOOC–COOH и др.).
Двухатомный спирт, этиленгликоль HOCH2–CH2OH, при нагревании в кислотной среде с раствором KMnO4или K2Cr2O7 легко окисляется до щавелевой кислоты, а в нейтральной – до оксалата калия.
5СН2(ОН)–СН2(ОН)+8КMnO4-+12H2SO4→5HOOC–COOH +8MnSO4 +4К2SO4 +22Н2О
3СН2(ОН) – СН2(ОН) + 8КMnO4→3KOOC – COOK +8MnO2 +2КОН +8Н2О
Альдегиды.
Альдегиды – довольно сильные восстановители, и поэтому легко окисляются различными окислителями, например: KMnO4, K2Cr2O7, [Ag(NH3)2]OH. Все реакции идут при нагревании:
3CH3CHO + 2KMnO4 = CH3COOH + 2CH3COOK + 2MnO2 + H2O
3CH3CHO + K2Cr2O7 + 4H2SO4 = 3CH3COOH + Cr2(SO4)3 + 7H2O
CH3CHO + 2[Ag(NH3)2]OH = CH3COONH4 + 2Ag + H2O + 3NH3
Муравьиный альдегид окисляется хромовой смесью до углекислого газа: 3СН2О + 2K2Cr2O7 + 8H2SO4 = 3CO2![]() +2K2SO4 + 2Cr2(SO4)3 + 11H2O
+2K2SO4 + 2Cr2(SO4)3 + 11H2O
Здесь надо вспомнить материал неорганической химии, окислительные свойства брома. Альдегид окисляется до карбоновой кислоты, а поскольку реакция идет в присутствии NaOH, продуктом реакции будет соль:
CH3CHO + Br2 + 3NaOH CH3COONa + 2NaBr + 2H2O
2NaMnO4+CH3CHO+3NaOH CH3COONa+2Na2MnO4+2H2O
ЗСН3СНО + 2КМnО4 2СН3СООК + СН3СООН + 2МnО2 + Н2О
Карбоновые кислоты.
Среди кислот сильными восстановительными свойствами обладают муравьиная и щавелевая, которые окисляются до углекислого газа.
НСООН + HgCl2 =CO2![]() + Hg + 2HCl
+ Hg + 2HCl
HCOOH+ Cl2 = CO2![]() +2HCl
+2HCl
HOOC-COOH+ Cl2 =2CO2![]() +2HCl
+2HCl
Третья часть тестов (38) – это пять заданий со свободным развернутым ответом, приближающих ЕГЭ непосредственно к уровню вступительных экзаменов в вузы. Задания этой части требуют полного и обоснованного ответа. Для получения высокого балла нужно выполнить хотя бы одно задание из третьей части. Если полного и точного ответа ты не знаешь, напиши то, в чем уверен: уравнения реакций, начало решения задачи, предварительные расчеты, просто рассуждения. Старайся не оставлять такие задания совсем без ответа: в данном случае очень важно положить в копилку хотя бы немного баллов!..
Приложение 4
Учебный химический эксперимент (демонстрационные и лабораторные опыты, практические работы, виртуальные) при подготовке к ГИА (9 класс) и ЕГЭ (11 класс).
Химический эксперимент придает особую специфику предмету химии. Он является важнейшим способ ом осуществления связи теории с практикой путем превращения знаний в убеждения, а точнее, представлений в отношения и стратегию деятельности. Именно через эксперимент формируются у школьников универсальные учебные действия личностного, познавательного, регуляторного и коммуникативного характера.
Одной из основных задач, поставленных перед современной школой в проекте ФГОС второго поколения , является подготовка выпускника школы с активной жизненной позицией, т.е. формирование личности, способной к критическому анализу, к непредвзятой оценке фактов и мнений.
Химический эксперимент выполняет важнейшие функции: образование, воспитание (нравственное, духовное, трудовое, эстетическое, экономическое и др.) и развитие (в том числе памяти, мышления, эмоций, воли, мотивов и др.).
Химический эксперимент выполняет и некоторые частные функции – информативную, эвристическую, критериальную, корректирующую, исследовательскую, обобщающую и мировоззренческую.
1. Информативная функция проявляется в тех случаях, когда химический эксперимент служит первоначальным источником познания предметов и явлений. С помощью эксперимента обучающиеся узнают о свойствах и превращениях веществ. В этих случаях явления рассматриваются такими, какие они есть, в реальной обстановке. Будучи включенным в активную познавательную деятельность, обучаемый в состоянии проникнуть в суть химического явления, освоить его на эмпирическом уровне и использовать усвоенный материал в качестве способа дальнейшего познания.
2. Эвристическая функция обеспечивает не только установление фактов, но и служит активным средством формирования многих эмпирических понятий, выводов, зависимостей и закономерностей в химии.
Простейший пример, когда на основе опыта устанавливается факт: ученик, добавляя к раствору индикатора (фенолфталеина) несколько капель раствора гидроксида натрия, убеждается в том, что данный индикатор под действием щелочи изменяет свою окраску.
В учебной деятельности химический эксперимент не только позволяет устанавливать факты, но и служит активным средством формирования многих химических понятий и представлений. Например, первоначальное формирование представление о «катализаторе» базируется на простом химическом опыте разложения пероксида водорода в присутствии оксида марганца (IV):
Химический эксперимент также позволяет выводить зависимости и закономерности. Например, при изучении скорости химической реакции необходимо так организовать учебный процесс, чтобы учащиеся сами установили зависимость скорости реакции от концентрации реагирующих веществ. С этой целью им можно предложить провести взаимодействие раствора йодида калия с раствором пероксида водорода в присутствии крахмала.
В три пробирки, содержащие раствор йодида калия с крахмалом, наливают раствор пероксида водорода: в первую пробирку с исходной концентрацией (3%), во вторую – разбавленный в два раза и в третью – разбавленный в четыре раза. С помощью часов или метронома фиксируют, что во второй пробирке реакция протекает в два раза медленнее, чем в первой, а в третьей – в четыре раза.
На основании проделанного опыта учащиеся приходят к выводу, что скорость реакции прямо пропорциональна концентрации реагирующих веществ. Полученный из эксперимента вывод можно оформить графически в координатах «время – концентрация». Такой путь: от эксперимента к графику, а от него к уравнению – пример высшего проявления эвристического вывода. Он возможен при высоком уровне самостоятельности и творческой активности учащихся.
Все вышеприведенные примеры показывают, что эксперимент можно использовать для организации прямых эвристических выводов.
3. Критериальная функция проявляется в том случае, когда результаты опытов подтверждают предположения (гипотезы) обучаемых, т.е. служат той «практикой, что является критерием истины». Это необходимое средство практического доказательства правильности или ошибочности предположительных суждений, выводов, а также подтверждения ряда известных положений.
Часто эксперимент рассматривается как средство опровержения или подтверждения выдвинутой гипотезы. Например, при изучении бензола, обсуждая его молекулярную формулу, учащиеся относят бензол к непредельным углеводородам. Учитель предлагает проверить на опыте, взаимодействует ли бензол с бромной водой. Опыт не подтверждает выдвинутого предположения: бензол не вызывает характерного для непредельных углеводородов обесцвечивания бромной воды. Из неудачи в эксперименте ученики делают вывод, что при теоретических обсуждениях необходимо делать ориентировку на практику.
4. Корректирующая функция позволяет преодолевать трудности в освоении теоретических знаний: уточнять имеющиеся знания в процессе приобретения экспериментальных умений и навыков, исправлять ошибки обучаемых, осуществлять контроль за приобретенными знаниями.
Ученические опыты можно использовать для формирования правильных суждений учащихся и исправления ошибочных. Например, изучая свойства кислотных оксидов, учащиеся на уроке узнают из эксперимента, что оксид углерода (IV) и оксид серы (IV) взаимодействуют с водой. Такое взаимодействие учащиеся доказывают с помощью лакмуса. Но если ограничиться только этими опытами, то у учащихся может возникнуть ряд ошибочных представлений, связанных с неправильным переносом знаний. Так, например, большинство учащихся пишут уравнение реакции не существующего в природе процесса взаимодействия оксида кремния (IV) с водой. Для исправления этой ошибки необходимо, чтобы учащиеся провели опыт и сами убедились с помощью раствора лакмуса, что данные вещества не взаимодействуют между собой. Такие опыты помогут учащимся преодолеть типичные ошибки.
В практической деятельности учащихся также велика вероятность ошибок, связанных с нарушением правил техники безопасности. При получении хлороводорода и соляной кислоты учащиеся нередко опускают газоотводную трубку прибора в воду, забывая о том, что хлороводород хорошо растворяется в воде. Даже предупредительные слова учителя и инструкция учебника не оказывают должного воздействия. В подобной ситуации необходим специальный корректирующий эксперимент, демонстрирующий возможные последствия при неправильном проведении реакции. Учитель умышленно делает экспериментальную ошибку и тем самым показывает, как не следует ставить данный опыт. Видя результаты неправильного обращения с прибором, учащийся в своей практической работе уже не допустит подобной ошибки.
5. Исследовательская функция связана с развитием исследовательских компетентностей по анализу и синтезу веществ, поиску знаний о свойствах веществ и исследованию их простейших признаков, конструированию приборов и установок, т.е. освоению простейших методов научно-исследовательской работы. В соответствии с этой функцией учебный химический эксперимент как бы соединяет применение основных приемов научного метода с выполнением учащими ся учебно-исследовательских заданий.
Наиболее распространенными и доступными исследованиями являются практические работы по качественному анализу веществ. Экспериментальные исследовательские работы ценны в творческом отношении и дают возможность обучаемым самим создавать опытные установки для исследования веществ. В ходе таких работ не только изучаются вещества, но и осваиваются различные экспериментальные методы, применяемые в химии.
Однако в химии важны не только качественные, но и количественные показатели Ученический эксперимент, связанный с измерением количественных характеристик, практически не используется на уроках и чаще может использоваться во внеурочной проектно – исследовательской деятельности.
Первоначально, учащиеся начинают решать количественные экспериментальные задачи на образцах искусственных смесей (например, определение содержания карбонатов в выданном образце щелочи). Затем характер задач усложняется и приближается к жизненным условиям (например, определение кислотности пищевых продуктов: хлеба, молока, ягод, фруктов и т.д.). Особый интерес представляют количественные экспериментальные задачи по синтезу веществ (например, получение индикатора метилоранжа и других препаратов, необходимых для школьного химического эксперимента). Выполняя эти работы, учащиеся не только изучают вещества, но и осваивают экспериментальные методы, применяемые в химии (взвешивание, титрование, экстракция, хроматография, анализ, синтез и т.д.).
6. Обобщающая функция учебного химического эксперимента создает условия для выработки предпосылок при построении различных типов эмпирических обобщений. С помощью серии учебных экспериментов можно сделать обобщенный вывод.
Например, наблюдение опытов по электропроводности водных растворов кислот, щелочей и солей приводит учащихся к обобщению: несмотря на различную природу этих веществ, их растворы обладают одним свойством – все они могут проводить электрический ток. Полученные в опытах отдельные экспериментальные факты могут быть интерпретированы в общий вывод, на основании которого дается определение понятия «электролит».
В преподавании химии часто возникают такие ситуации, при которых обобщение, сделанное на основе эксперимента, дополняется и уточняется с помощью теории. При формировании обобщенного понятия «реакция замещения» для создания эмпирической базы необходимо провести как минимум три опыта: взаимодействие растворов хлорида меди (II) с цинком, сульфата меди (II) с железом, нитрата се ребра с медью. Если указанные металлы взять в виде порошков, то учащиеся, наблюдая опыты, могут сделать обобщенный вывод: в этих опытах было взято по два исходных вещества (простое и сложное) и получилось два новых (простое и сложное). Однако этот эмпирический вывод недостаточен для обобщенно го определения реакции замещения. Привлекая знания атомно-молекулярной теории, учитель объясняет механизм этой реакции и дает следующее определение: «Химические реакции между простым и сложным веществами, при которых атомы, составляющие простое вещество, замещают атомы одного из элементов сложного вещества, называются реакциями замещения».
В государственном образовательном стандарте по химии для полной средней общеобразовательной школы в требованиях к уровню подготовки выпускников перечислены основные экспериментальные компетентности. Большинство из них являются обобщенными: обращаться с простейшим лабораторным оборудованием, растворять твердые вещества, проводить отстаивание, фильтрование, обращаться с кислотами и щелочами, готовить растворы с определенной массовой долей растворенного вещества, собирать из готовых деталей приборы, определять с помощью характерных реакций неорганические и органические вещества, в том числе и полимерные материалы. При формировании экспериментальных компетентностей необходимо постоянно обращать внимание учащихся на то, как следует правильно проводить тот или иной эксперимент с точки зрения техники безопасности.
7. Мировоззренческая функция определяется дидактической ролью учебного химического эксперимента в научном химическом познании. Эксперимент является составной частью в цепи диалектического процесса познания учащимися объективной действительности. Правильно поставленный учебный химический эксперимент – важнейшее средство формирования научного мировоззрения учащихся в процессе усвоения основ химической науки.
Все перечисленные функции учебного химического эксперимента взаимосвязаны и взаимообуславливают друг друга. От возможности выполнения этих функций зависят успех и эффективность проводимого учебного химического эксперимента.
Выделяют следующие типы школьного химического эксперимента: демонстрационный опыт, лабораторный опыт, лабораторная работа, практическая работа, лабораторный практикум и домашний эксперимент.
По характеру воздействия на мышление учащихся, методики организации школьный химический эксперимент может осуществляться в исследовательской и иллюстративной форме.
Иллюстративный метод называют иногда методом готовых знаний: учитель сначала сообщает то, что должно получиться в результате опыта, а затем иллюстрирует сказанное демонстрацией, или изучаемый материал подтверждается проведением лабораторного опыта.
Исследовательским называют метод, в результате которого учащимся предлагается подобрать реактивы и оборудование для проведения опыта, спрогнозировать результат, выделить главное в наблюдениях и самостоятельно сделать вывод. Учитель проводит опыт как бы под руководством учащихся, выполняя предложенные экспериментальные действия, комментирует правила безопасности проведения эксперимента, задает уточняющие вопросы.
На первом этапе изучения химии, иллюстративный метод проведения демонстрационных опытов оказывается более эффективным, чем исследовательский. В этом случае учащиеся испытывают меньше затруднений при последующем описании наблюдений, формулировании выводов. Однако использование иллюстративного метода не должно ограничиваться только грамотным комментарием учителя. Более прочными у учащихся будут знания, полученные в результате эвристической беседы, построенной учителем в ходе демонстрации. По мере роста готовности школьников к самостоятельному наблюдению в процессе изучения химии возможно увеличение доли исследовательского метода при проведении демонстраций. Правильный выбор формы организации эксперимента является показателем педагогического мастерства учителя.
Школьный химический эксперимент можно разделить на демонстрационный, когда эксперимент показывает учитель, и ученический, выполняемый учащимися.Наиболее распространенным и сложным в преподавании является проведение демонстрационных опытов, в которых наблюдаются предметы и процессы.
Демонстрационным называют эксперимент, который проводит в классе учитель, лаборант или иногда один из учащихся. Этот эксперимент учитель использует в начале курса с целью научить учащихся наблюдать за процессами, приемами работы, манипуляциями. Это вызывает у учащихся интерес к предмету, начинает формировать у них практические умения, знакомит с химической посудой, приборами, веществами и т.д. Затем демонстрационный эксперимент применяют тогда, когда он слишком сложен для самостоятельного выполнения учащимися.
В школе используют демонстрационный эксперимент двух типов:
1.Демонстрации, когда объекты демонстраций ученик наблюдает непосредственно. В этом случае показывают вещества и проводят с ними различные химические операции, например, нагревание, сжигание, или демонстрируют опыты в сосудах большого размера - стаканах, колбах и др.
2. Опосредованные демонстрации используются в тех случаях, когда происходящие процессы мало заметны или слабо воспринимаются органами чувств. В этих случаях химические процессы воспроизводятся с помощью различных приспособлений.
Дидактический эффект демонстрационных опытов зависит от таких факторов, как техника проведения опыта и создание оптимальных условий наглядности того, что хочет показать и доказать учитель, т.е. достижения цели эксперимента.
Требования к демонстрационному эксперименту:
безопасность эксперимента;
соблюдение условия определенного расстояния от объектов наблюдения до наблюдателя, условий освещения, объемов веществ, размеров и формы посуды, приборов;
сочетание демонстрации опыта с комментарием учителя.
Последнее требование играет главную роль в демонстрации, когда учитель посредством комментария руководит наблюдением за ходом эксперимента. Проведение эксперимента учителем может быть осуществлено как чисто иллюстративным методом, так и частично-исследовательским [6].
Таким образом, в процессе демонстрирования осуществляется три функции учебного процесса: образовательная, воспитательная и развивающая. Демонстрационный опыт позволяет формировать у учащихся основные теоретические понятия химии, обеспечивает наглядное восприятие химических явлений и конкретных веществ, развивает логическое мышление, раскрывает практическое значение химии. С его помощью перед учащимися ставят познавательные проблемы, выдвигают гипотезы, проверяемые экспериментально. Он способствует закреплению и дальнейшему применению изучаемого материала.
Ученический эксперимент - это вид самостоятельной работы. Он не только обогащает учащихся новыми знаниями, понятиями, умениями, но и доказывает истинность приобретенных ими знаний, что обеспечивает более глубокое понимание и усвоение материала. Он позволяет более полно осуществлять принцип политехнизма - связь с жизнью, с практической деятельностью [4].
Ученический эксперимент подразделяют на два вида: 1) лабораторные опыты, проводимые учащимися в процессе приобретения новых знаний; 2) практические работы, которые учащиеся проделывают после прохождения одной - двух тем.
Лабораторные опыты имеют обучающий и развивающий характер и их роль в изучении химии наиболее важна.
Цель лабораторных опытов - приобретение новых знаний, изучение нового материала. В них первоначально отрабатываются способы действий, при этом учащиеся работают обычно парами.
Практические занятия, как правило, проводят в конце изучения темы с целью закрепления, конкретизации знаний, формирования практических умений и совершенствования уже имеющихся умений учащихся. На практических занятиях они проводят опыты самостоятельно, пользуясь инструкцией, чаще индивидуально.
Проведение практических работ позволяет учащимся применить полученные знания и умения в самостоятельной работе, сделать выводы и обобщения, а учителю - оценить уровень сформировавшихся знаний и умений учащихся. Практическая работа является своеобразным итогом, завершающим этапом при изучении тем и разделов.
К практическим работам учащиеся обязательно готовятся и самостоятельно продумывают эксперимент. Во многих случаях практические работы проводятся в виде экспериментального решения задач, в старших классах - в виде практикума, когда после прохождения ряда тем практические работы проводятся на нескольких уроках. Умело использованный химический эксперимент имеет большое значение не только для достижения поставленных образовательных и воспитательных задач в преподавании химии, но и для развития познавательных интересов учащихся. Если учитель свободно владеет химическим экспериментом и применяет его для приобретения учащимися знаний и умений, то учащиеся с интересом изучают химию. При отсутствии химического эксперимента на уроках химии знания учащихся по химии могут приобрести формальный оттенок - резко падает интерес к предмету.
Ученический эксперимент с точки зрения процесса учения должен проходить по следующим этапам: 1) осознание цели проведения опыта; 2) изучение предложенных веществ; 3) сборка или использование готового прибора; 4) выполнение опыта; 5) анализ результатов и выводы; 6) объяснение полученных результатов и использование химических уравнений; 7) составление отчета.
Каждый учащийся должен понимать, для чего он проделывает опыт и как надо решить поставленную перед ним задачу. Он изучает вещества органолептически или с помощью приборов и индикаторов, рассматривает детали прибора или весь прибор. Выполняя опыт, учащийся овладевает приемами и манипуляциями, наблюдает и замечает особенности хода процесса, отличает важные изменения от несущественных. Проделав опыт, он должен составить отчет.
На практических занятиях большое внимание обращается на выработку практических умений, так как их основы закладываются с самых первых этапов изучения химии, а в последующих классах они получают развитие и совершенствуются.
Практические занятия бывают двух видов: проводимые по инструкции и экспериментальные задачи.
Инструкция - это ориентировочная основа деятельности учащихся. В ней подробно изложен каждый этап выполнения опытов, даются указания, как избежать ошибочных действий, и содержится информация о мерах безопасности при выполнении работы. Инструкции к лабораторным опытам и практическим заданиям должны быть четкими, последовательными. Однако при выполнении работы одной письменной инструкции недостаточно, учителю необходимо грамотно и четко показывать лабораторные приемы и манипуляции в процессе предварительной подготовки учащихся к практической работе.
Экспериментальные задачи не содержат инструкций, а включают только условия. Разрабатывать план решения и осуществлять его учащиеся должны самостоятельно.
Подготовка к практическим занятиям носит обобщающий характер. При этом используется материал, изученный в разных разделах темы, и также формируются практические умения. На предыдущих уроках учитель использовал приборы, которыми учащиеся будут пользоваться на практическом занятии, рассматривались условия и особенности проведения опыта и т. д.
В начале практического занятия необходимо провести краткую беседу о правилах безопасности и об узловых моментах работы. На демонстрационном столе размещают в собранном виде все используемые в работе приборы.
Практическое занятие, посвященное решению экспериментальных задач, - разновидность контрольной работы, поэтому его проводят несколько иначе, чем практическое занятие по инструкции.
Подготовку учащихся к решению экспериментальных задач можно проводить поэтапно.
1. Сначала весь класс решает задачу теоретически. Для этого необходимо проанализировать условие задачи, сформулировать вопросы, на которые нужно дать ответы для получения окончательного результата, предложить опыты, необходимые для ответа на каждый вопрос.
2. Один из учащихся решает задачу теоретически у доски.
3. Учащийся у доски выполняет эксперимент. После этого класс приступает к решению аналогичных задач на рабочих местах.
Экспериментальные задачи целесообразно распределять по вариантам, чтобы добиться большей самостоятельности и активности учащихся в процессе работы.
При экспериментальном решении химических задач предусматривается самостоятельное применение умений учащихся проводить химические опыты для приобретения знаний или подтверждения предположений. Так обеспечивается развитие их познавательной деятельности в процессе выполнения химического эксперимента.
Химический эксперимент – важный источник знаний. В сочетании с технически ми средствами обучения он способствует более эффективному овладению изучаемым материалом, а так же алгоритмом исследований. Систематическое использование на уроках химии эксперимента помогает развивать УУД (познавательные, коммуникативные, регулятивные, личностные), алгоритм наблюдения за явлениями и процессами, формирует и совершенствует экспериментальные компетентности. Химический эксперимент способствует общему воспитанию и всестороннему развитию личности.












