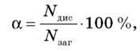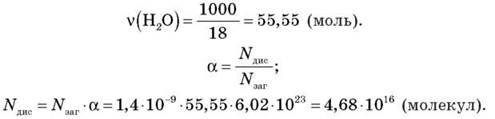РАСТВОРЫ
Урок 13
Тема урока. Степень диссоциации. Сильные и слабые электролиты
Цели урока: расширить знания учащихся о электролиты; ознакомить с понятиями «сильные и слабые электролиты»; показать количественную характеристику процесса электролитической диссоциации — степень диссоциации; закрепить навыки составления уравнений диссоциации кислот, оснований и солей; определить различия сильных и слабых электролитов.
Тип урока: комбинированный урок усвоения знаний, умений и навыков и творческому применению их на практике.
Формы работы: фронтальная опрос, групповая работа.
Оборудование: таблица растворимости, периодическая система химических элементов.
ХОД УРОКА
I. Организация класса
II. Проверка домашнего задания.
Мотивация учебной деятельности
А. Фронтальное опрос (химический диктант)
| Вариант И | Вариант II |
| 1. Электролиты это — ... |
| 2. Электролитическая диссоциация — это. |
| 3. Вид химической связи в молекулах электролитов: ... неэлектролита: ... |
| 4. Вещества, в результате диссоциации которых образуется только один вид катионов — H+, называются. |
| 5. Вещества, в результате диссоциации которых образуется только один вид анионов — OH , называется. |
| 6. Напишите уравнения диссоциации: |
| HCl | HBr |
| KOH | NaOH |
| CuSO4 | NaNO3 |
| Al2(SO4)3 | Fe2(SO4)3 |
Бы. Работа в парах
1. Вычислите число ионов в растворах, содержащих:
2 моль CuSO4
1,5 моль HCl
1 моль Al2(SO4)3
1 моль Na3PO4
4 моль NaOH
3 моль H2SO4
2. В растворе содержатся ионы: Na+, SO42-, NO3-, OH-, Cu2-, Ba2+.
• Напишите формулы электролитов, которые могли поместить в раствор для получения этих ионов.
• Назовите ионы, которые не могут одновременно находиться в растворе. Почему?
3. Выберите вещества, в растворах которых лампочка загорится:
• Натрий хлорид
• Этиловый спирт
• Хлоридная кислота
• Дистиллированная вода
• Бензин
• Натрий гидроксид
• Кальций карбонат
• Калий сульфат
III. Изучение нового материала
Количественно процесс диссоциации веществ в растворе можно оценить по степени диссоциации:
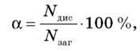
где Nд — число молекул, продисоціювали;
Nобщ — общее число молекул, помещенных в раствор; а зависит от природы растворенного вещества и растворителя.
Условно принято считать: если:
• α 30 % — сильный электролит (соли, щелочи, сильные кислоты);
• 2 % (H3PO4, НF);
• α H2О, NH4H, органические кислоты, H2CО3, H2SiО3, H2S и др.).
Диссоциация средних и слабых электролитов обратима и поэтапная. Степень диссоциации играет важную роль в процессах, протекающих в растворе. В растворах слабых электролитов одновременно содержатся и ионы, и молекулы растворенного вещества. Например, в растворе карбонатной кислоты:
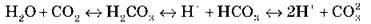
Одновременно в растворе могут содержаться три вида ионов, молекулы карбон(II) оксида и карбонатной кислоты.
Обобщаем, что разделение на сильные и слабые электролиты условный. Степень диссоциации α изменяется при условиях:
• повышение температуры;
• уменьшение концентрации растворенных веществ;
• замены растворителя.
Например, в 98%-м растворе H2SО4 (слабый электролит) при разбавлении степень диссоциации увеличивается.
IV. Творческое применение полученных знаний (управляемая практика)
Задача 1
Запишите уравнение поэтапной диссоциации веществ:
• H2CО3;
• Mg(ОH)2;
• H3PО4;
• Ca(OH)2.
Задание 2
Что означает выражение: степень диссоциации равна 0,25; 50 %; 15 %; 0,0017?
Задание 3
Вычислите степень диссоциации, если известно, что при температуре 25 °С в воде растворилось молекул вещества:
• 20 из 200;
• 10 из 80;
• 30 из 100;
• 50 из 150.
Задание 4
Чему равна степень диссоциации, если N = 0? если Nд = Nобщ?
Задание 5
При температуре 18 °С степень диссоциации воды равна 1,4 · 10-9. Вычислите, сколько молекул продисоціює в 1 л воды.
Решения
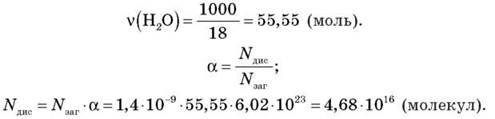
Задание 6
Вычислите количество ионов H+ в растворе сульфатной кислоты массой 180 г, если массовая доля кислоты — 50 %. Степень диссоциации принять за 100 %.
V. Подведение итогов урока
VI. Домашнее задание
Проработать материал параграфа, ответить на вопросы к нему, выполнить упражнения.