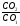Алгоритм № 1 определения состава атома.
| 1. Выберите элемент в ПСХЭ, запишите слева от знака химического элемента: внизу – порядковый номер, вверху – атомную массу. | Углерод C Z=6 A(C)=12 12 6C |
| 2. Определите состав атома ( см. № 3 в справках). | Число протонов N(р+) = 6 Число электронов N(ē) = 6 Число нейтронов N(n0) = 6 N(n0)=A-Z=12-6=6 |
| 3. Запишите состав атома: после знака химического элемента в скобках укажите состав ядра, за скобкой – число электронов | Состав атома: 12 6C(6р+, 6n0)6 ē |
Алгоритм № 2 объяснения физического смысла порядкового номера химического элемента, номеров периода и группы в ПСХЭ Д.И. Менделеева.
| 1. Выберите элемент, запишите его химический знак. | Азот N |
| 2. Объясните физический смысл: порядкового номера, Z. | Z=7 7N Заряд ядра +7 Число протонов 7 Число электронов 7 |
| номера периода | II период Два энергетических уровня * Два вида орбиталей (s-, p-) |
| Номера группы | VA группа Пять электронов, способных образовать химические связи. Пять электронов в наружном энергетическом уровне. |
Алгоритм № 3 определения строения атома по его положению в ПСХЭ.
| 1. Укажите химический элемент и его положение в ПСХЭ. | Азот N II период VA группа Атомный номер (главная подгруппа) Z=7 |
| 2. Определите число энергетических уровней и число электронов в атоме. (см. № 4 в справках). | | В атоме 7 электронов | 2 энергетичес- ких уровня, 2 вида орбиталей (s-, p-) | На наружном энергетичес- ком уровне 5ē |
|
| 3. Составьте схему строения атома. |
+7N 2ē, 5ē или N 
2 5
|
| *4. Составьте электронную конфигурацию (формулу атома). | +7N 1s2 2s2 2p3 |
| *5. Составьте схему распределения электронов по орбиталям. | E |  ↑↓ ↑↓
| ↑ | ↑ | ↑ | 2s 2 p 1s
|
Алгоритм № 4 определения зависимости свойств химических элементов от их положения в ПСХЭ и строения атома.
| 1. Запишите названия и химические знаки указанных элементов. | Углерод C | Кремний Si |
| 2. Определите по положению элементов в ПСХЭ их принадлежность к одному и тому же периоду или А группе (главной подгруппе). | Z=6 II период IV A группа | Z=14 III период IV A группа |
| Принадлежат к одной группе IV A (главной подгруппе), располагаясь в ней сверху вниз |
| 3. Определите сходство и различие в строении атомов | Сходство: IV A группа, 4ē в наружном энергетическом уровне. Различие: у углерода 2 энергетических уровня (II период), у кремния три энергетических уровня (III период; у кремния радиус атома больше, притяжение электронов наружного энергетического уровня меньше. |
| 4. Определите характер изменения свойств | В А группе сверху вниз неметаллические свойства элементов уменьшаются, следовательно, у кремния Si они выражены меньше, чем у углерода С. |
Алгоритм № 5 определения вида химической связи по формуле соединения:
| 1. Запишите формулу соединения | BeCl2 |
| 2. Укажите вид атомов, образующих химическую связь | Атомы разных элементов |
| 3. Сравните электроотрицательность элементов (вычислите разность ЭО), см. № 6 в справках | ЭО(Be)=1,5; ЭО(Cl)=3,0 Разность ЭО = 3,0-1,5=1,5 |
| 4. Определите вид связи | Разность ЭО |
Алгоритм № 6 составления электронных и структурных формул соединения и схем, объясняющих образование ковалентной связи
| 1. Запишите формулу химического соединения | Cl2 |
| 2. Укажите номер группы и определите число электронов на внешнем уровне (см. № 4 в справках) | VII A группа 7 валентных ē |
| 3. Определите число неспаренных электронов (по формуле 8-N, где N – номер группы) | 8-7=1 |
| 4. Обозначьте наружные электроны (спаренные и неспаренные) точками | . . :Сl о . . |
| 5. Составьте электронную схему образования связи и электронную формулу хлора | . . . . . . . . :Сl о + оСl: → :Cl: Cl: . . . . . . . . |
| 6. Составьте структурную формулу хлора и укажите кратность связи. Кратность связи определяется числом общих электронных пар. | Cl – Cl Одна общая электронная пара – одинарная связь |
| 7. Охарактеризуйте расположение электронной плотности связующей общей электронной пары между атомами | Простое вещество Cl2 состоит из атомов одного элемента, поэтому общая электронная пара принадлежит связанным атомам в одинаковой мере |
| 8. Укажите разновидность ковалентной связи | Неполярная |
Алгоритм № 7 составления схемы образования ионной сявзи:
| 1. Запишите формулу соединения | CaF2 |
| 2. Определите число внешних электронов у атома металла (равно номеру группы) и, следовательно, заряд иона, в который он превратится в результате отдачи этих электронов | Са – кальций II группа в ПСХЭ На внешнем слое 2 электрона Ca0 - 2ē→Ca2+ |
| 3. Определите число внешних электронов у атома неметалла и, следовательно, число недостающих до 8 электронов и соответственно заряд получившегося при приеме этих электронов иона | F фтор VII группа в ПСХЭ На внешнем слое 7 электронов, до 8 не хватает одного F0 + 1ē→F- |
| 4. Найти наименьшее общее кратное (НОК) между зарядами образовавшихся ионов и определить число атомов металла, которое нужно взять, чтобы они отдали это НОК число электронов и число атомов неметалла, чтобы они приняли это НОК число электронов. | НОК =2 (т. к. 2 и 1) Значит необходим один атом кальция и два атома фтора Ca0 и 2F0 |
| 5. Записать схему образования ионной связи между атомами металла и неметалла в последовательности атомы → ионы → ионное соединение. Коэффициенты и индексы «1» не пишутся. | 2ē 
Ca0 + 2F0 → Ca2+ + 2F- → Ca2+F-2
|
Алгоритм № 8 определения высшей и низшей степеней окисления (СО) элемента
| 1. Выберите химический элемент | Сера S |
| 2. Укажите номер группы в ПСХЭ, в которой находится элемент | VI A группа |
| 3. Определите высшую положительную СО элемента (см. № 8 в справках). | +6 (S+6) |
| 4. Вычислите низшую отрицательную СО элемента (см. № 8 в справках). | 6-8=-2 (S-2) |
Алгоритм № 9 составления названий бинарных соединений:
| 1. Напишите формулу соединения | CaO |
| 2. Назовите соединение | Оксид кальция |
| 3. Напишите формулу соединения, элемент которого имеет переменную степень окисления | +3 ![]() FeCl3-1 FeCl3-1
|
| 4. Назовите соединение | Хлорид железа (III) |
Алгоритм № 10 выведения формул бинарных соединений по степеням окисления элементов:
| 1. Выберите два элемента, один из которых должен иметь положительную степень окисления (СО), а другой – отрицательную | 1. Кальций и сера 2. Магний и фтор 3. Магний и фосфор |
| 2. Запишите химические знаки элементов так, чтобы на первом месте находился элемент с положительной степенью окисления (в ряду ЭО он стоит правее) | 1. Ca и S 2. Mg и F 3. Mg и P |
| 3. Укажите для каждого элемента значения степеней окисления (высшая положительная СО равна номеру группы; низшая отрицательная – номеру группы минус 8) | Ca, Mg – II группа (+2) S – VI группа (6-8=-2) F – VII группа (7-8=-1) P – V группа (5-8=-3) |
| 4. Определите индексы (см. справку ниже) | 1. Сa+2 S-2 CaS ![]()  2. Mg+2 F2-1 2:1=2 MgF2 2. Mg+2 F2-1 2:1=2 MgF2
![]()
  3. Mg3+2 P2-3 Mg3P2 3. Mg3+2 P2-3 Mg3P2
|
Справка
| Значения степеней окисления | Математическая запись | Расстановка индексов |
| Одинаковые | Индексы = 1, если СО1=СО2 | Индексы не записываются |
| Значение степени окисления одного элемента нацело делится на значение другого | Индекс = 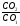 СО2CO1 | Индекс записывают рядом со знаком элемента с меньшей степенью окисления |
| Не делятся друг на друга нацело | Индекс 1= [CO2] Индекс2=[CO1] | Модули степеней окисления записывают индексами у знаков элементов крест-накрест |
Алгоритм № 11 определения степени окисления элемента в бинарных соединениях:
| 1. Запишите формулу соединения | Fe2O3 |
| 2. Определите сначала низшую отрицательную степень окисления элемента (см. № 8 в справках), знак которого в формуле записан вторым |
| O – VI группа 6-8= -2 |
| 3. Вычислите произведение индекса и известной СО | Fe2+3 | O3-2 (-2)·3=-6 |
| 4. Определите положительную СО элемента, исходя из электро-нейтральности соединения (сумма СО всех элементов равна 0) | +6:2=+3 |
Алгоритм № 12 выведения формул солей по их названию
| 1. Запишите ионы металла и кислотного остатка, входящие в состав заданной соли, пользуясь таблицей растворимости | 1. хлорид натрия Cl- Na+ 2. фосфат калия PO43- K+ 3. сульфат алюминия SO42- Al3+ |
| 2. Запишите ионы так, чтобы на первом месте находился ион с положительным зарядом, а на втором – с отрицательным. | 1. Na+Cl- 2. K+PO43- 3. Al3+SO42- |
| 3. Определите индексы (см. справку ниже) | 1. Na+Cl- 2. K3+PO43- 3:1=3 ![]() ![]() 
3. Al23+(SO4)32- |
Справка
| Значения разрядов ионов | Математическая запись | Расстановка индексов |
| Одинаковые | Заряд (Мn+)=заряд(Acdn-), где М – металл, Acd – кислотный остаток | Индексы не записываются |
| Значение заряда одного иона делится на значение заряда другого иона нацело | Индекс=заряд2 заряд1 , где заряд2заряда1 | Индекс записывают рядом со знаком иона, имеющего меньший заряд |
| Не делятся друг на друга | индекс1=заряду2 индекс2=заряду1 | Модули зарядов ионов записывают индексами у знаков ионов «крест-накрест» |
Алгоритм решения задач на вычисление массы (объема) продукта реакции, если одно из исходных веществ дано в избытке
Запись краткого условия задачи.
Запись уравнения реакции.
Надписание над формулами веществ в уравнении реакции данных условия задачи.
Определение мольных отношений, молярных масс (М), масс веществ (m) и подписание их под формулами веществ, с которыми необходимо вести расчеты.
Определение массы вещества, которое расходуется в реакции полностью, т.е. в недостатке.
Определение массы, количества или объема искомого вещества.
Запись ответа задачи.
Алгоритм решения задач на вычисления, связанные с использованием понятия “выход продукта реакции”
Запись краткого условия задачи.
Запись уравнения реакции.
Надписание над формулами веществ в уравнении реакции данных условия задачи.
Определение мольных отношений, молярных масс (объемов) и масс (объемов) веществ и запись их под формулами веществ, с которыми необходимо вести расчеты.
Определение теоретического выхода искомого вещества по уравнению реакции.
Вычисление массовой доли практического выхода продукта в процентах от теоретически возможного.
Запись ответа задачи.
Алгоритм решения задач на вычисление массы (объема) продукта реакции, если исходное вещество содержит примеси
Запись краткого условия задачи.
Определение массы чистого вещества, исходя из содержания массовой доли (%) примесей в исходном материале.
Запись уравнения реакции.
Надписание над формулами веществ в уравнении реакции данных условия задачи.
Определение молярных отношений, молярных масс (М), масс веществ (m), молярных объемов (Vm) и объемов (V) и подписание их под формулами веществ, с которыми необходимо вести расчеты.
Определение объема (или массы) искомого вещества.
Запись ответа задачи.
Алгоритм решения задач на нахождение молекулярной формулы вещества по относительной плотности и массовой доле элемента в соединении
Запись краткого условия задачи.
Нахождение относительной молекулярной массы искомого вещества.
Нахождение простейшей формулы искомого вещества.
Нахождение относительной молекулярной массы по простейшей формуле искомого вещества.
Сравнение относительных молекулярных масс, найденных по истинной и простейшей формуле искомого вещества.
Нахождение истинной формулы искомого вещества.
Запись ответа задачи.
Алгоритм решения задач на нахождение молекулярной формулы вещества по массе (объему) продуктов сгорания
Запись краткого условия задачи.
Нахождение относительной молекулярной массы искомого вещества.
Нахождение массы искомого вещества.
Нахождение масс элементов в исходном веществе.
Определение, входит ли еще какой-либо элемент в состав искомого вещества. Если входит, то определяют его массу.
Определение простейшей формулы искомого вещества.
Определение истинной формулы искомого вещества.
Запись ответа задачи.







 ↑↓
↑↓ 


 2. Mg+2 F2-1 2:1=2 MgF2
2. Mg+2 F2-1 2:1=2 MgF2
 3. Mg3+2 P2-3 Mg3P2
3. Mg3+2 P2-3 Mg3P2