Тема урока. Контрольная работа по теме «Неметаллы и их соединения»
Цели урока: обобщить и скорректировать знания учащихся по теме «Неметаллы и их соединения»; определить уровень учебных достижений учеников с темы, понимание учениками основных понятий, умение использовать их на практике.
Тип урока: контроля и коррекции знаний, умений и навыков.
Формы работы: письменная контрольная работа по вариантам.
Оборудование: периодическая таблица химических элементов, таблица растворимости, ряд активности металлов.
ХОД УРОКА
I. Организация класса
II. Письменная контрольная работа
Учитель распределяет варианты и напоминает ученикам содержание заданий, время выполнения и ключевые моменты оформления ответов и система оценивания:
• задачи 1, 2, 3, 4, 5, 6 — тестовые, каждое задание оценивается в 0,5 балла, в сумме первые шесть заданий дают 3 балла;
• задачи 7, 8, 9 оцениваются по 2 балла, итого за девять верно выполненных заданий — 9 баллов;
• задача 10 предлагается выполнять учащимся, претендующим на оценку 12 баллов, оценивается в 3 балла.
Следовательно, максимальная оценка за правильно выполненную работу составляет 12 баллов.
Время на выполнение работы — 40 минут.
Вариант И
1. Простое вещество хлор:
а) тяжелый газ зеленого цвета;
б) бурая летучая жидкость;
в) ядовитое вещество;
г) хорошо растворяется в воде.
2. Качественная реакция на карбонат-ион:
а) действие растворимых солей Аргентуму;
б) действие растворимых солей Бария;
в) действие сильных кислот;
г) действие индикатора.
3. Только окислительные свойства Сульфур проявляет в соединении:
а) SO3;
б) H2S;
в) SO2;
г) H2SO3.
4. Стекло для стекол получают в результате сплавления:
а) Na2CO3, CaCO3, SiO2;
б) Na2Cl, CaCO3, SiO2;
в) CaCl2, CaCO3, SiO2;
г) Na2CO3, NaCl, SiO2.
5. Формула азотной кислоты:
а) HNO2;
б) N2O3;
в) HNO3;
г) H3N.
6. Соли фосфорной кислоты применяются:
а) взрывчатые вещества;
б) для производства удобрений;
в) для изготовления резины.
7. Запишите уравнения реакции для осуществления превращений: 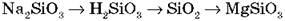
8. Напишите ионно-молекулярные уравнения реакции взаимодействия:
а) натрий сульфита и соляной кислоты;
б) аммоний нитрата и барий гидроксида.
9. Аргентум нитрат массой 8,5 г прореагировало с хлоридной кислотой. Выпал белый нерастворимый осадок массой 7 г. Вычислите массовую долю выхода продукта реакции от теоретически возможного.
10. Через раствор кальций гидроксида массой 50 г с массовой долей 74 % пропустили карбон(IV) оксид объемом 12,5 л (н. в.). Вычислите массу соли, образовавшейся.
Вариант II
1. Аллотропные модификации Углерода:
а) алмаз и графит;
б) белый и черный;
в) алмаз и кварц;
г) метан и уголь.
2. Качественная реакция на хлорид-ион:
а) действие растворимых солей Аргентуму;
б) действие растворимых солей Бария;
в) действие сильных кислот;
г) действие индикатора.
3. Только восстановительные свойства Азот проявляет в веществе:
а) NO2;
б) N2;
в) HNO3;
г) HSN.
4. Жидкое стекло имеет формулу:
а) Na2SiO3;
б) CaSiO3;
в) CaSiO3;
г) Na2C03.
5. Ортофосфатная кислота является:
а) одноосновною;
б) двохосновною;
в) трьохосновною.
6. Азотная кислота применяется:
а) в медицине;
б) в производстве взрывчатых веществ;
в) в радиотехнике.
7. Запишите уравнения реакции для осуществления превращений: СО2  KHCО3
KHCО3  K2CО3
K2CО3  KCl
KCl
8. Напишите ионно-молекулярные уравнения реакций взаимодействия:
а) аммоний сульфата и калий гидроксида;
б) натрий силиката и азотной кислоты.
9. Железо массой 5,6 г сгорело в атмосфере хлора. Образовался ферум(ІІІ) хлорид массой 15,25 г. Вычислите массовую долю выхода продукта реакции от теоретически возможного.
10. К раствору сульфатной кислоты массой 98 г с массовой долей кислоты 10 % добавили натрий гидроксид массой 10 г. Вычислите массу соли, образовавшейся.
Вариант III
1. Азот находится в природе:
а) в виде простых и сложных веществ;
б) только в свободном состоянии;
в) только в связанном состоянии;
г) в свободном состоянии только в космосе.
2. Качественная реакция на сульфат-ион:
а) действие растворимых солей Аргентуму;
б) действие растворимых солей Бария;
в) действие сильных кислот;
г) действие индикатора.
3. Только восстановительные свойства Карбон проявляет в степени окисления:
а) +2;
б) +4;
в) -4;
г) 0.
4. Силикатная промышленность производит:
а) цемент, бетон, песок;
б) цемент, стекло, железобетон;
в) цемент, стекло, керамику;
г) цемент, стекло, резину.
5. Концентрированная сульфатная кислота пассивирует:
а) Al, Fe, Cr;
б) Zn, Fe, Cr;
в) Fe, Al, Pb;
г) Al, Zn, Pb.
6. Аммиак применяется:
а) в медицине;
б) в строительстве;
в) в металлургии.
7. Запишите уравнения реакции для осуществления превращений: KNO3  O2
O2  P2O5
P2O5  H3PO4
H3PO4
8. Напишите ионно-молекулярные уравнения реакции взаимодействия:
а) калий карбоната и хлоридной кислоты;
б) алюминий сульфата и барий хлорида.
9. В результате нагревания магния массой 2,4 г с фосфором образовался магний фосфид массой 4 г. Вычислите массовую долю выхода продукта реакции от теоретически возможного.
10. Технический барий карбонат массой 24,6 г с массовой долей карбоната 20 % прореагировало с хлоридной кислотой массой 8,6 г. Вычислите объем газа, образовавшегося (н. в.).
III. Домашнее задание
Повторить материал параграфов о неметаллические элементы и их соединения.

















