
- Назовите местоположение металлов в ПСХЭ Д.И. Менделеева?
- Какие особенности в строении атомов имеют металлы?
- Какие физические и химические свойства характерны для металлов? С чем это связано?

Я известен с давних пор и имею спрос,
Опусти меня в раствор – медный купорос.
Изменить хочу я соль, ну-ка, выйди, соизволь!
Удивительный момент: стал другим раствор!
Вытесняю элемент, не вступая в спор.
На меня взгляни, ответь. Начинаю я ржаветь.
- Какой это металл?

- «Железо: строение атома, физические и химические свойства, получение, применение».

Изучить:
- 1. Положение железа в ПСЭХ Д.И.Менделеева
- 2. Строение атома железа
- 3. Нахождение в природе
- 4.Физические и химические свойства
- 5.Получение и применение железа

- Порядковый номер: № 26, A =56 , e=26 , p=26 , N=30
- Период: 4 период
- Группа: VIII В группа
- Распределение электронов: +26 Fe 2e 8e 14e 2e
- Электронная формула внешнего уровня …4 s 2 3d 6
- Тип кристаллической решетки: металлическая
- Вид химической связи: металлическая химическая связь

0
56
4 s 2
4 s 2
2e
8e
1 4 e
2e
3d 6
3d 6
3d 5
3p 6
3p 6
3s 2
3s 2
2p 6
2p 6
2s 2
2s 2
1 s 2
1 s 2
+2,+3
Степени окисления -
Краткая электронная формула

Станция 2. «Геологическая» Нахождение в природе
Метеоритное желез о
- Запишите не менее 4 -х формул соединений железа, встречающихся в природе
6

- В земной коре 5,1% железа, 4 место после кислорода, кремния и алюминия.
- По запасам железных руд Россия занимает 1 место в мире.
6

Таблица 1. Важнейшие руды и минералы, содержащие железо.
Название минералов
Химическая формула
Магнетит
( магнитный железняк)
Важнейшие месторождения
Fe 3 O 4
Гематит(красный железняк)
Fe 2 O 3
Южный Урал (Магнитогорск, Курская магнитная аномалия)
Лимонит(бурый железняк)
Криворожский район (Украина)
2Fe 2 O 3 . 3H 2 O
FeCO 3
Крым (Керченские месторождения)
Пирит(железный колчедан)
г. Братск
FeS 2
Сидерит(железный шпат)

Природные соединения железа
FeS
Пирит
FeCO 3
Сидерит
Fe
(железный или серный колчедан)
Fe 3 O 4
(магнитный железняк)
Fe 2 O 3 *3H 2 O Лимонит
Fe 2 O 3
(красный железняк)
(бурый железняк)

Серебристо-белый металл
Металлический блеск
Температура плавления +1539 о С , кипения 3070 С.
Пластичный, ковкий
Проводит электрический ток
Проводит тепло
Легко намагничивается и размагничивается
Плотность 7, 87 г/см 3 .
- Железо высокой чистоты содержит менее 0,01 % примесей. Оно почти инертно .

Исходным сырьем для получения железа служат природные руды (желязники), содержащие Fe 2О3, используют каменноугольный кокс в качестве восстановителя.
- 2Fe 2 O 3 + 3C = 4Fe + 3CO 2
- сложный трудоемкий двухступенчатый процесс. Сначала из руды получают чугун, а затем его переплавляют в сталь. Выплавка чугуна осуществлеется в доменных печах при высокой температуре до 1500С.
- Fe 2 O 3 + 3CO = 2Fe + 3CO 2
- Fe 2 O 3 + 3H 2 = 2Fe + 3H 2 O
- Fe 2 O 3 + 2Al = 2Fe + Al 2 O 3

Физминутка:
«Клоуны»
- Брови свести и развести;
- Глаза сильно прищурить и широко открыть;
- Губы максимально растянуть в улыбке, а затем поджать их;
- Шею максимально вытянуть, а затем опустить её;
- Плечи максимально свести и развести;
- Руками обнять себя, погладить и пожелать себе успехов, улыбнуться.
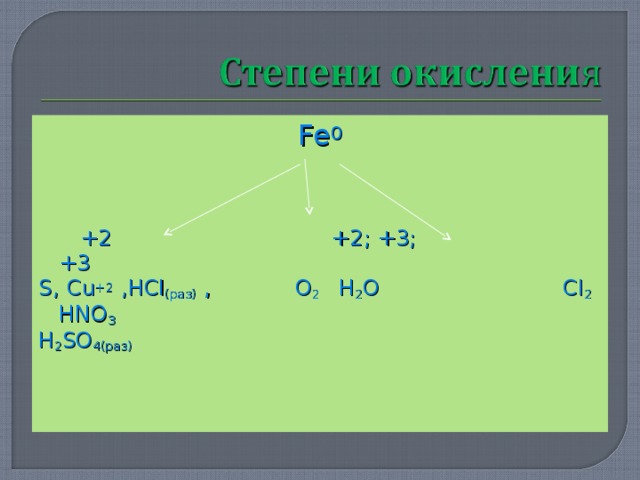
Fe 0
+2 +2 ; +3; +3
S , Cu +2 , HCl ( раз) , O 2 H 2 O Cl 2 HNO 3
H 2 SO 4 (раз)

Станция 5
Химические свойства железа
Взаимодействие железа с хлором:
2 Fe + 3 Cl 2 = 2 FeCl3

Химические свойства железа
Взаимодействие железа с кислородом:
Fe + O 2 =
Fe 3 O 4
(FeO*Fe 2 O 3 )
3
2

Fe + S= FeS (при нагревании)
2 Fe + 3 Cl 2 → 2 FeCl 3
6 Fe + 4 O 2 → 2 Fe 3 O 4 раскаленное железо ( 150 С) сгорает в кислороде с образованием железной окалины.
3 Fe + 4 H 2 O (пар) → Fe 3 O 4 + 4 H 2
4 Fe +6 H 2 O + 3 O 2 4 Fe ( OH ) 3 процесс коррозии
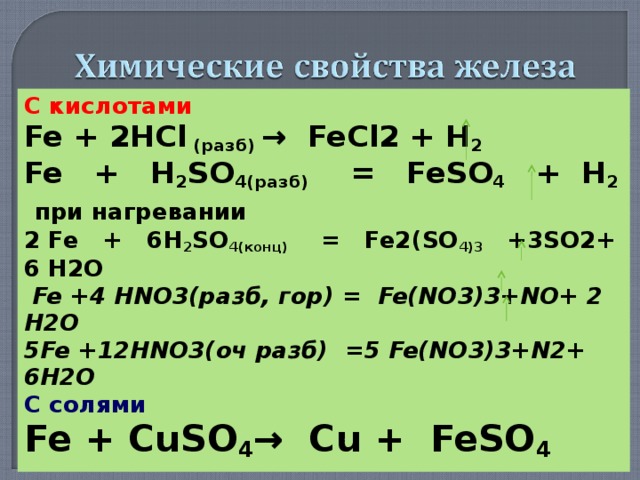
С кислотами
Fe + 2HCl ( разб) → FeCl2 + H 2
Fe + H 2 SO 4(разб) = FeSO 4 + H 2
при нагревании
2 Fe + 6 H 2 SO 4(конц) = Fe 2( SO 4)3 +3 SO2 + 6 Н2О
Fe +4 HNO3( разб , гор ) = Fe(NO 3 )3+NO+ 2 H2O
5Fe +12HNO3( оч разб ) =5 Fe(NO 3 )3+N2+ 6H2O
С солями
Fe + CuSO 4 → Cu + FeSO 4


Содержание железа в
100 г продукта
печень
персики
9 мг
хлеб
4 мг
грибы
свежие
грибы сушёные
2 мг
5 мг
яблоки
35 мг
3 мг

- Чистое железо способно быстро намагничиваться и размагничиваться, поэтому его применяют для изготовления трансформаторов, электромоторов и мембран микрофонов. Основная масса железа на практике используется в виде сплавов – чугуна и стали.
- Железо - самый употребляемый металл, на него приходится до 90 % мирового производства металлов.

Красный – мне было все понятно и интересно на уроке
Желтый – мне было не всё понятно, но интересно на уроке
Зеленый - мне было все непонятно и неинтересно на уроке

«Попс-формула»
- Сегодня я понял(а), что ………..
- Главным на уроке для меня было ……….
- Больше всего мне запомнилось ……….

- § 41, с. 188 -191 № 1 с. 190 - всем
- № 5 с. 191 (задача), по желанию











































