
Растворы

Растворы – это гомогенные (однородные) системы, состоящие из двух и более компонентов и продуктов их взаимодействия.
Точное определение раствора ( 1887 год Д.И.Менделеев)
Раствор – гомогенная (однородная) система, состоящая из
частиц растворенного
вещества, растворителя
и продуктов
их взаимодействия.
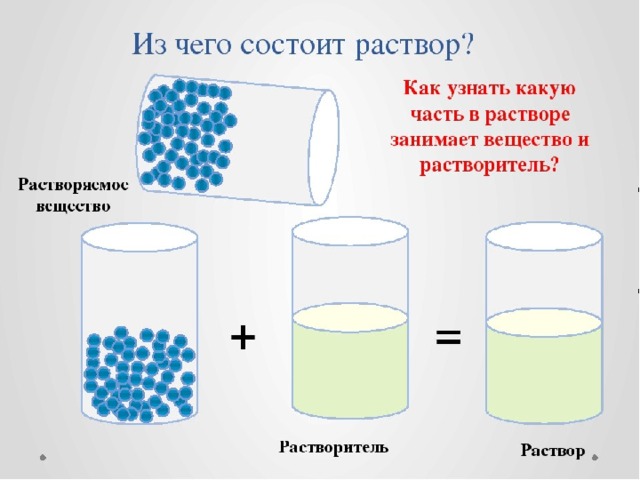






Растворы подразделяются:
- Молекулярные – водные растворы неэлектролитов
( спиртовой раствор йода, раствор глюкозы).
- Молекулярно-ионные – растворы слабых электролитов
( азотистая и угольная кислоты, аммиачная вода).
3. Ионные растворы – растворы электролитов.

 1г Практически Нерастворимые S" width="640"
1г Практически Нерастворимые S" width="640"
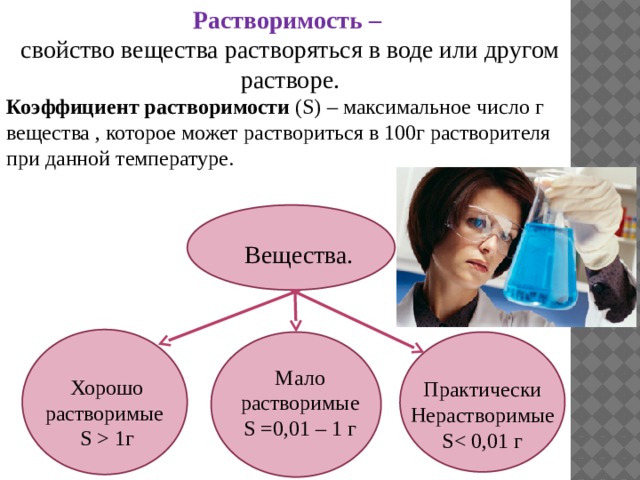
Растворимость –
свойство вещества растворяться в воде или другом растворе.
Коэффициент растворимости (S) – максимальное число г вещества , которое может раствориться в 100г растворителя при данной температуре.
Вещества.
Мало растворимые
S =0,01 – 1 г
Хорошо растворимые
S 1г
Практически Нерастворимые
S

Растворимость газов- определяется объемом газа, растворившегося при постоянной температуре в 1 объеме растворителя с образованием насыщенного раствора.
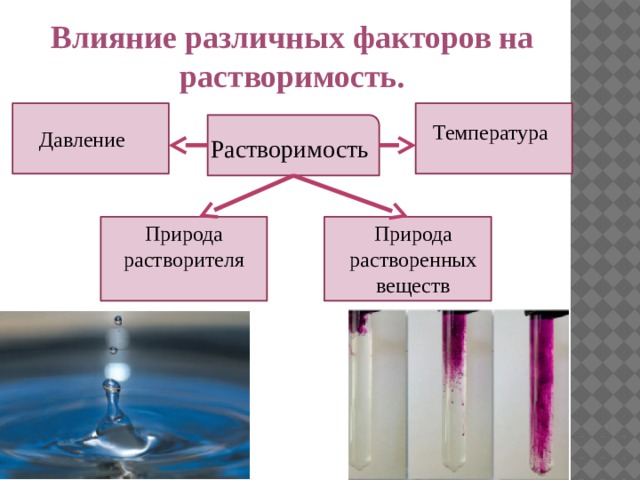
Влияние различных факторов на растворимость.
Температура
Давление
Растворимость
Природа растворенных веществ
Природа растворителя



Растворимость жидкостей в жидкостях очень сложным образом зависит от их природы.
Можно выделить три типа жидкостей , различающихся способностью к взаимному растворению.
- Практически несмешиваемые жидкости, т. е. не способные к образованию взаимных растворов (например, Н 2 0 и Hg, Н 2 0 и С 6 Н 6 ).
2) Жидкости, смешиваемые в любых соотношениях, т. е. с неограниченной взаимной растворимостью (например, Н 2 0 и С 2 Н 5 ОН, Н 2 0 и СН 3 СООН).
3) Жидкости с ограниченной взаимной растворимостью (Н 2 0 и С 2 Н 5 ОС 2 Н 5 , Н 2 0 и C 6 H 5 NH 2 ).



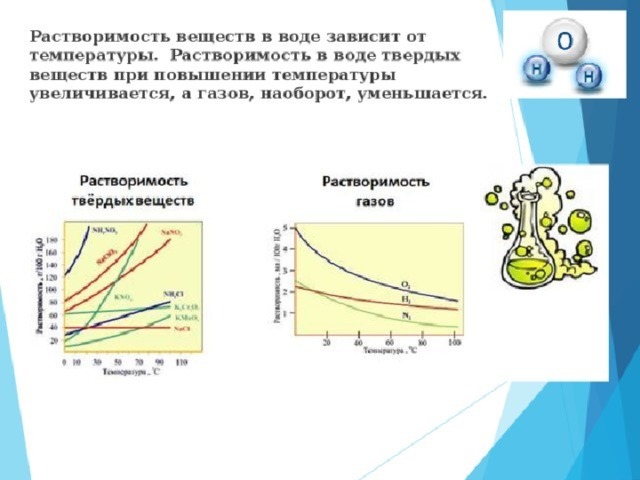

Существенное влияние давление оказывает лишь на растворимость газов.
Причем если между газом и растворителем не возникает химического взаимодействия, то согласно
закона Генри растворимость газа при постоянной температуре прямо пропорциональна его давлению над раствором
S=kР


Способы выражения состава растворов 1. доли 2. Концентрации
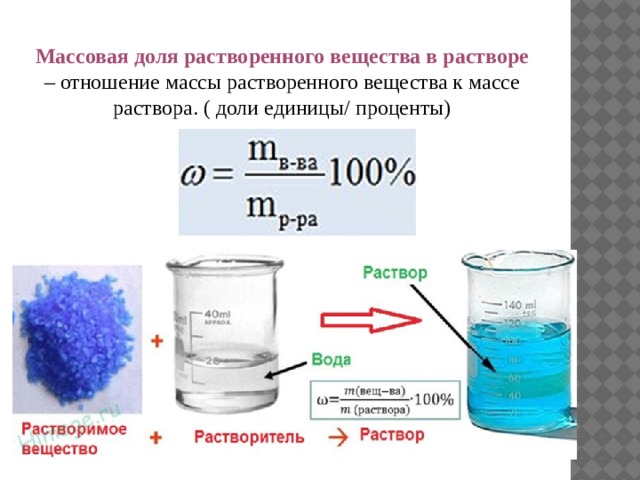
Массовая доля растворенного вещества в растворе – отношение массы растворенного вещества к массе раствора. ( доли единицы/ проценты)


Концентрация раствора –
это содержание вещества в определенной массе или объеме раствора .

Молярность - число молей растворенного вещества в 1 л раствора.
ʋ - количество вещества (моль);
V – объем раствора (л);


Эквивалентная концентрация (нормальность) – число эквивалентов растворенного вещества в 1л раствора.
ʋ экв. - количество эквивалентов;
V – объём раствора, л.

Выражение концентраций растворов.
Моляльная концентрация (моляльность) – число молей растворенного вещества на 1000 г растворителя.


















 1г Практически Нерастворимые S" width="640"
1г Практически Нерастворимые S" width="640"







































