Областное государственное бюджетное профессиональное образовательное учреждение «Кожевниковский техникум агробизнеса»
| Согласовано Председатель ПЦК ________ Г.В. Монастырева «_____»____________2019 г
| Утверждаю Заместитель директора по УМР ______________Л.Э. Кильб «______»______________2019 г |
Учебное пособие
для обучающихся
Дидактический материал по неорганической химии
с. Кожевниково, 2019
Учебное пособие «Дидактический материал по неорганической химии» для обучающихся по общеобразовательной учебной дисциплине Химия разработан в соответствии с ФГОС среднего общего образования и учебной программой по дисциплине и предназначен для обучающихся по профессиям 15.05.01 Сварщик (ручной и частично механизированной сварки (наплавки), 13.01.10 Электромонтёр по ремонту и обслуживанию электрооборудования (по отраслям), 35.01.11 Мастер сельскохозяйственного производства и для обучающихся по специальности 35.02.07 Механизация сельского хозяйства.
Разработчик: Монастырева Галина Васильевна, преподаватель.
Рассмотрено и согласовано на заседании ПЦК
Протокол № ______ от «_____»___________2019 г
Председатель ПЦК _______________ Г.В. Монастырева.
Содержание
-
Пояснительная записка……………………………………………………………..4
-
Тема 1.1 Основные понятия и законы химии……………………………………..5
-
Тема 1.2 Периодический закон и периодическая система химических элементов Д.И. Менделеева и строение атома ………………………………………………..6
-
Тема 1.3 Строение вещества………………………………………………………...8
-
Тема 1.4 Вода. Растворы. Электролитическая диссоциация……………………13
-
Тема 1.5 Классы неорганических соединений……………………………………14
-
Тема 1.6 Химические реакции……………………………………………………..15
-
Тема 1.7 Металлы и неметаллы……………………………………………………17
-
Список источников литературы……………………………………………………18
Пояснительная записка
Данное учебное пособие является частью учебного комплекса по неорганической химии. Оно содержит задания как по общим темам программы по химии, которые изучаются всеми обучающимися. По указанным в учебном пособии темам представлены различные виды заданий. Есть и разделы, где обучающиеся должны выполнить задания и решить расчетные задачи . Также в пособии указаны критерии оценивания решенных задач.
Пособие было разработано в 2019 году и используется в учебном процессе. За это время в содержании и методах обучения химии произошли изменения: сократилось время аудиторных занятий, повысилась значимость самостоятельной работы обучающихся, разрабатываются и вводятся в учебный процесс информационные технологии обучения, тестовые методики контроля знаний.
Пособие предназначено для работы на занятиях, на консультациях и подготовки к зачёту и индивидуальной самостоятельной работы обучающихся.
При работе над данным пособием просмотрено много учебной литературы.
Раздел 1 Общая и неорганическая химия
Тема 1.1. Основные понятия и законы химии
Теоретические вопросы:
1.Какой из двух процессов - кипение воды, ржавление железа - является физическим процессом, а какой - химической реакцией? Ответ мотивировать.
2.Какой из процессов - горение дерева, фильтрование воды - является физическим процессом, а какой - химической реакцией? Ответ мотивировать.
3.Какой из двух процессов - проявление фотопленки, свечение электролампы - является физическим процессом, а какой - химической реакцией? Ответ мотивировать.
4.Какое из двух веществ - дистиллированная вода, воздух - является химическим соединением, а какое - смесью? Ответ мотивировать.
5.Какое из двух веществ - стекло, нефть - является химическим соединением, а какое - смесью? Ответ мотивировать.
6.Какое из двух веществ - гидроксид натрия, железная руда - является химическим соединением, а какое - смесью? Для соединения укажите формулу, а для смеси - состав.
7.Какое из двух веществ - серная кислота, мел - встречается в природе, а какое получают химическим путем? Для вещества, получаемого химическим путём, напишите уравнения реакций получения.
8.Какое из двух веществ - кварц, аммиачная селитра - встречается в природе, а какое получают химическим путем? Для получаемого вещества напишите уравнения реакций получения.
9.Какое из двух веществ - азотная кислота, поваренная соль - встречается в природе, а какое получают химическим путем? Для получаемого вещества напишите уравнения реакций получения.
10.Приведите примеры химических веществ, используемых в промышленности, сельском хозяйстве и в быту.
11.Напишите определения понятий «атом» и «химический элемент». Напишите русские и латинские названия химических элементов, обозначаемых символами: Ar, Au, Ag, Mg, Mn, Mo, Ru, Re.
12.Напишите и объясните обозначения (символы) данных химических элементов и укажите, какие из них являются металлами, неметаллами и амфотерными элементами: барий, хлор, германий, олово, рубидий, селен.
13.Напишите определения понятий «простое вещество» и «сложное вещество». Напишите формулы данных веществ и укажите, какие из них являются простыми, а какие - сложными: вода, хлор, фосфор, метан, аммиак, серная кислота.
14.Какие вещества называются простыми, а какие - сложными? Среди данных веществ укажите простые и сложные, напишите формулы всех веществ: железо, азотная кислота, бензол, углерод, гидразин, силан.
15.Объясните физический смысл постоянной Авогадро. Какой вклад в развитие химии внес ученый, именем которого названо это число?
16.Число Авогадро определено с очень большой точностью. Чему равно точное значение этого числа? Как определено число Авогадро? Каков физический смысл этого числа?
Решение задач:
1. Определить массу молекулярного кислорода количеством вещества 4 моль.
2. Рассчитайте количество вещества натрия массой 69 грамм.
3. Сколько молекул содержится в 54 граммах алюминия.
4. Определить массу и объём при (н.у. ) молекулярного азота количеством вещества 2 моль.
5.Какое количество вещества составляют: а) 1 г водорода; б) 4 кг гидроксида натрия; в) 135 г алюминия?
6.Чему равны массы следующих количеств веществ: а) 1000 моль водорода; б) 10 моль хлорида натрия; в) 200 моль аммиака? Ответ приведите в килограммах.
7. Рассчитайте массовые доли элементов, входящих с состав нитрата аммония и нитрата калия. Сравните содержание азота в веществах.
8. Плотность по водороду газовой смеси из азота и кислорода равна 15. Определите объемные доли (в %) азота и кислорода в смеси.
Критерии оценки умений решать расчетные задачи
Отметка «5»:- в логическом рассуждении и решении нет ошибок, задача решена рациональным способом;
Отметка «4»:- допущено не более двух несущественных ошибок или решено правильно две задачи из трех.
Отметка «3»:- в логическом рассуждении нет существенных ошибок, но допущена существенная ошибка в математических расчетах, правильно решена только одна задача из трех.
Отметка «2»: -не решена ни одна задача из задач.
Тема 1.2. Периодический закон и ПСХЭ Д.И. Менделеева и строение атома.
1.Напишите определение понятия « валентность химического элемента». Приведите примеры элементов постоянной и переменной валентности и соответствующих соединений.
2.Какое свойство химического элемента называется его валентностью? Приведите примеры элементов постоянной валентности, равной единице, двум и трем, и формулы соответствующих соединений. Приведите примеры элементов переменной валентности и формулы соответствующих соединений.
3.Как определяется максимальная валентность элемента? Укажите максимальную валентность фосфора, хлора, серы и ксенона и приведите примеры соответствующих соединений.
4.У многих элементов переменной валентности значения валентности отличаются на число 2. Приведите примеры таких элементов и соответствующих соединений.
5.Определите валентность серы в соединениях: H2S, SO2, H2SO3, SO3, H2SO4, CS2.
6.Определите валентность азота в соединениях: NH3, N2O, NO, N2O3, HNO2, NO2, N2O5, HNO3, NH4NO3, NH4NO2.
7.Как изменяется максимальная валентность химических элементов в периодах? Приведите примеры соединений кремния, фосфора, серы в которых эти элементы имеют максимальную валентность.
8.Как связана максимальная валентность химического элемента с его положением в периодической системе? Приведите примеры соединений германия, фосфора, селена и хлора, в которых эти элементы имеют максимальную валентность.
9.Как изменяется максимальная валентность химических элементов с увеличением их атомного номера? Приведите примеры соединений олова, сурьмы, теллура, брома в которых они проявляют максимальную валентность.
10.Чему равна максимальная валентность химических элементов, расположенных в одной группе Периодической системы? Покажите на примере соединений, образуемых элементами третьего периода.
11.Руководствуясь положением элементов в Периодической системе, напишите формулы соединений алюминия с водородом, кислородом, азотом, углеродом, серой и фтором.
12.Напишите формулы оксидов азота (I, II, III, IV, V), марганца (II, III, IV, VI, VII) и хрома (II, III, VI).
13.Напишите структурные формулы Al2O3, HNO3, CaSO4, SO2Cl2, NaHCO3. Отражает ли структурная формула пространственное строение молекулы или кристаллической решетки вещества? Какую полезную информацию дает структурная формула?
14.Какую информацию дают структурные формулы веществ? Напишите структурные формулы H2SO4, NaHSO3, Cr(OH)2NO3.
Решение задач:
-
Масса 0,25 моль хлорида меди (II) СиС12 равна:
1)64 г; 2) 24,75 г; 3)24,875 г; 4) 33,75 г.
-
Какой объем займут 12 * 1023 молекул водорода: 1) 44,8л 2) 22,4л 3)11,2л 4)112л
-
Какую массу будут иметь 12 * 1023 молекул водорода: 1) 1 г 2) 2г 3) 4г 4) 6г
-
Масса соли, которую необходимо растворить в 20г воды для приготовления 25% раствора равна: 1)7г 2)5,6 3) 6,7г 4)8,2г
-
К 50 г 5% раствора сахара добавили 10 г воды. Какова массовая доля сахара в новом растворе? 1)20% 2)4% 3)2% 4)6%
-
Масса воды, которую необходимо взять для приготовления 120 г 15% раствора соли 1)102г 2) 18г 3)3Ог 4)205г
Критерии оценки умений решать расчетные задачи
Отметка «5»:- в логическом рассуждении и решении нет ошибок, задача решена рациональным способом;
Отметка «4»:- допущено не более двух несущественных ошибок или решено правильно две задачи из трех.
Отметка «3»:- в логическом рассуждении нет существенных ошибок, но допущена существенная ошибка в математических расчетах, правильно решена только одна задача из трех.
Отметка «2»: -не решена ни одна задача из задач.
Тема 1.3 Строение вещества
Тестовые задания
Вариант 1
1. В ковалентных соединениях состава Н3Э число общих электронных пар равно:
1) 1 2) 2 3) 3 4) 4
2. Ионные и ковалентные полярные связи присутствуют в молекуле:
1) оксида кремния (IV) 2) хлорида натрия
3) гидрокарбоната аммония 4) хлороводорода
3. Наибольшее число ковалентных неполярных связей в молекуле:
1) N2 2) O2 3) P4 4) S8
4. Химическая связь в молекулах брома и бромоводорода отличается:
1) числом общих электронных пар
2) числом электронов, принимающих участие в образовании связи
3) числом валентных электронов у атомов водорода и брома
4)смещением электронной пары к атому с большей электроотрицательностью
5. В молекуле азота число общих электронных пар равно:
1) 1 2) 2 3) 3 4) 4
6. Хлор образует ковалентную полярную связь с элементом, химический знак которого:
1) Mg 2) C 3) Nа 4) Li
7. Какие из утверждений являются верными?
А) Все гибридные орбитали имеют одинаковую форму
Б) Чем больше энергия химической связи, тем меньше ее прочность
1) верно только А 2) верно только Б
3) оба утверждения верны 4) оба утверждения неверны
8. Ковалентная связь между атомами образована по донорно-акцепторному механизму в соединении:
1) NH3 2) NH4Cl 3) СCl4 4) НCl
9. Из щелочных металлов наибольшую тенденцию к образованию ковалентных связей проявляет:
1) Li 2) Na 3) K 4) Rb
10. Водородные связи есть в веществе:
1) брома 2) иода 3) льда 4) сахарозы
11. Водородная связь не образуется между молекулами:
1) воды 2) фтора 3) аммиака 4) фтороводорода
12. Металлическую связь образует элемент с электронной конфигурацией атома:
1) 1s22s22p63s23p3 2) 1s22s22p4
3) 1s22s22p63s23p1 4) 1s22s22p3
13. Вещество с наибольшей температурой плавления:
1) сахароза 2) лед
3) иод 4) хлорид кальция
14. Наиболее выражена ионная связь между атомами:
1) K и Cl 2) Mg и Cl 3) Al и Cl 4) P и Cl
15. Заряд атома кремния равен:
1) +14 2) +28 3) 0 4) +4
16. Число атомов в формульной единице фосфата натрия равно:
1) 2 2) 4 3) 6 4) 8
17. Заполнение электронами последнего энергетического уровня происходит в атоме элемента:
1) скандия 2) брома 3) титана 4) железа
18. Последний электрон заполняет s-подуровень у атома элемента:
1) хлора 2) кремния 3) натрия 4) кобальта
19. Укажите пару элементов, атомы которых в основном состоянии содержат равное число электронов на внешнем р-подуровне:
1) N и O 2) S и Cl 3) Cи Si
10. Изотопы данного элемента не отличаются между собой:
1) атомной массой 2) физическими свойствами
3) числом протонов 4) числом нейтронов
20. Во втором и третьем периодах периодической системы слева направо:
1) уменьшается электроотрицательность 2) уменьшается радиус ионов
3) металлические свойства усиливаются 4) неметаллические свойства
ослабевают
21.В одной подгруппе периодической системы расположены:
1) марганец, бром, технеций 2) азот, ванадий, мышьяк
3) цинк, кадмий, ртуть 4) углерод, кремний, титан
22. В ряду химических элементов: Si → P → S → Cl неметаллические свойства:
1) не изменяются 2) усиливаются
3) ослабевают 4) изменяются периодически
Контрольная работа по теме «Строение вещества»
Вариант2
1. В ковалентных соединениях состава Н2Э число общих электронных пар равно:
1) 1 2) 2 3) 3 4) 4
2. Только ковалентные полярные связи присутствуют в молекуле:
1) оксида кремния (IV) 2) хлорида натрия
3) хлороводорода 4) сульфата аммония
3. Наименьшее число ковалентных неполярных связей в молекуле:
1) N2 2) O2 3) P4 4) S8
4. Химическая связь в молекулах брома и бромоводорода отличается:
1) числом общих электронных пар
2) числом электронов, принимающих участие в образовании связи
3) числом валентных электронов у атомов водорода и брома
4)смещением электронной пары к атому с большей электроотрицательностью
5. В молекуле азота число общих электронных пар равно:
1) 1 2) 2 3) 3 4) 4
6. Хлор образует ковалентную полярную связь с элементом, химический знак которого:
1) Mg 2) C 3) Nа 4) Li
7. Какие из утверждений являются верными?
А) Все гибридные орбитали имеют одинаковую форму
Б) Чем больше энергия химической связи, тем меньше ее прочность
1) верно только А 2) верно только Б
3) оба утверждения верны 4) оба утверждения неверны
8. Ковалентная связь между атомами образована по донорно-акцепторному механизму в соединении:
1) NH3 2) NH4Cl 3) СCl4 4) НCl
9. Из щелочных металлов наибольшую тенденцию к образованию ковалентных связей проявляет:
1) Li 2) Na 3) K 4) Rb
10. Водородные связи есть в веществе:
1) брома 2) иода 3) льда 4) сахарозы
11. Водородная связь не образуется между молекулами:
1) воды 2) фтора 3) аммиака 4) фтороводорода
12. Металлическую связь образует элемент с электронной конфигурацией атома:
1) 1s22s22p63s23p3 2) 1s22s22p4
3) 1s22s22p63s23p1 4) 1s22s22p3
13. Вещество с наибольшей температурой плавления:
1) сахароза 2) лед
3) иод 4) хлорид кальция
14. Наиболее выражена ионная связь между атомами:
1) K и Cl 2) Mg и Cl 3) Al и Cl 4) P и Cl
15. Заряд атома кремния равен:
1) +14 2) +28 3) 0 4) +4
16. Число атомов в формульной единице фосфата натрия равно:
1) 2 2) 4 3) 6 4) 8
17. Заполнение электронами последнего энергетического уровня происходит в атоме элемента:
1) скандия 2) брома 3) титана 4) железа
18. Последний электрон заполняет s-подуровень у атома элемента:
1) хлора 2) кремния 3) натрия 4) кобальта
19. Укажите пару элементов, атомы которых в основном состоянии содержат равное число электронов на внешнем р-подуровне:
1) N и O 2) S и Cl 3) Cи Si
10. Изотопы данного элемента не отличаются между собой:
1) атомной массой 2) физическими свойствами
3) числом протонов 4) числом нейтронов
20. Во втором и третьем периодах периодической системы слева направо:
1) уменьшается электроотрицательность 2) уменьшается радиус ионов
3) металлические свойства усиливаются 4) неметаллические свойства
ослабевают
21.В одной подгруппе периодической системы расположены:
1) марганец, бром, технеций 2) азот, ванадий, мышьяк
3) цинк, кадмий, ртуть 4) углерод, кремний, титан
22. В ряду химических элементов: Si → P → S → Cl неметаллические свойства:
1) не изменяются 2) усиливаются
3) ослабевают 4) изменяются периодически
Решение задач:
1 Рассчитайте, какой объём азота (н.у.) образуется при полном сгорании 67,2 л (н.у.) аммиака. (Запишите число с точностью до десятых.)
2 Вычислите объем газа, который образуется при взаимодействии 40 л азота и 40 л водорода при нагревании и давлении, в присутствии катализатора. (Запишите число с точностью до целых)
3 Какой объем воздуха необходим при полном сгорании 35 л сероводорода? (Запишите число с точностью до целых)
4. Сульфид железа (II) массой 33,4 г обработали избытком хлороводородной кислоты. Определите объем (н.у.) газа, выделившегося в результате реакции (запишите ответ с точностью до десятых)
Критерии оценки умений решать расчетные задачи
Отметка «5»:- в логическом рассуждении и решении нет ошибок, задача решена рациональным способом;
Отметка «4»:- допущено не более двух несущественных ошибок или решено правильно две задачи из трех.
Отметка «3»:- в логическом рассуждении нет существенных ошибок, но допущена существенная ошибка в математических расчетах, правильно решена только одна задача из трех.
Отметка «2»: -не решена ни одна задача из задач
Тема 1.4 Вода. Растворы. Электролитическая диссоциация
| 1.Закончить уравнения возможных реакций |
|
А) CaO+SO3→ Б)Al+HCl→ В)KNO3+ HNO3→ Г)Na2SO4+BaCl2→ Д)Cu(OH)2+NaOH→ |
А) HNO3+HCl→ Б)NH4NO3+KOH→ В)MgO+CO2→ Г)Al+FeCl3→ Д)Na3PO4+K2SO3→
|
| 2.Написать полные и сокращённые ионные уравнения для следующих реакций
|
| А) KOH+ H2SO4→ K2SO4+H2O Б) AgNO3+ HCl→AgCl+ HNO3 В)NH4Cl+ NaOH→NH4OH+NaCl | А) CaCO3+ HCl→ CaCl2+H2CO3 Б) HNO3+ NaOH→NaNO3+ H2O В)AlCl3+ KOH→Al(OH)3+KCl
|
| 3.Расставить степени окисления H3PO4, CO2, Mg(OH)2, K2CO3, AlOHSO4. | каждого элемента в соединениях N2O5, Al(OH)3, HNO3, Na2SO4, K2HPO4.
|
| 4.Осуществить превращения |
|
| N2→N2O5→HNO3→Ca(NO3)2 Li→Li2O→LiOH→Li2SO4 |
Решение задач:
Задания первого уровня:
1. Определите массовую долю соли в растворе, если для его приготовления взяли 80 г воды и 20 г соли (при решении использовать формулу).
2. Вычислите массы поваренной соли и воды, необходимые для приготовления 200 г физиологического раствора (0,9-процентный раствор поваренной соли).
3. Необходимо приготовить 500 г раствора “марганцовки” – перманганата калия. С массовой долей 0,1%. Определите массы воды и указанной соли для приготовления раствора.
Задания второго уровня:
1. Определите массу соли, которую надо растворить в 270 г воды. Чтобы получить раствор с массовой долей растворенного вещества 0,1 (или 10%).
2. Определите массу сухой соли, которая образуется в чашке после выпаривания 150 г раствора с массовой долей этой соли 15%.
3. Определите массу сахара, который нужно растворить в 1 л воды. Чтобы получился раствор с массовой долей сахара 20%.
Задания третьего уровня:
1. Железнодорожная цистерна имеет грузоподъёмность 60 т. Какова масса перевозимой воды при транспортировке 65-процентной азотной кислоты пятидесятивагонным поездом.
2. Одним из основных источников промышленного получения магния служит морская вода. Где его содержание составляет 0,13%. Какова масса морской воды, которую необходимо переработать, чтобы получить в конечном результате 100 т магния.
Критерии оценки умений решать расчетные задачи
Отметка «5»:- в логическом рассуждении и решении нет ошибок, задача решена рациональным способом;
Отметка «4»:- допущено не более двух несущественных ошибок или решено правильно две задачи из трех.
Отметка «3»:- в логическом рассуждении нет существенных ошибок, но допущена существенная ошибка в математических расчетах, правильно решена только одна задача из трех.
Отметка «2»: -не решена ни одна задача из задач
Тема 1.5 Классы неорганических соединений
Теоретические вопросы:
1.Как можно получить оксид металла: а) из простого вещества;
б) из основания; в) из соли? Покажите уравнениями реакций на примере оксидов магния и цинка.
2.Как можно получить оксид неметалла: а) из простого вещества;
б) из кислоты; в) из соли? Покажите уравнениями реакций на примере оксидов серы (IV) и углерода (IV).
3.Среди оксидов ВаО, А12О3, CI 2 O 7 найти основной, кислотный и амфотерный. Покажите основность, кислотность и амфотерность соответствующих оксидов уравнениями реакций.
4. Среди гидроксидов Са(ОН)2, Fe(OH)2, Sn(OH)2 найдите амфотерный и покажите его амфотерность уравнениями реакций.
5.Как вывести формулу кислоты, если известен ее ангидрид? Покажите на примере серного (SO3), сернистого (SO2), азотного (N2O5) и азотистого (N2O3) ангидридов.
6.Оксиды СаО, А12О3 и Р2О5 по внешнему виду неразличимы. Как можно их отличить при помощи химических реакций?
7.Если металл переменной валентности образует несколько оксидов и гидроксидов, то как отличаются по свойствам такие оксиды и гидроксиды? Покажите на примере соединений хрома (II, III, VI).
8.Напишите уравнения реакций получения нитрата калия взаимодействием: а) основания с кислотой; б) основного оксида с кислотным;
в) основания с кислотным оксидом; г) основного оксида с кислотой.
9.С какими из веществ из числа HNO3, HNO2, NaOH, BaO, SO3, Al2O3, Zn(OH)2 может взаимодействовать оксид кальция? Напишите уравнения реакций.
10.Какие из указанных газов вступают в химические реакции с растворами щелочей: HCl, H2S, NH3, CH4, SO2, SO3? Напишите уравнения реакций.
11.Напишите названия веществ: NO2, HF, H2SiO3, H4SiO4. Напишите формулы веществ, имеющих названия: а) сульфат лития, б) сульфит магния, в) дигидрофосфат калия, г) сульфат гидроксомеди (II).
12.Напишите обычные и структурные формулы веществ, имеющих названия: а) азотный ангидрид, б) гидросульфат свинца (II), в) сульфат гидроксожелеза (II), г) натриевая селитра,
13.Напишите названия данных веществ и их структурные формулы: Be(OH)2, HMnO4, MgSO 4, Ca(HCO3) 2.
Решение задач:
Назвать следующие химические соединения и определить степень окисления всех элементов соединений: 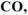
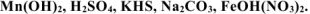
б) Написать формулы следующих химических соединений: оксид свинца (IV), сульфат лития, хлорид гидроксоцинка, дигидроортофосфат алюминия
Тема 1.6 Химические реакции
Теоретические вопросы:
1.Среди данных химических уравнений найдите уравнения реакций присоединения, разложения, замещения и обмена и определите в них стехиометрические коэффициенты:
а) СаСОз + CO2 + H2O = Са(НСОз)2
б) Cl2 + KI = KCl + I2
в) MgCO3 = MgO + CO2
г) BaO + HCl = BaCl2 + H2O
2.Определите стехиометрические коэффициенты в уравнениях реакций, в которых степень окисления атомов не изменяется:
а) SiO2 + K2CO3 = K4SiO4 + CO2
б) Na3N + H2O = NaOH + NH3
в) IF5 + KOH = KIO3 + KF + H2O
3.Определите степень окисления фосфора в соединениях и ионах: PH3, Na3P, H3PO2, H3PO3, H3PO4, HPO3, H4P2O7, HPO42-, H2PO4-, PO43-.
4.Среди данных веществ укажите окислитель, восстановитель и вещество с окислительно-восстановительной двойственностью, ответ мотивируйте и иллюстрируйте примерами реакций: MnO2, Mn, KMnO4.
5.Для каждой реакции:
1) определите ее тип;
2) укажите восстановитель и окислитель;
3) определите коэффициенты методом электронного баланса;
4) методом полуреакций;
5) вычислите эквивалентные массы восстановителя и окислителя:
а) HBr + H2SO4 = Br2 + SO2 + H2O
б) MnSO4 + Ca(ClO)2 + NaOH = Na2MnO4 + CaCb + Na2SO4 + H2O
в) FeS + HNO3 = Fe(NO3)3 + H2SO4 + NO + H2O
Решение задач:
1. Вычислите количество вещества водорода, полученного при взаимодействии 2,8 г железа с соляной кислотой по уравнению. Fe + 2HCl = FeCl2 + Н2
2. Вычислите массу оксида меди (II), полученного при окислении 32 г меди.
3. Вычислите объем углекислого газа (н.у. ), полученного при взаимодействии 250 г известняка (карбоната кальция), содержащего 10% примесей, с раствором азотной кислоты
4. Какой объем водорода (н.у.) образуется при взаимодействии 650 г цинка, содержащего 20% примесей, с соляной кислотой?
5. Какой объем углекислого газа (н.у.) образуется при взаимодействии 200 г CaCO3 (известняка), содержащего 20% примесей, с азотной кислотой?
6. Решите задачу. Определите массу оксида бария, который можно получить при взаимодействии бария с 4 моль кислорода.
Критерии оценки умений решать расчетные задачи
Отметка «5»:- в логическом рассуждении и решении нет ошибок, задача решена рациональным способом;
Отметка «4»:- допущено не более двух несущественных ошибок или решено правильно две задачи из трех.
Отметка «3»:- в логическом рассуждении нет существенных ошибок, но допущена существенная ошибка в математических расчетах, правильно решена только одна задача из трех.
Отметка «2»: -не решена ни одна задача из задач
Тема 1.7 Металлы и неметаллы
Теоретические вопросы:
1.В каких группах и периодах периодической системы химических элементов Д.И.Менделеева сосредоточены элементы-неметаллы?
2.Элементы VIa группы таблицы Д.И.Менделеева называют халькогенами (рождающие соли). Напишите пять формул солей с различными кислотными остатками, содержащих элементы VIa группы. Назовите эти соли.
3. Напишите по две формулы кислотных оксидов, кислот и оснований. Где они встречаются в природе и какие неметаллы их образуют?
4.Откуда в природе взялись залежи угля?
5.Как изменяются неметаллические свойства элементов в таблице Д.И. Менделеева в периодах слева направо и в главных подгруппах сверху вниз?
6.Некоторые неметаллы взаимодействуют с кислотами-окислителями, превращаясь в кислоты или в кислотные оксиды с высшими степенями окисления. Составьте уравнения следующих реакций:
а) С + Н2SО4 (конц.) = ……………………………………………………. ;
б) С + НNО3 (конц.) = ……………………………………………………. ;
в) Р + НNО3 (конц.) = ……………………………………………………. ;
7.Какие элементы-металлы в периодической системе Д.И. Менделеева оказываются вблизи диагонали от бора к астату, разделяющей металлы и неметаллы?
8.Какова особенность строения кристаллической решетки металлов?
9.Приведите химические символы и названия трех элементов-металлов главных подгрупп и трех элементов побочных подгрупп.
10.Пирометаллургический метод – восстановление металлов из руд при нагревании в присутствии: а) угля; б) оксида углерода(II); в) алюминия; г) водорода. Напишите уравнения реакций восстановления металлов из их оксидов (в скобках указан восстановитель): SnO2 (а), Fe3
11.Для каждого из перечисленных металлов – Na, Ca, Mg, Al, Sn – напишите по одной реакции с каким-либо из следующих реагентов: О2, Сl2, S, Н2О, НСl.
Решение задач:
1.В колбу с 75,6 г воды постепенно внесли 4,6 г металлического натрия. Вычислите массовую долю (в %) гидроксида натрия в полученном растворе.
2.В чашку с ледяной водой поместили кусочек щелочного металла массой 1,4 г. Когда реакция закончилась, привес массы оказался равным 1,2 г. Рассчитайте относительную атомную массу металла и назовите его.
3.Рассчитайте массу и объём при н.у. хлора, который необходим для получения 18 г хлороводорода.
4. Какой объем углекислого газа (н.у.) выделится при сжигании 500г угля, содержащего 8 % негорючих примесей.
5. Вычислите массу оксида кальция, который может быть получен при разложении карбоната кальция массой 50 кг, массовая доля примесей в котором составляет 20 %.
6. Над 16 г серы пропустили водород при нагревании. Определите объем (н.у.) полученного сероводорода, если выход продукта реакции составляет 85% от теоретически возможного.
7. Смешали два раствора, содержащих соответственно 33,3г хлорида кальция и 16,4г фосфата натрия. Вычислите массу осадка.
8. Вычислите объём углекислого газа (н.у.), выделившегося при действии соляной кислоты массой 30 г на карбонат кальция массой 25 г.
Критерии оценки умений решать расчетные задачи
Отметка «5»:- в логическом рассуждении и решении нет ошибок, задача решена рациональным способом;
Отметка «4»:- допущено не более двух несущественных ошибок или решено правильно две задачи из трех.
Отметка «3»:- в логическом рассуждении нет существенных ошибок, но допущена существенная ошибка в математических расчетах, правильно решена только одна задача из трех.
Отметка «2»: -не решена ни одна задача из задач
Список источников литературы
-
Химия: учеб. для студ. проф. учеб. заведений / О.С. Габриелян, И.Г. Остроумов. – М., 2012.
-
Габриелян О.С. Химия в тестах, задачах, упражнениях: учеб. пособие для студ. сред. проф. учебных заведений / О.С. Габриелян, Г.Г. Лысова – М., 2006.
-
Габриелян О.С. Практикум по общей, неорганической и органической химии: учеб. пособие для студ. сред. проф. учеб. заведений / Габриелян О.С., Остроумов И.Г., Дорофеева Н.М. – М., 2007.
-
Габриелян О.С. Общая химия: учеб. для 11 кл. общеобразоват. учреждений с углубл. изучением химии / О.С. Габриелян, И.Г. Остроумов, С.Н. Соловьев, Ф.Н. Маскаев – М., 2005.
-
Габриелян О.С., Лысова Г.Г. Химия в тестах, задачах и упражнениях: учеб. пособие. – М., 2004.
-
Габриелян О.С. Настольная книга учителя химии: 11 класс: в 2 ч. / О.С. Габриелян, Г.Г. Лысова, А.Г. Введенская – М., 2004.
19

























