
1-Пересыпкинский филиал МБОУ 2-Гавриловской СОШ
Пустовалова Любовь
Александровна,
учитель химии
2018 год

ТЕМА УРОКА

Вступление
Дождливый день. На остановке троллейбуса люди складывают зонтики и заходят в салон. Вот один из них поставил ногу на ступеньку и тут же вскрикнул: «Ой, током бьёт!» Как же ток добрался до пассажира?
Ещё на заре изучения электрических явлений учёные заметили, что ток могут проводить не только металлы, но и растворы. Но не всякие.
На сегодняшнем уроке мы…

ЦЕЛЬ УРОКА
Изучить классификацию веществ по электрической проводимости;
Рассмотреть механизм диссоциации веществ с ионной и ковалентной полярной связью ;
Изучить процесс электролитической диссоциации кислот, щелочей, солей.
ПЛАН УРОКА
- Электролиты и неэлектролиты.
- Электролитическая диссоциация:
а) кислот
б) щелочей
в) солей

В растворах вещества распадаются на структурные единицы – молекулы, ионы, атомы . Как вы думаете, в каком случае раствор будет проводить электрический ток? Электрический ток проводится заряженными частицами. Из перечисленных к заряженным относятся только ионы. Значит, электрический ток будут проводить вещества, распадающиеся в растворе на ионы .

эксперимент
Проверим электропроводность дистиллированной воды, кристаллов соли, сахара, спирта . Они неэлектропроводны. Растворим в дистиллированной воде сахар, соль, и проверим электропроводность растворов. Раствор сахара не проводит ток, значит, сахар в растворе распадается на молекулы. С оль в растворе проводят ток, значит, они распались на ионы.
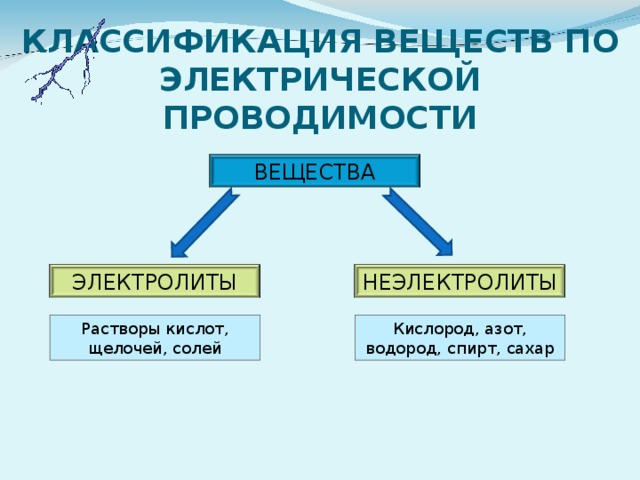
КЛАССИФИКАЦИЯ ВЕЩЕСТВ ПО ЭЛЕКТРИЧЕСКОЙ ПРОВОДИМОСТИ
ВЕЩЕСТВА
ЭЛЕКТРОЛИТЫ
НЕЭЛЕКТРОЛИТЫ
Растворы кислот, щелочей, солей
Кислород, азот, водород, спирт, сахар
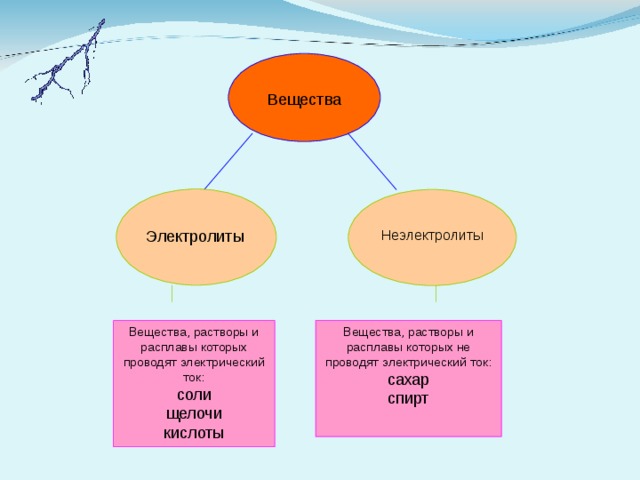
Вещества
Электролиты
Неэлектролиты
Вещества, растворы и расплавы которых проводят электрический ток:
соли
щелочи
кислоты
Вещества, растворы и расплавы которых не проводят электрический ток:
сахар
спирт

- Вещества, растворы которых не проводят электрический
ток:
сахар
спирт
- Вещества, растворы которых проводят электрический ток:
соли
щелочи
кислоты
Неэлектролиты
Электролиты
Фрагмент Видео

Шведский ученый, академик. В 1887 году сформулировал основные положения об электролитической диссоциации.
C . А. Аррениус (1859-1927)

Электролитическая диссоциация – процесс распада электролита на ионы при растворении его в воде или расплавлении

Кистяковский Владимир Александрович (1865—1952 ).
- Русский ученый, физикохимик, академик. В. А. Кистяковский в 1888 г. высказал идею об объединении химической теории растворов Д. И. Менделеева с учением С. Аррениуса об электролитической диссоциации.

И. А. Каблуков (1857— 1942).
- Русский ученый, академик. Независимо от
- В. А. Кистяковского в 1889—1891 гг. ввел представление о гидратации ионов. Положил начало физической и химической теории растворов.

МЕХАНИЗМ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ ВЕЩЕСТВ С ИОННОЙ СВЯЗЬЮ
диссоциация
Ориентация
гидратация

МЕХАНИЗМ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ ВЕЩЕСТВ С КОВАЛЕНТНОЙ ПОЛЯРНОЙ СВЯЗЬЮ
диссоциация
Ориентация
гидратация
ионизация

Степень диссоциации
α= N (дисс.)/ N (общее)*100%
зависит
От природы растворенного вещества и растворителя.
От концентрации раствора (чем меньше концентрация раствора, тем больше α.
От температуры (чем выше температура, тем больше α.

Степень диссоциации зависит:
от природы растворенного вещества и растворителя%
от температуры ( чем выше температура, тем больше а);
от концентрации раствора (чем меньше концентрация раствора, тем больше а).
Кислоты диссоциируют ступенчато, причем степень диссоциации на каждой очередной ступени ниже, чем на предыдущей:
1 ступень H 2 S H ++ HS - гидросульфид –анион.
2 ступень HS - H ++ S 2- сульфид-анион.

Положения теории электрической диссоциации
Электролиты в растворах и расплавах диссоциируют (распадаются) на ионы.
Диссоциация – обратимый процесс.
При пропускании через раствор или расплав электролита электрического тока к катоду движутся катионы, а к аноду – анионы.
Не все электролиты в одинаковой мере диссоциируют на ионы.
Атомы и ионы одного и того же элемента отличаются строением и свойствами.

КИСЛОТЫ С ПОЗИЦИИ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ
Кислоты – это электролиты, которые диссоциируют на катионы водорода и анионы кислотного остатка
-
+
+ Cl
Н С l
Н
2-
Н 2 SO 4
+ SO 4
+
2 Н

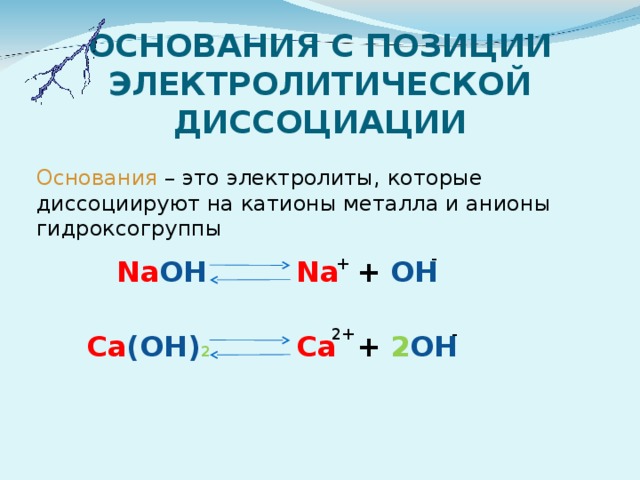
ОСНОВАНИЯ С ПОЗИЦИИ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ
Основания – это электролиты, которые диссоциируют на катионы металла и анионы гидроксогруппы
-
Na OH
+ OH
+
Na
2+
-
+ 2 OH
Ca (OH) 2
Ca
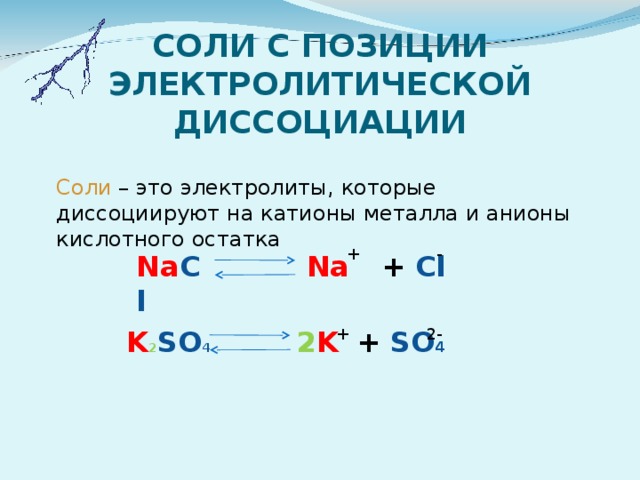
СОЛИ С ПОЗИЦИИ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ
Соли – это электролиты, которые диссоциируют на катионы металла и анионы кислотного остатка
-
+
Na С l
+ Cl
Na
+
+ SO 4
2-
K 2 SO 4
2 K

Заряд ионов Для двух ребят подарков груз ИОН взвалил себе на спину:
- Для АНИ ОН несёт свой МИНУС –
- Для КАТИ ОН несёт свой ПЛЮС +
АНЯ -
КАТЯ +

Кислоты-это электролиты, при которых образуются катионы водорода и анионы кислотного остатка.
Щелочи-электролиты, при диссоциации которых образуется катионы металла и гидроксид-анионы.
Электролиты
Соли-электролиты, при диссоциации которых образуются катионы металла и анионы кислотных остатков.

ИЗМЕНИЕ ОКРАСКИ ИНДИКАТОРОВ В ЗАВИСИМОСТИ ОТ СРЕДЫ
Название индикатора
Окраска индикатора в щелочной среде
Фенолфталеин
Окраска индикатора в кислотной среде
Метиловый оранжевый

ИЗМЕНИЕ ОКРАСКИ ИНДИКАТОРОВ В ЗАВИСИМОСТИ ОТ СРЕДЫ
Название индикатора
Окраска индикатора в щелочной среде
Фенолфталеин
Окраска индикатора в кислотной среде
Малиновая
Метиловый оранжевый
Бесцветная

ИЗМЕНИЕ ОКРАСКИ ИНДИКАТОРОВ В ЗАВИСИМОСТИ ОТ СРЕДЫ
Название индикатора
Окраска индикатора в щелочной среде
Фенолфталеин
Окраска индикатора в кислотной среде
Малиновая
Метиловый оранжевый
Желтая
Бесцветная
Красно - розовая

Применение электролитической диссоциации
ЭЛЕКТРОФОРЕЗ- лечебный метод, сочетающий действие на организм постоянного тока и вводимых с его помощью лекарственных веществ. Основан на теории электролитической диссоциации. В соответствии с ионной теорией лекарственные вещества при электрофорезе вводятся в организм соответственно их полярности: катионы - с анода, анионы - с катода через кожу и слизистую оболочку Используется при заболеваниях органов дыхания, печени, поджелудочной железы, сосудов конечностей.
Иониты - твердые нерастворимые в воде вещества, способные обмениваться своими ионами с ионами внешней среды.
Используются: при производстве сахара, умягчения и очистки воды и других веществ, повышения урожайности, при производстве антибиотиков и их очистки. Для длительного хранения донорской крови её пропускают через слой катионитов. Кровь больных пропускают в колонку с ионитом для очистки тот вредных примесей.

ВЫБЕРИТЕ ПРАВИЛЬНЫЕ ОТВЕТЫ
I . Какое из перечисленных веществ не является электролитом :
1)хлорид алюминия;
2)сахар;
3)азотная кислота;
4)сульфат железа

II . Электролиты – это вещества с:
1) металлической связью;
2) ионной связью;
3) ковалентной полярной связью;
4) ковалентной неполярной связью.

III . Какое из перечисленных веществ проводит электрический ток:
1)водород;
2) хлор;
3)гидроксид калия;
4)дистиллированная вода

IV . Частицы, заряженные отрицательно называются:
1) ионами;
2) катионами;
3) анионами;
4) атомы

V . Кислоты в растворе и расплаве диссоциируют на:
1) анион кислотного остатка;
2) Катион водорода;
3) катион металла;
4) анион гидроксогруппы.

VI . Свойства оснований определяются наличием в растворе:
1) катиона металла
2) аниона кислотного остатка
3) катиона водорода;
4) аниона гидроксогруппы.

Рефлексия
Закончите предложения:
- На уроке я услышал……………………………….
- На уроке я увидел…………………………………
- На уроке я узнал …………………………………..….

Выводы:
- познакомились с понятиями электролиты и неэлектролиты.
- изучили механизм электролитической диссоциации веществ с ионной и ковалентной полярной связями.
- Дали определение веществам с учётом электролитической диссоциации

Теорию электролитической диссоциации в 1887 году сформулировал шведский ученый Сванте Аррениус; по мере развития знаний о растворах она дополнялась и в современном виде содержит следующие положения.
1. Электролиты в растворах и расплавах диссоциируют (распадаются) на ионы.
2. Диссоциация – обратимый процесс.
3.Не все электролиты в одинаковой мере диссоциируют на ионы.
4.При пропускании через раствор или расплав электролита электрического тока к катоду (-) движутся положительные ионы (катионы), а к аноду(+) –отрицательные ионы (анионы).
5.Атомы и ионы одного и того же элемента отличаются строением и свойствами.
Домашнее задание.




















































