Тема: Фтор, бром, йод.
Цель: изучить получение, применение и свойства фтора, брома, йода.
Задачи.
Образовательная: ознакомить обучающихся с действие на организм фтора, брома, иода и их соединений. Сформировать умение распознавать иод, бромид- и иодид-ионы в растворах. Охарактеризовать области применения этих галогенов.
Развивающая: Развивать умение применять знания на практике. Развивать умение анализировать, сравнивать, обобщать, выделять главное. Развивать приемов наблюдения.
Воспитательная: Воспитание мотивов учения, положительного отношения к знаниям.
Тип урока: комбинированный.
1. Организационный момент, целеполагание.
2. Мотивация, актуализация знаний.
Ребята, как вы считаете, полезен ли фтор для наших зубов? Слышали ли вы выражение “врач прописал мне пить бром”? Что это означает? Ответ: фтор – необходимый микроэлемент, в небольших дозах полезен для зубов, ногтей, костей, волос, но в больших дозах – это яд, имеющей обратное действие. Лекарство от бессонницы, успокоительное содержит бромид натрия.
3. Проверка домашней работы.
1) Написать уравнения реакции согласно схеме:
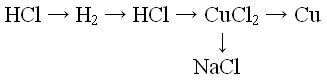
Ответ:
2HCl + Zn — H2 + ZnCl2,
H2 + Cl2 — 2HCl,
2HCl + CuO — CuCl2+ H2O,
CuCl2 + Zn — Cu + ZnCl2,
HCl + NaOH— NaCl + H2O
4. Изучение нового материала и первичное закрепление.
История открытия галогенов:
1886 г. Мауссан (Франция) фторос (греч.) – разрушающий – реагирует со всеми веществами активно со взрывом или воспламенением (выражение “гори оно все синим пламенем” относится к реакции 2F2 + 2H2O = 4HF + O2)
1826 г. Балар (Франция) бромос (греч.) – зловонный – запах простого вещества Br2
1811 г. Куртуа (Франция) иодес (греч.) – фиолетовый – цвет паров иода I2
Свойства галогенов: самый активный неметалл окислитель – F2
F2 Cl2 Br2 I2
Допишите реакции, зная, что предыдущий галоген вытесняет следующий
а) Сl2 + KBr =
б) Сl2 + LiI =
в) Br2 + KI =
г) Br2 + KCl =
Ответ: реакция г) невозможна.
Действие на организм: разрушает зубы, ногти, приводит к ломкости костей, хотя в небольших количествах фтор, бром и иод – важные микроэлементы для животных и растений. СаF2 входит в состав зубной эмали, поступает фтор с питьевой водой и пищей. НО избыток фторидов действует БОЛЕЕ разрушающе на эмаль, чем недостаток.
Применение: фреоны CCl2F2, смазочные материалы термостойкие, тефлон.
Бром образует подобно хлору бромную воду, но бром менее активен, бурая вонючая жидкость, токсична,
Применение: необходим для синтеза красителей и лекарств содержащих NaBr (бессонница, расстройства нервной системы), для получения черно-белой фотографии 2AgBr = (свет) 2Ag + Br2
Иод менее активен, чем бром, не растворим и не реагирует с водой, черно-фиолетовый кристаллы, легко возгоняется (эксперимент – возгонка иода при нагревании)
Применение: спиртовая настойка иода – антисептик, кровоостанавливающее средство, необходим для функционирования щитовидной железы, содержится в воде и воздухе морском, луке, рыбе и креветках. Йодированная соль – это NaCl + NaBr. Избыток вызывает отравление, раздражает кожу.
Качественные реакции – действие раствора нитрата серебра AgNO3
AgI – желтый осадок
AgBr – бледно-желтый
AgCl – белый творожистый осадок
Фторид серебра растворим.
В присутствии йода – простого вещества – крахмал синеет.
5. Подведение итогов.
- Что узнали нового для себя? Фтор, бром, иод – необходимые микроэлементы, в больших количествах являются разрушающими веществами, ядами. Для галогенов характеры свойства типичных неметаллов, используют для синтеза красителей, лекарств, термостойких смазочных материалов и тефлоновых покрытий.
Выставление оценок за урок по результатам работы.
Домашнее задание:
- параграф 16 учебника Новошинский И.И., Новошинская Н.С. Химия: учебник для 9 класса,
- задания 1-4,
- подготовка к практической работе.