
Гидролиз органических соединений. Решение расчетных задач. Гидролиз неорганических соединений
11 класс

Цели урока:
- Ознакомиться с понятием гидролиза солей.
- Рассмотреть типы гидролиза.
- Научиться составлять ионные уравнения гидролиза солей.
- Научиться определять тип гидролиза соли по её формуле.

Что такое гидролиз?
( от греческого hydro – вода ;
lysis – разложение )
- взаимодействие органических и неорганических веществ с водой

Гидролиз алкенов приводит к образованию спиртов
H 2 O=CH + HOH CH 3 +CH 2 - OH
Этен этиловый спирт
CH 3 –CH=CH 2 +HOH CH 2 -CH-CH 2
Пропен
OH
пропиловый спирт(пропанол-2)
CH 3 -CH 2 -CH=CH 2 +HOH CH 3 -CH 2 -CH-CH 3
Бутен-1
OH
бутанол-2
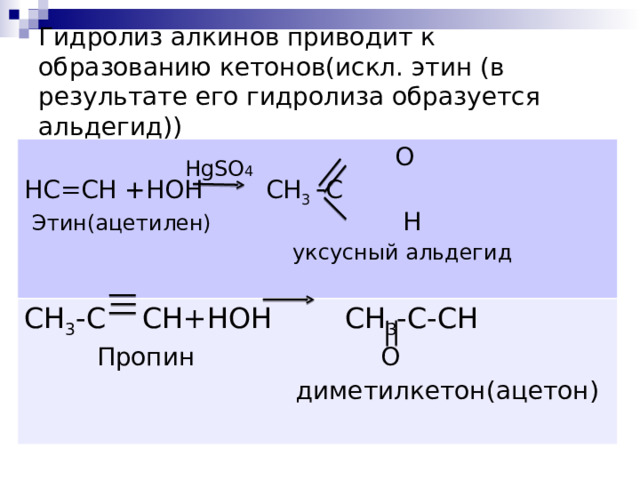
Гидролиз алкинов приводит к образованию кетонов(искл. этин (в результате его гидролиза образуется альдегид))
O
H С =CH + HOH CH 3 - C
Этин(ацетилен) H
уксусный альдегид
С H 3 - C СН+ HOH CH 3 - C-CH
Пропин
диметилкетон(ацетон)
HgSO 4
O
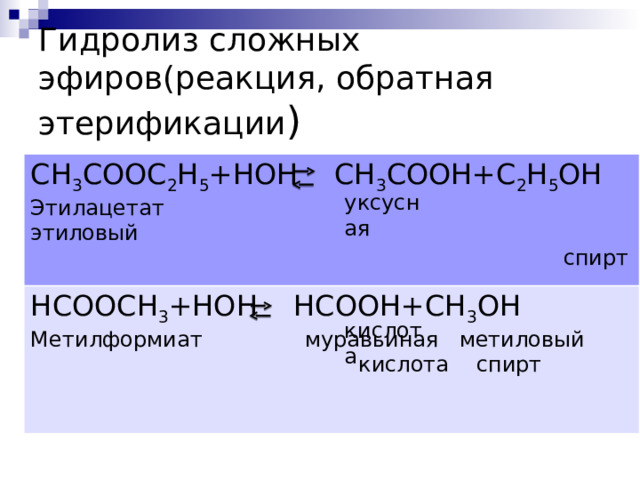
Гидролиз сложных эфиров(реакция, обратная этерификации )
СН 3 С OOC 2 H 5 +HOH CH 3 COOH+C 2 H 5 OH
Этилацетат этиловый
спирт
НС OOCH 3 +HOH HCOOH+CH 3 OH
Метилформиат муравьиная метиловый
кислота спирт
уксусная кислота
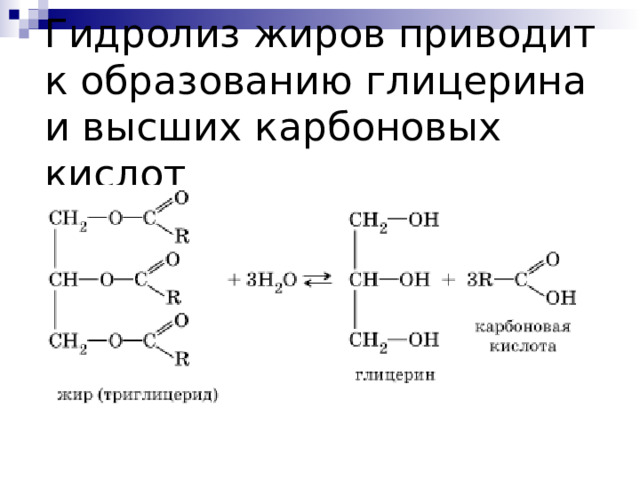
Гидролиз жиров приводит к образованию глицерина и высших карбоновых кислот
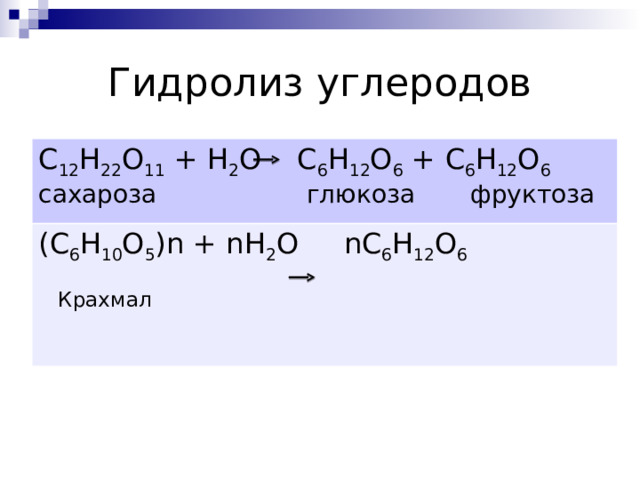
Гидролиз углеродов
C 12 H 22 O 11 + H 2 O C 6 H 12 O 6 + C 6 H 12 O 6
сахароза глюкоза фруктоза
( C 6 H 10 O 5 ) n + nH 2 O nC 6 H 12 O 6
Крахмал
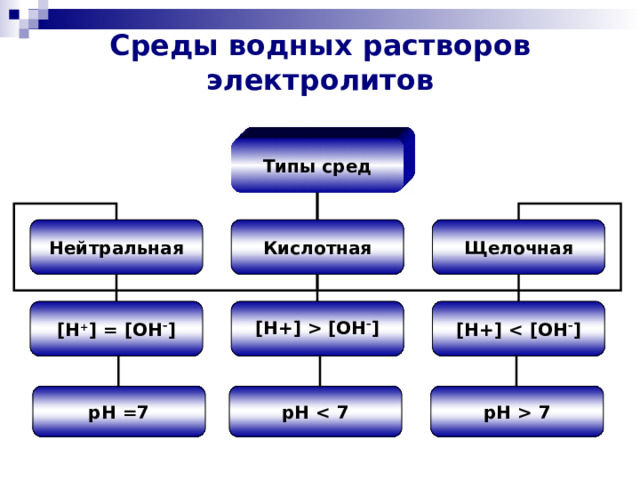 [OH – ] [H+] pH =7 pH pH 7 " width="640"
[OH – ] [H+] pH =7 pH pH 7 " width="640"
Среды водных растворов электролитов
Типы сред
Кислотная
Нейтральная
Щелочная
[H + ] = [OH – ]
[H+] [OH – ]
[H+]
pH =7
pH
pH 7

Определение гидролиза
- Гидролиз соли – это химическая реакция обмена соли с водой ,
в результате которой ионы слабого электролита, входящие в состав соли, соединяются с составными частями воды : H + и OH - .
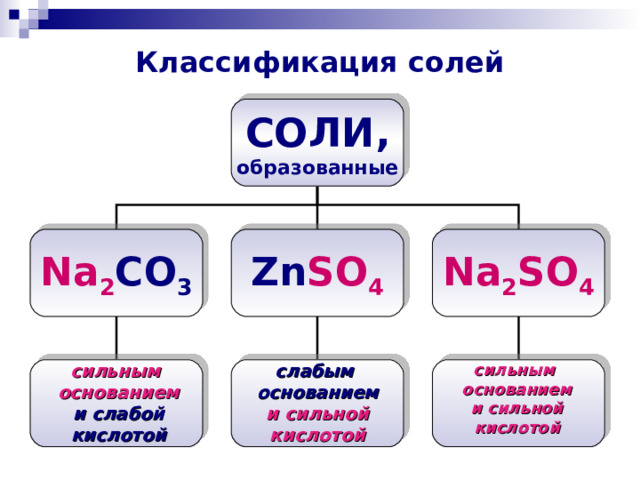
Классификация солей
СОЛИ,
образованные
Na 2 SO 4
Zn SO 4
Na 2 CO 3
сильным основанием и слабой кислотой
слабым основанием и сильной кислотой
сильным основанием и сильной кислотой
 7) гидролиз по аниону слабой кислотой Сильным основанием кислотная ( pH 2. Слабым основанием гидролиз по катиону сильной кислотой нейтральная среда ( pH = 7) не подвергаются гидролизу Сильным основанием 3. сильная кислотой " width="640"
7) гидролиз по аниону слабой кислотой Сильным основанием кислотная ( pH 2. Слабым основанием гидролиз по катиону сильной кислотой нейтральная среда ( pH = 7) не подвергаются гидролизу Сильным основанием 3. сильная кислотой " width="640"
Гидролиз солей
№
Соли, образованные
Реакция среды, pH
Тип гидролиза
1.
щелочная ( pH 7)
гидролиз по аниону
слабой кислотой
Сильным основанием
кислотная ( pH
2.
Слабым основанием
гидролиз по катиону
сильной кислотой
нейтральная среда ( pH = 7)
не подвергаются гидролизу
Сильным основанием
3.
сильная кислотой
 7 2 Na + +CO 3 2 - +HOH Na + + Н CO 3 - n +Na + +OH - Na 2 CO 3 +HOH NaHCO 3 +NaOH K 2 S 2K + +S 2 – S 2 - +HOH HS - +OH - 2K + +S 2 - +HOH K + +HS - +K + +OH - K 2 S+H 2 O KHS+KOH " width="640"
7 2 Na + +CO 3 2 - +HOH Na + + Н CO 3 - n +Na + +OH - Na 2 CO 3 +HOH NaHCO 3 +NaOH K 2 S 2K + +S 2 – S 2 - +HOH HS - +OH - 2K + +S 2 - +HOH K + +HS - +K + +OH - K 2 S+H 2 O KHS+KOH " width="640"
Гидролиз солей
А) гидролиз солей, образованных сильным основанием и слабой кислотой.
- Na 2 CO 3 2Na + + CO 3 2 -
- CO 3 2 - + HOH HCO 3 - + OH - среда щелочная pH 7
- 2 Na + +CO 3 2 - +HOH Na + + Н CO 3 - n +Na + +OH -
- Na 2 CO 3 +HOH NaHCO 3 +NaOH
- K 2 S 2K + +S 2 –
- S 2 - +HOH HS - +OH -
- 2K + +S 2 - +HOH K + +HS - +K + +OH -
- K 2 S+H 2 O KHS+KOH

Гидролиз солей
б) гидролиз солей, образованных сильным основанием и сильной кислотой
AlCl 3 Al 3+ + 3Cl -
Al 3+ + HOH ⇄ AlOH 2+ + H + - кислая среда pH
Al 3+ + 3Cl - + HOH ⇄ AlOH 2+ + 2Cl - + H + + Cl -
AlCl 3 + HOH ⇄ AlOHCl 2 + HCl
Гидрохлорид
алюминия

Гидролиз солей
б) гидролиз солей, образованных сильным основанием и сильной кислотой
Zn(NO 3 ) 2 Zn 2+ 2NO 3 -
Zn 2+ + HOH ⇄ ZnOH + + H + - кислая среда pH
Zn 2+ + 2NO 3 - + HOH ⇄ ZnOH + + NO 3 - + H + + NO 3 -
Zn(NO 3 ) 2 + HOH ⇄ ZnOHNO 3 + HNO 3
Гидроксонитрат
цинка
![В) гидролиз соли образованной слабым основанием и слабой кислотой CH 3 COONH 4 CH 3 COO - + NH 4 + CH 3 COO +HOHCH 3 COOH+OH - NH 4 + + HOH NH 4 OH + H + [OH] = [H] pH=7- среда нейтральная](https://fsd.multiurok.ru/html/2023/08/09/s_64d359a5c18d6/img15.jpg)
В) гидролиз соли образованной слабым основанием и слабой кислотой
CH 3 COONH 4 CH 3 COO - + NH 4 +
CH 3 COO +HOHCH 3 COOH+OH -
NH 4 + + HOH NH 4 OH + H +
[OH] = [H] pH=7- среда нейтральная
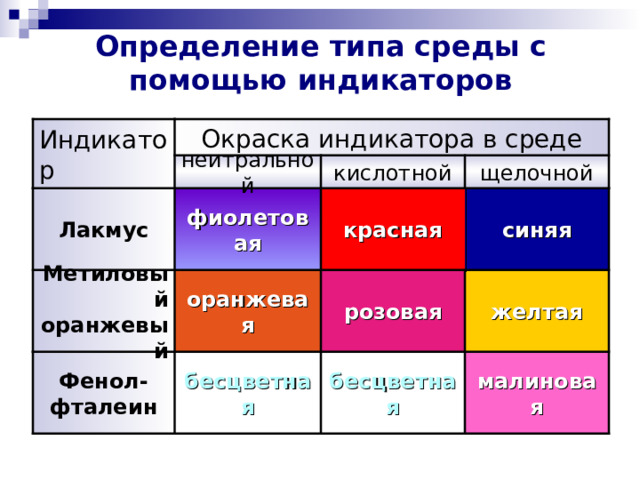
Определение типа среды с помощью индикаторов
Индикатор
Окраска индикатора в среде
нейтральной
кислотной
щелочной
красная
фиолетовая
Лакмус
синяя
розовая
оранжевая
Метиловый оранжевый
желтая
Фенол- фталеин
бесцветная
бесцветная
малиновая
 7 32 Кислотная pH розовая бесцветная красная ZnSO 4 46 Na 2 SO 4 фиолетовая оранжевая бесцветная Нейтральная pH = 7 " width="640"
7 32 Кислотная pH розовая бесцветная красная ZnSO 4 46 Na 2 SO 4 фиолетовая оранжевая бесцветная Нейтральная pH = 7 " width="640"
Лабораторный опыт Таблица № 1
Окраска индикатора
Соли
Среда,
pH
Фенол-фталеин
Лакмус
Метил-оранж
37
желтая
Na 2 CO 3
синяя
малиновая
Щелочная
pH 7
32
Кислотная
pH
розовая
бесцветная
красная
ZnSO 4
46
Na 2 SO 4
фиолетовая
оранжевая
бесцветная
Нейтральная
pH = 7
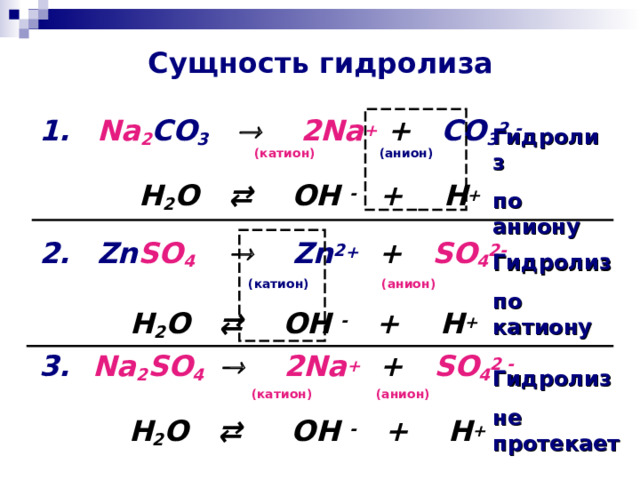
Сущность гидролиза
1. Na 2 CO 3 2Na + + CO 3 2 -
( катион) (анион)
H 2 O ⇄ OH - + H +
2. Zn SO 4 Zn 2 + + SO 4 2 -
( катион) (анион)
H 2 O ⇄ OH - + H +
3. Na 2 SO 4 2Na + + SO 4 2 -
( катион) (анион)
H 2 O ⇄ OH - + H +
Гидролиз
по аниону
Гидролиз
по катиону
Гидролиз
не протекает
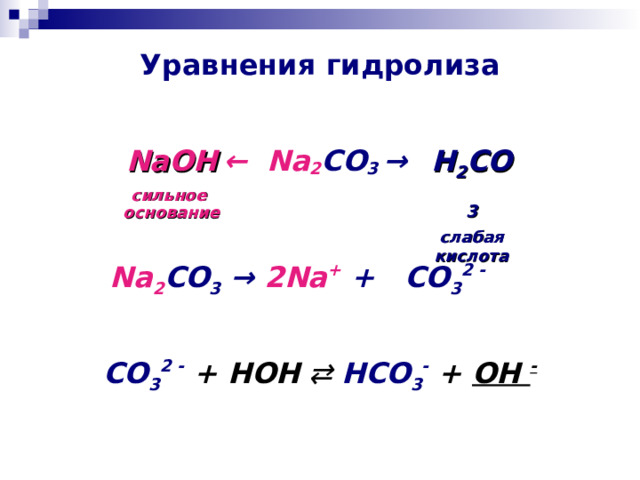
Уравнения гидролиза
← Na 2 CO 3 →
NaOH
сильное основание
H 2 CO 3
слабая кислота
Na 2 CO 3 → 2Na + + CO 3 2 -
CO 3 2 - + HOH ⇄ HCO 3 - + OH -

Уравнения гидролиза
← Zn S O 4 →
Zn (ОН) 2
слабое основание
H 2 SO 4
сильная кислота
Zn SO 4 → Zn 2+ + SO 4 2 -
Zn 2 + + HOH ⇄ ZnOH + + H +

Задание. Определите реакцию среды водных растворов солей. Таблица № 2
III ряд
№
II ряд
I ряд
KCl
NaNO 2
Li 2 SO 4
1.
Н
Н
Щ
Na 2 SO 3
2.
CuSO 4
FeCl 3
Щ
К
К
3.
KI
KMnO 4
K 3 PO 4
Щ
Н
Н
NH 4 NO 3
LiNO 3
NaClO 4
4.
Н
К
Н
Na 2 SiO 3
K 2 S
5.
NaNO 3
Щ
Щ
Н
н -нейтральная; к – кислотная; щ - щелочная
 7) гидролиз по аниону слабой кислотой Сильным основанием гидролиз по катиону 2. кислотная ( pH сильной кислотой Слабым основанием 3. нейтральная среда ( pH = 7) не подверга-ются гидро-лизу Сильным основанием сильная кислотой ? гидролиз по катиону и аниону слабой кислотой 4. Слабым основанием " width="640"
7) гидролиз по аниону слабой кислотой Сильным основанием гидролиз по катиону 2. кислотная ( pH сильной кислотой Слабым основанием 3. нейтральная среда ( pH = 7) не подверга-ются гидро-лизу Сильным основанием сильная кислотой ? гидролиз по катиону и аниону слабой кислотой 4. Слабым основанием " width="640"
Гидролиз солей
№
Соли, образованные
Реакция среды
Тип гидролиза
1.
Щелочная ( pH 7)
гидролиз по аниону
слабой кислотой
Сильным основанием
гидролиз по катиону
2.
кислотная ( pH
сильной кислотой
Слабым основанием
3.
нейтральная среда ( pH = 7)
не подверга-ются гидро-лизу
Сильным основанием
сильная кислотой
?
гидролиз по
катиону и
аниону
слабой кислотой
4.
Слабым основанием

Готовимся к ЕГЭ
1. Установите соответствие:
Формула соли Тип гидролиза
1. FeCl 2 А. по катиону
2. Ba(NO 3 ) 2 Б. по аниону
3. KF В. не гидролизуется
4. Na 3 PO 4
Ответ:
1А;
2В;
3Б;
4Б

Готовимся к ЕГЭ
2. Установите соответствие:
Формула соли Среда раствора
1. K 2 SO 4 А. кислотная
2. Li 2 CO 3 Б. щелочная
3. NH 4 Br В. нейтральная
4. CrCl 3
Ответ:
1В;
2Б;
3А;
4А
 7 3. CuCl 2 В. pH = 7 4. NaCl Ответ: 1Б; 2В; 3А; 4В " width="640"
7 3. CuCl 2 В. pH = 7 4. NaCl Ответ: 1Б; 2В; 3А; 4В " width="640"
Готовимся к ЕГЭ
3. Установите соответствие:
Формула соли Значение pH
1. K 2 SiO 3 А. pH
2. LiNO 3 Б. pH 7
3. CuCl 2 В. pH = 7
4. NaCl
Ответ:
1Б;
2В;
3А;
4В

 7) гидролиз по аниону слабой кислотой Сильным основанием кислотная ( pH 2. Слабым основанием гидролиз по катиону сильной кислотой нейтральная среда ( pH = 7) сильная кислотой Сильным основанием 3. Не подвергаются гидролизу " width="640"
7) гидролиз по аниону слабой кислотой Сильным основанием кислотная ( pH 2. Слабым основанием гидролиз по катиону сильной кислотой нейтральная среда ( pH = 7) сильная кислотой Сильным основанием 3. Не подвергаются гидролизу " width="640"
- Гидролиз - взаимодействие органических и неорганических веществ с водой.
- Гидролиз соли – это химическая реакция обмена соли с водой , в результате которой ионы слабого электролита, входящие в состав соли, соединяются с составными частями воды : H + и OH - .
№
Соли, образованные
Реакция среды, pH
Тип гидролиза
1.
щелочная ( pH 7)
гидролиз по аниону
слабой кислотой
Сильным основанием
кислотная ( pH
2.
Слабым основанием
гидролиз по катиону
сильной кислотой
нейтральная среда ( pH = 7)
сильная кислотой
Сильным основанием
3.
Не подвергаются гидролизу














 [OH – ] [H+] pH =7 pH pH 7 " width="640"
[OH – ] [H+] pH =7 pH pH 7 " width="640"


 7) гидролиз по аниону слабой кислотой Сильным основанием кислотная ( pH 2. Слабым основанием гидролиз по катиону сильной кислотой нейтральная среда ( pH = 7) не подвергаются гидролизу Сильным основанием 3. сильная кислотой " width="640"
7) гидролиз по аниону слабой кислотой Сильным основанием кислотная ( pH 2. Слабым основанием гидролиз по катиону сильной кислотой нейтральная среда ( pH = 7) не подвергаются гидролизу Сильным основанием 3. сильная кислотой " width="640"
 7 2 Na + +CO 3 2 - +HOH Na + + Н CO 3 - n +Na + +OH - Na 2 CO 3 +HOH NaHCO 3 +NaOH K 2 S 2K + +S 2 – S 2 - +HOH HS - +OH - 2K + +S 2 - +HOH K + +HS - +K + +OH - K 2 S+H 2 O KHS+KOH " width="640"
7 2 Na + +CO 3 2 - +HOH Na + + Н CO 3 - n +Na + +OH - Na 2 CO 3 +HOH NaHCO 3 +NaOH K 2 S 2K + +S 2 – S 2 - +HOH HS - +OH - 2K + +S 2 - +HOH K + +HS - +K + +OH - K 2 S+H 2 O KHS+KOH " width="640"


![В) гидролиз соли образованной слабым основанием и слабой кислотой CH 3 COONH 4 CH 3 COO - + NH 4 + CH 3 COO +HOHCH 3 COOH+OH - NH 4 + + HOH NH 4 OH + H + [OH] = [H] pH=7- среда нейтральная](https://fsd.multiurok.ru/html/2023/08/09/s_64d359a5c18d6/img15.jpg)

 7 32 Кислотная pH розовая бесцветная красная ZnSO 4 46 Na 2 SO 4 фиолетовая оранжевая бесцветная Нейтральная pH = 7 " width="640"
7 32 Кислотная pH розовая бесцветная красная ZnSO 4 46 Na 2 SO 4 фиолетовая оранжевая бесцветная Нейтральная pH = 7 " width="640"




 7) гидролиз по аниону слабой кислотой Сильным основанием гидролиз по катиону 2. кислотная ( pH сильной кислотой Слабым основанием 3. нейтральная среда ( pH = 7) не подверга-ются гидро-лизу Сильным основанием сильная кислотой ? гидролиз по катиону и аниону слабой кислотой 4. Слабым основанием " width="640"
7) гидролиз по аниону слабой кислотой Сильным основанием гидролиз по катиону 2. кислотная ( pH сильной кислотой Слабым основанием 3. нейтральная среда ( pH = 7) не подверга-ются гидро-лизу Сильным основанием сильная кислотой ? гидролиз по катиону и аниону слабой кислотой 4. Слабым основанием " width="640"


 7 3. CuCl 2 В. pH = 7 4. NaCl Ответ: 1Б; 2В; 3А; 4В " width="640"
7 3. CuCl 2 В. pH = 7 4. NaCl Ответ: 1Б; 2В; 3А; 4В " width="640"

 7) гидролиз по аниону слабой кислотой Сильным основанием кислотная ( pH 2. Слабым основанием гидролиз по катиону сильной кислотой нейтральная среда ( pH = 7) сильная кислотой Сильным основанием 3. Не подвергаются гидролизу " width="640"
7) гидролиз по аниону слабой кислотой Сильным основанием кислотная ( pH 2. Слабым основанием гидролиз по катиону сильной кислотой нейтральная среда ( pH = 7) сильная кислотой Сильным основанием 3. Не подвергаются гидролизу " width="640"










