ГБУ ОО ЗО "КОНСТАНТИНОВСКАЯ СОШ №2 ИМ. ГЕРОЯ СОВЕТСКОГО СОЮЗА П.Т.ОДИНЦА" Г.О.МЕЛИТОПОЛЬ
Инструктивные карты для практических работ
Предмет: химия.
Возраст детей: 8 класс
Разработала учитель химии
Левченко Светлана Петровна.
с.Константиновка,2024
Практическая работа № 1
Тема. «Правила работы в лаборатории и приемы обращения
с лабораторным оборудованием»
Цель работы: изучение правил техники безопасности при работе с веществами и оборудованием.
Оборудование: инструктивная карта, пробирки, химический стакан, колба, лабораторный штатив, мерный цилиндр, спиртовка, спички.
Ход работы
1. Изучите правила техники безопасности:
А) правила поведения в химическом кабинете
Б) правила техники безопасности при проведении химического эксперимента
В) правила работы со спиртовкой и правила нагревания
Г) правила обращения с химическими веществами и растворами
2. Выполните задания.
Опыт 1. Работа со штативом. Знакомство с химической посудой.
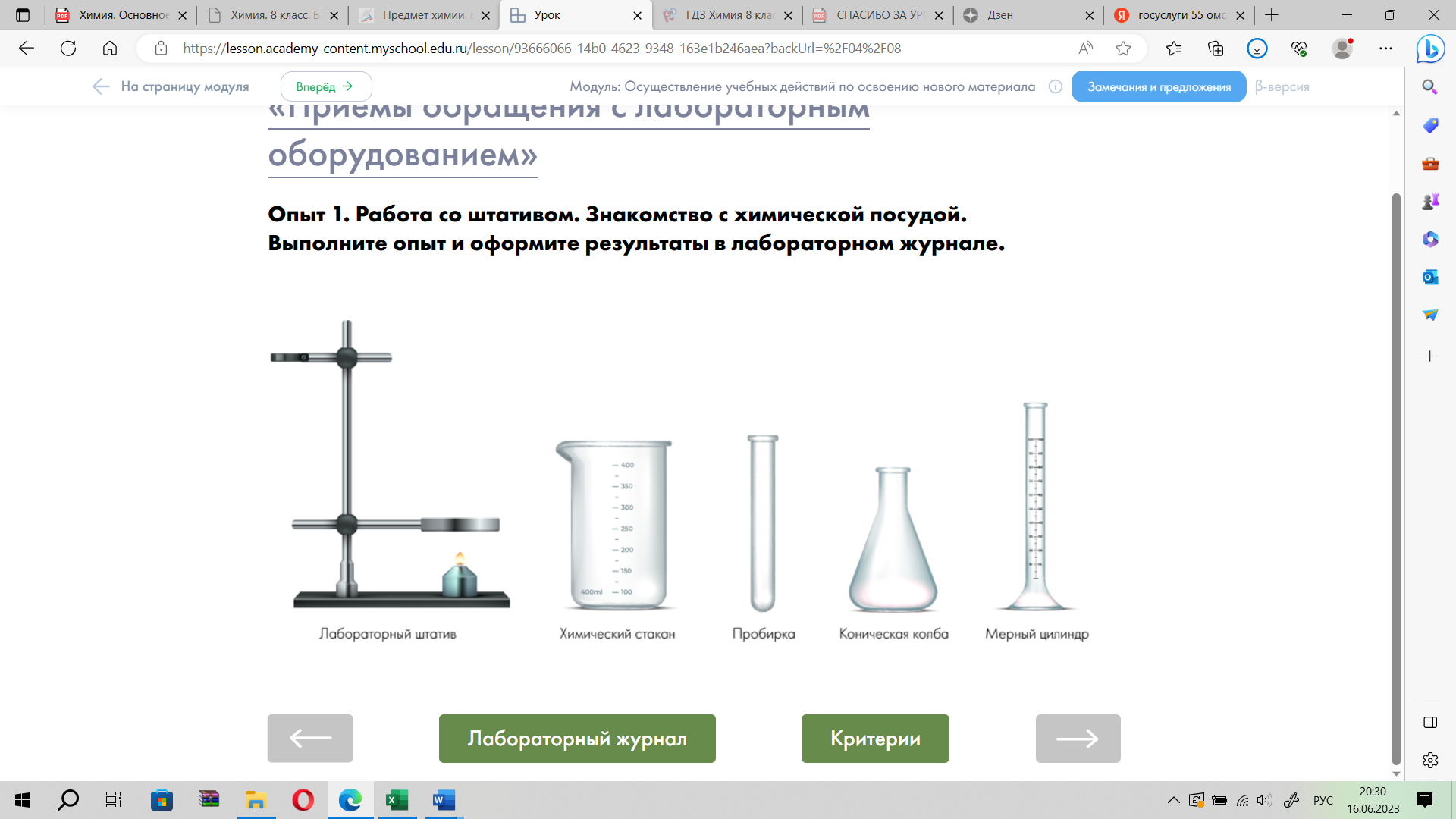
Задание 1. Начертите в тетради для практических работ таблицу и оформите в ней свои наблюдения и выводы по результатам опыта №1. В качестве подсказки используйте пояснения и вопросы таблицы
| Название опыта | Наблюдения и рисунки | Объяснения наблюдений | Выводы |
| Опыт 1. Работа со штативом. Знакомство с химической посуды. | Нарисуйте штатив и закрепленные на нем лапку, кольцо и муфты. Сделайте подписи к рисунку. Зарисуйте пробирку, колбу, химический стакан. Подпишите названия. | 1) С помощью чего на штативе закрепляются лапка и кольцо? 2) Как правильно закреплять пробирку в лапке? 3) Из какого материала сделаны пробирки и колбы? | 1) Для чего используют лабораторный штатив? 2) Почему нельзя закручивать винт лапки при закреплении пробирки и колбы? |
Опыт 2. Работа со спиртовкой.
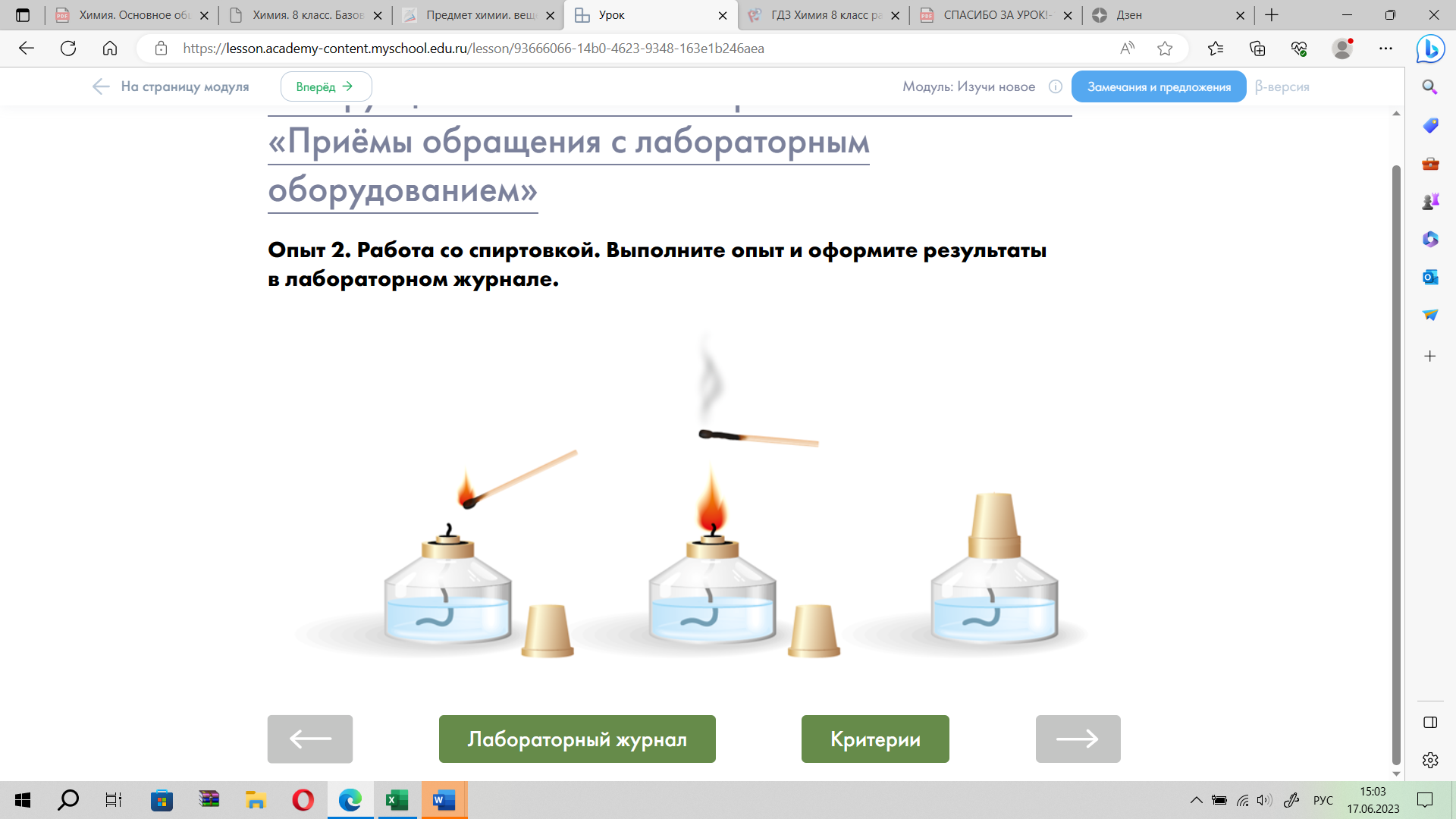
Задание 2. Начертите в тетради для практических работ таблицу и оформите в ней свои наблюдения и выводы по результатам опыта №2. В качестве подсказки используй пояснения и вопросы таблицы.
| Название опыта | Наблюдения и рисунки | Объяснения наблюдений | Выводы |
| Опыт 2. Работа со спиртовкой. | Нарисуйте спиртовку. Сделайте подписи к рисунку.
| 1) С помощью чего можно зажигать спиртовку? 2) Как правильно гасить спиртовку?
| Для чего используют спиртовку?
|
Опыт 3. Нагревание пламенем.
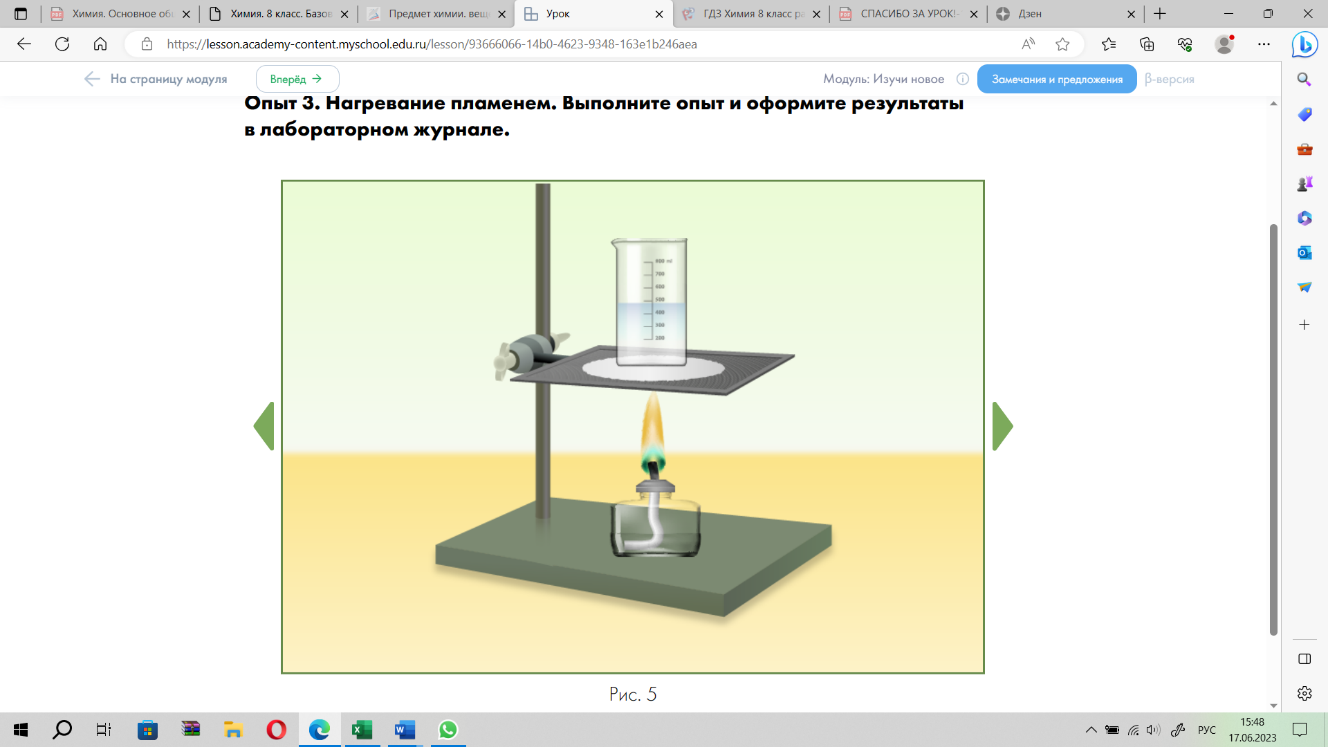
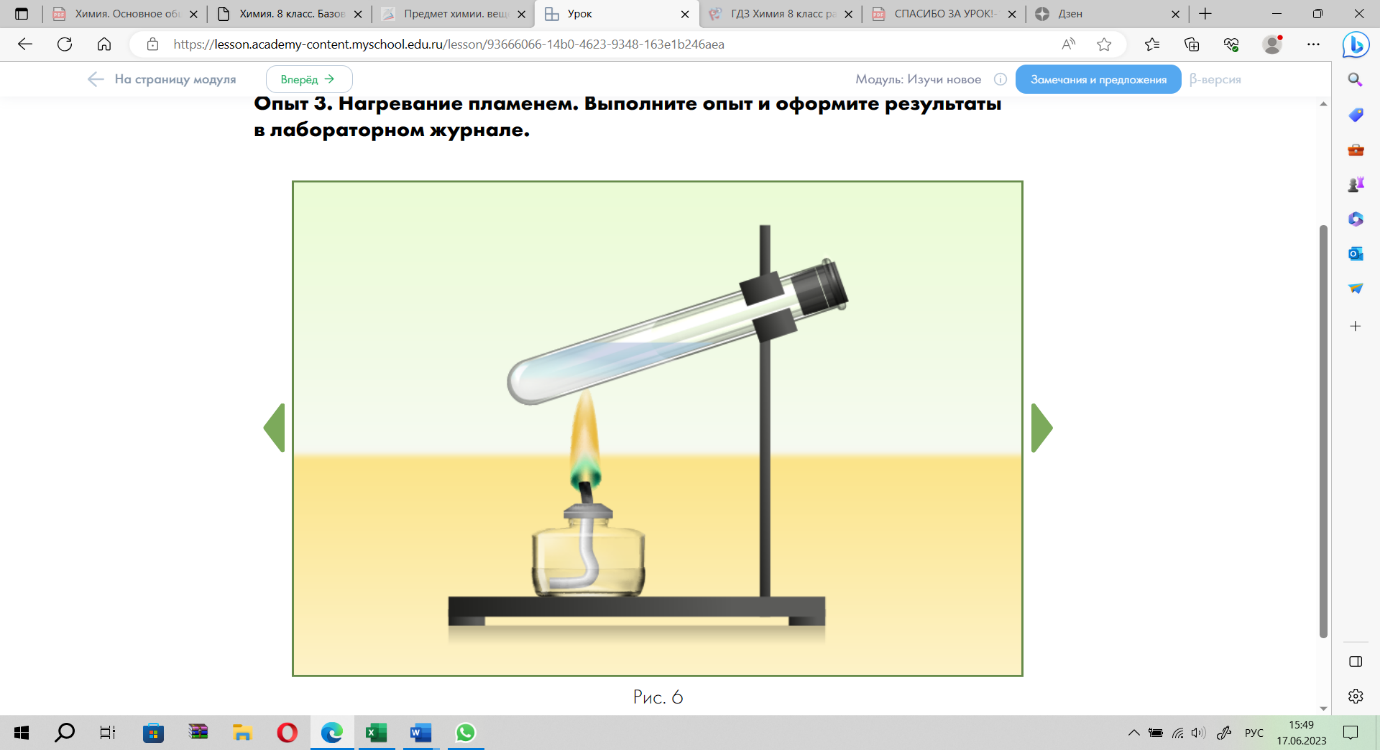
Задание 3. Начертите в тетради для практических работ таблицу и оформите в ней свои наблюдения и выводы по результатам опыта №3. В качестве подсказки используйте пояснения и вопросы таблицы.
| Название опыта | Наблюдения и рисунки | Объяснения наблюдений | Выводы |
| Опыт 3. Нагревание пламенем. | Нарисуйте строение пламени. Обозначьте зоны с различной температурой пламени и подпишите значение температуры | 1) Как определить, что стеклянная посуда прогрета? 2) В какой части пробирки необходимо проводить нагревание? 3) С помощью чего держат пробирку? | 1) Почему стеклянную посуду предварительно необходимо прогреть? 2) Почему при нагревании пробирку необходимо держать в сторону от себя? |
Задание 4. Выберите правильные ответы.
1) В химической лаборатории можно:
А) смешивать любые вещества
Б) убирать рабочее место по окончанию работы
В) разговаривать
Г) работать только в присутствии учителя
Д) принимать пищу
Е) брать вещества и оборудование с незадействованных на данный момент рабочих мест
2) Что можно делать с веществами в лаборатории?
А) высыпать излишки веществ обратно в банки
Б) пробовать вещества на вкус
В) помещать вещества в лабораторную посуду руками
Г) перемешивать вещества при помощи стеклянной палочки
Д) нагревать специальную посуду с веществами
Е) помещать вещества при помощи шпателя в лабораторную посуду
Ж) определять запах веществ
3) Как правильно обращаться при работе со спиртовками?
А) перед зажиганием спиртовки необходимо убедиться в ее исправности
Б) чтобы погасить спиртовку, можно использовать колпачок, а можно задуть пламя
В) спиртовки можно зажигать одну от другой
Г) горящие спиртовки можно переносить с одной парты на другую
Д) гасить спиртовки можно только при помощи специального колпачка
Е) спиртовки нужно зажигать спичками
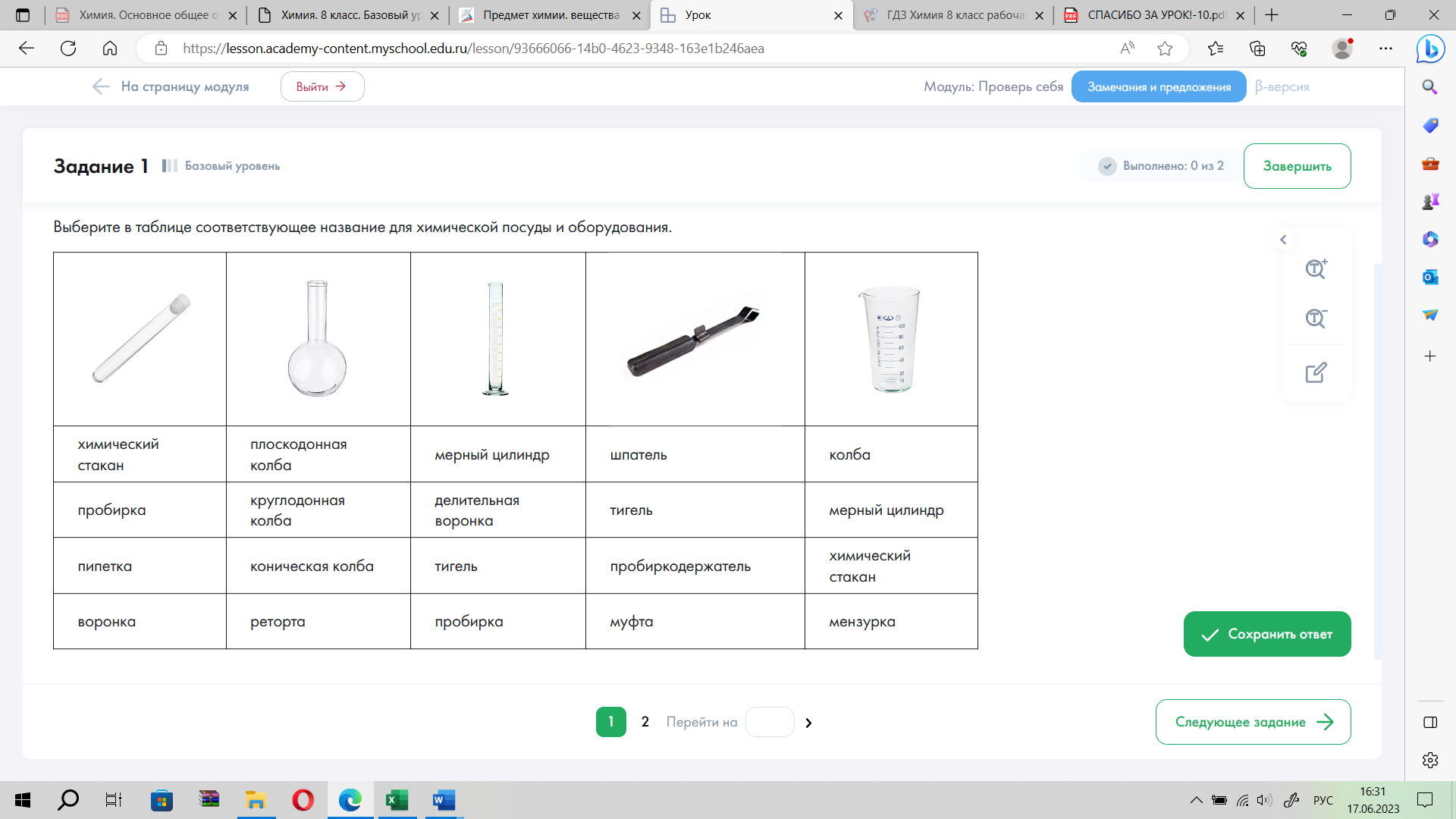
Задание 5. Выберите в таблице соответствующее название для химической посуды и оборудования. Запишите в тетрадь.





5
4
3
1
2
Задание 6. Установите соответствие между названием химической посуды или оборудования и возможным его назначением.
| Химическая посуда | Назначение |
| 1) пипетка 2) химический стакан 3) пробирка 4) шпатель | А) для проведения реакций в растворах Б) для отбора пробы жидкости В) для приготовления растворов Г) для отбора пробы твердого сыпучего вещества |
Задание 7. Оцените свою работу
Спасибо за работу!
Практическая работа №2
Тема: Разделение смесей.
Цель. Научиться разделять смеси на примере поваренной соли.; освоить методы фильтрования и выпаривания, закрепить знания о зависимости способов очистки веществ от свойств вещества, приобрести умения по очистке веществ.
Оборудование: поваренная соль, фильтровальная бумага, воронка, стеклянная палочка, держатель, стакан с водой, фарфоровая чашка., штатив.
.
Ход работы.
Правила техники безопасности. (прочитайте)
| 
|
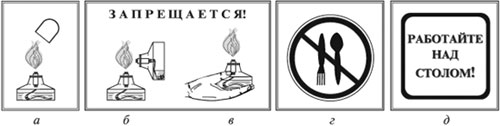
| Тушите спиртовку только колпачком (а).
Запрещается зажигать одну спиртовку с помощью другой (б).
Запрещается передавать спиртовку в зажженном виде (в).
Запрещается пробовать вещество на вкус (г).
Работу проводить только над столом (д) |
Работа со стеклом:
Помните, что горячее стекло по внешнему виду не отличается от холодного. Не прикасайтесь к горячей пробирке. Закрепляя пробирку в лапке штатива, не закручивайте сильно винт. При нагревании стекло расширяется и пробирка может треснуть
1. В химический стакан поместите 2-3 ложки загрязненной поваренной соли.
2. Налейте в тот же стакан воду так, чтобы стакан был заполнен приблизительно на ½ его объема.
3. Перемешайте стеклянной палочкой.
 .
.
4.Сложите фильтр. Для этого сверните его пополам и, не разворачивая, еще раз пополам. Разверните полученный конус так, чтобы с одной стороны был один слой бумаги, а с другой – три слоя. Вложите фильтр в воронку
5. Проверьте правильность положения фильтра в воронке: он должен плотно прилегать к стенкам воронки и не доходить до ее края примерно на 0,5 см.
6. Смочите фильтр водой.
7. Установите воронку в кольце штатива. Стебель воронки должен касаться стенки стакана – приемника. 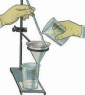
8. Держите стеклянную палочку так, чтобы ее конец был направлен на тройной слой фильтровальной бумаги.
9. Аккуратно наливайте фильтруемую жидкость по палочке. Следите за тем, чтобы жидкость не доходила до края фильтра.
10.Перелейте фильтрат в фарфоровую чашку для выпаривания.
10.Поставьте чашку на кольцо штатива. 
11.Нагрейте чашку в пламени спиртовки, после появления в чашке кристаллов соли нагревание прекратите. Полученную после полного испарения воды соль сравните с исходной.
Оформление результата опыта в тетради :
| Опыт | Что наблюдали? | Вывод |
|
1. Растворение смеси в воде. Отстаивание |
|
|
|
2. Фильтрование. |
|
|
|
3. Выпаривание (кристаллизация) |
|
|
Вывод: (сформулируйте вывод из цели работы)
Практическая работа №3.
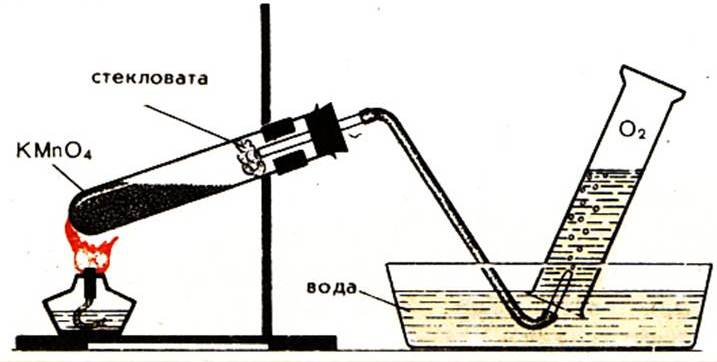
Тема. Получение кислорода и изучение его свойств.
Цели:
- знать лабораторный способ получения кислорода из перманганата калия KMnO4 и уметь писать уравнение реакции;
- знать физические свойства кислорода;
- знать способы собирания кислорода;
- знать качественную реакцию на кислород;
- знать одно химическое свойства кислорода и уметь писать уравнение реакции.
Приборы и оборудование: KMnO4 – перманганат калия KMnO4 (марганцовка), С – древесный уголь, известковая вода, пробка с газоотводной трубкой, лучинка, спиртовка, спички, колба, вата, пробирка, штатив лабораторный с лапкой или пробиркодержатель, халат химический, перчатки.
Правила техники безопасности. (прочитайте)
| 
|
| Тушите спиртовку только колпачком (а).
Запрещается зажигать одну спиртовку с помощью другой (б).
Запрещается передавать спиртовку в зажженном виде (в).
Запрещается пробовать вещество на вкус (г).
Работу проводить только над столом (д) |
Работа со спиртовкой:
Не переносите горящую спиртовку с места на место.
Гасите спиртовку только с помощью колпачка.
При нагревании не забудьте прогреть пробирку. Для этого пробирку, закрепленную в лапке штатива, медленно проведите сквозь пламя от донышка до отверстия и обратно. Эту операцию повторите несколько раз: чтобы стекло равномерно прогрелось. Признаком прогрева стекла можно считать исчезновение запотевания на стенках пробирки.
Дно пробирки должно находиться в верхней части пламени.
Дно пробирки не должно касаться фитиля.
Работа со стеклом:
Помните, что горячее стекло по внешнему виду не отличается от холодного. Не прикасайтесь к горячей пробирке. Закрепляя пробирку в лапке штатива, не закручивайте сильно винт. При нагревании стекло расширяется и пробирка может треснуть
ХОД РАБОТЫ.
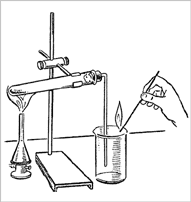
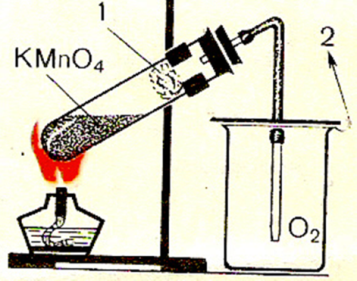
Опыт 1. Получите кислород разложением при нагревании перманганата калия KMnO4. Пронаблюдайте физические свойства кислорода. Соберите выделяющийся кислород двумя методами.
Получение кислорода методом вытеснения воздуха
1. Перманганат калия (КMnO4) поместите в сухую пробирку. У отверстия пробирки положите рыхлый комочек ваты.
2. Закройте пробирку пробкой с газоотводной трубкой, проверьте на герметичность (рис. 1).
| 
|
| Рис. 1.
Проверка прибора
на герметичность |
Укрепите прибор в лапке штатива.
Газоотводную трубку опустите в стакан, не касаясь дна, на расстоянии 2–3 мм (рис. 2).
| 
|
| Рис. 2.
Получение из перманганата калия кислорода
и собирание его методом вытеснения воздуха.
Обнаружение кислорода тлеющей лучинкой |
4. Подогрейте вещество в пробирке. (Помните правила техники безопасности.)
2. Получение кислорода методом вытеснения воды.
1. Пробирку заполните водой. Закройте пробирку большим пальцем и переверните ее вверх дном. В таком положении опустите руку с пробиркой в кристаллизатор с водой. Подведите к концу газоотводной трубки пробирку, не вынимая ее из воды (рис. 3).
| 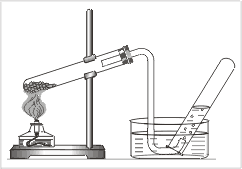
|
| Рис. 3.
Прибор для получения кислорода
и собирание его методом вытеснения воды |
2. Когда кислород вытеснит воду из пробирки, закройте ее большим пальцем и выньте из воды. Почему кислород можно собирать способом вытеснения воды?
Внимание! Выньте газоотводную трубку из кристаллизатора, не прекращая нагревать пробирку с КMnО4. Если этого не сделать, то воду перебросит в горячую пробирку. Почему?
Почему используются эти методы собирания газа?
Опыт 2. И в первом и во втором случае проведем качественную реакцию на кислород, внесите тлеющую лучину в сосуд с кислородом. Что происходит с лучиной? Что поддерживает кислород?
Кислород поддерживает горение — это свойство кислорода используется для его обнаружения
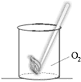
Опыт 3. Исследуйте химическое свойство кислорода взаимодействовать с углем при нагревании. Каким пламенем горит уголь в чистом кислороде? Какое образуется вещество в результате этой реакции? Как его определить?
При сгорании углерода образуется углекислый газ: С+О2= СО2
Добавим в колбу с газом известковую воду – она мутнеет.
Результаты работы оформите в таблицу:
| № | Что делали | Что наблюдали | Уравнения реакций, рисунок и вывод |
| 1 |
|
| 
Уравнение реакции: Вывод: |
| 2 |
|
|  Вывод: Вывод:
|
| 3 |
|
| 
Уравнение реакции: Вывод:
|
Общий вывод: кислород в лаборатории можно получить разложением _________. Кислород собирают методом _______. В результате горения простых веществ в кислороде образуются _________.
Приведите рабочее место в порядок : разберите прибор, расставьте посуду и принадлежности на свои места.
Сдайте тетради на проверку.
Практическая работа № 4.
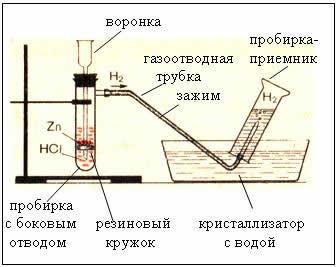
Тема: «Получение и собирание водорода, изучение его свойств»
Цель: научиться получать, собирать водород; изучить физические и химические свойства водорода.
Оборудование:
лабораторный штатив с лапкой, держатель для пробирок, штатив для пробирок, ложка-дозатор, фильтровальная бумага, спиртовка, спички, автоматический прибор Кирюшкина для получения газов, 3 пробирки, кристаллизатор с водой.
Реактивы: гранулы цинка, соляная кислота (разб.), оксид меди (II).
Правила техники безопасности. (прочитайте)

| Тушите спиртовку только колпачком (а).
Запрещается зажигать одну спиртовку с помощью другой (б).
Запрещается передавать спиртовку в зажженном виде (в).
Запрещается пробовать вещество на вкус (г).
Работу проводить только над столом (д) |
Работа со спиртовкой:
Не переносите горящую спиртовку с места на место.
Гасите спиртовку только с помощью колпачка.
При нагревании не забудьте прогреть пробирку. Для этого пробирку, закрепленную в лапке штатива, медленно проведите сквозь пламя от донышка до отверстия и обратно. Эту операцию повторите несколько раз: чтобы стекло равномерно прогрелось. Признаком прогрева стекла можно считать исчезновение запотевания на стенках пробирки.
Дно пробирки должно находиться в верхней части пламени.
Дно пробирки не должно касаться фитиля.
Работа со стеклом:
Помните, что горячее стекло по внешнему виду не отличается от холодного. Не прикасайтесь к горячей пробирке. Закрепляя пробирку в лапке штатива, не закручивайте сильно винт. При нагревании стекло расширяется и пробирка может треснуть
Ход работы.
В пробирку с газоотводной трубкой опустите 1-2 гранулы цинка и налейте соляной кислоты (чтобы кислота покрывала цинк)
Соберите водород методом вытеснения воздуха.
Проверка водорода на чистоту. Для опыта используем водород, собранный вытеснением воздуха. Поднесите её к пламени спиртовки. Если раздавшийся звук напоминает сухой треск, то значит водород чистый. А если звук резкий, «тявкающий», то водород смешан с воздухом.
Поднесите горящую лучинку к отверстию газоотводной трубки. Обратите внимание на цвет пламени.
Оформите отчет о работе в виде таблицы. Сделайте рисунки с обозначениями к ним. Запишите наблюдения. Составьте уравнения реакций. Сделайте выводы о свойствах водорода.
Сделайте вывод к практической работе.
| Химический эксперимент | что наблюдаем | уравнения химических реакций: |
| 
| В пробирке происходит… | Водород в лаборатории можно получить взаимодействии цинка с соляной кислотой
Zn+ HCl = ? + ?
|
| 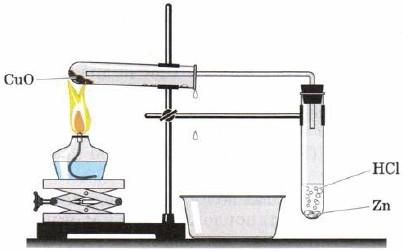 Взаимодействие оксида меди (II) с водородом Взаимодействие оксида меди (II) с водородом
| Появление металлической меди и капелек воды | CuO + H2 =? + ? Взаимодействие водорода с простыми веществами: Н2 + Na = ? Н2 + S = ? Н2 + Ca = ? Н2 + N2 = NH3 |
| 
| Тлеющая лучинка… | Водород … поддерживает … горение
Н2 + ? = ? |
Выводы:
1.
2.
Задача: Какую массу гидрида кальция необходимо взять для растворения его в воде, если необходимо получить 6 л водорода?
Практическая работа № 5
Тема: Приготовление растворов с определенной массовой долей растворенного вещества
Цель: Научиться выполнять расчеты массовой доли растворенного вещества в растворе
и готовить растворы с определенной массовой долей растворенного вещества.
Оборудование и реактивы: мерный цилиндр, коническая колба, стеклянная палочка, рычажные весы, разновесы, шпатель, химические стаканы, хлорид натрия, сахар, вода.
Правила техники безопасности
1.Осторожно обращайтесь с химическим оборудованием!
2.Пользуйтесь чистой и пригодной для работы посудой.
3.Запрещается:
-пробовать вещества на вкус
-брать вещества руками
-оставлять неубранными рассыпанные или разлитые реактивы
-оставлять открытыми склянки с жидкостямии банки с сухими веществами
4.Работу проводить только над столом
5. Взвешиваемое вещество кладите на левую чашку весов, разновесы на правую. (Для левшей – на правую чашку кладут вещество, на левую – разновесы.) Разновесы брать только пинцетом и при снятии с весов класть сразу в те гнезда футляра, из которых они были взяты.После взвешивания чашка весов должна оставаться чистой.
Жидкости на весах не взвешивают!
Ход работы:
Опыт 1: Приготовление раствора сахара и расчёт его массовой доли в растворе
Отмерьте мерным цилиндром 50 мл дистиллированной воды и влейте её в коническую колбу.
Чайную ложку сахарного песка (или два кусочка) взвесьте на лабораторных весах, затем поместите его в колбу с водой и перемешивайте стеклянной палочкой до полного растворения.
Теперь приступайте к расчётной части. Вначале рассчитайте массовую долю сахара в растворе. Необходимые данные у вас есть: масса сахара, объём воды, плотность воды примите равной 1 г/мл.
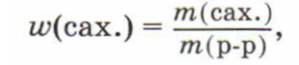 Х100%
Х100%
m(p-p) = m(cax.) + m(вода),
m(вода) = V(вода) • р(вода).
Опыт 2. Приготовление раствора с заданной массовой долей растворённого вещества.
В кулинарных книгах и пособиях по домашнему консервированию нередко предлагается приготовить раствор с заданной массовой долей растворенного вещества. Как это сделать?
| Вариант | Растворенное вещество | Раствор 1 | Раствор 2 | Раствор 3 |
| 1 | Хлорид натрия | 50 г 10 % - ный | 6 % - ный | 8 % - ный |
| 2 | Хлорид натрия | 30 г 10 % - ный | 4 % - ный | 7 % - ный |
Приготовление раствора 1: Рассчитайте массу твёрдого вещества и воды, необходимых для приготовления раствора 1. Зная, что плотность воды равна 1 г/мл, рассчитайте объём воды, необходимый для приготовления раствора. Взвесьте твёрдое вещество в соответствии с рассчитанной массой и перенесите в химический стакан. Мерным цилиндром отмерьте вычисленный объём воды и прилейте его к веществу в химическом стакане. Перемешивая содержимое стакана стеклянной палочкой, добейтесь полного растворения вещества в воде. Приготовленный раствор отдайте учителю.
Приготовление раствора 2: Рассчитайте массу воды, которую необходимо добавить к раствору l, чтобы получить раствор 2 меньшей концентрации. Рассчитайте объём воды. Отмерьте воду с помощью мерного цилиндра и добавьте в раствор 1. Какова масса раствора 2?
Приготовление раствора 3: Рассчитайте массу твёрдого вещества, которое следует добавить к раствору 2, чтобы получить раствор З большей концентрации. На весах взвесьте необходимую массу вещества, добавьте его в раствор 2 и перемешайте стеклянной палочкой до полного растворения. Какова масса раствора 3?
Вывод:
Практическая работа № 6
Тема. Решение экспериментальных задач по теме «Основные классы неорганических соединений»
Цель работы: изучить химические свойства основных классов неорганических соединений.
Реактивы и оборудование: штатив с пробирками, держатель для пробирок, спиртовка, спички, растворы индикаторов (фенолфталеин, метилоранж), растворы NaOH, H2SO4, CuSO4, гранулы цинка.
Правила техники безопасности (прочитайте)
1.Осторожно обращайтесь с химическим оборудованием!
2.Пользуйтесь чистой и пригодной для работы посудой.
3. Запрещается:
пробовать вещества на вкус
брать вещества руками
оставлять неубранными рассыпанные или разлитые реактивы
оставлять открытыми склянки с жидкостями банки с сухими веществами
4.Работу проводить только над столом
5.Отставьте в сторону предметы (тетрадь для практических работ) и позовите учителя.
6.Зажжённую спиртовку нельзя переносить с места на место, нельзя также зажигать одну спиртовку непосредственно от другой. Для зажигания спиртовки пользуйтесь спичками.
гасить спиртовку можно только одним способом – накрыть пламя фитиля колпачком. Колпачок должен находиться всегда под рукой.
7.Кислоты и щелочи – едкие вещества. Разрушают и раздражают кожу, слизистые оболочки.
наливать кислоту надо так, чтобы при наклоне склянки этикетка, во избежание её порчи, оказывалась сверху
Первая помощь при попадании кислоты на кожу рук:
Попавшие на кожу капли кислоты стряхните и тщательно смойте большим количеством воды, а затем обработайте поражённую поверхность 2% раствором питьевой соды.
Ход работы
Опыт 1. Действие индикаторов на растворы кислот и щелочей
А) В пробирку налейте 1 мл раствора гидроксида натрия NaOH, добавьте 2-3 капли раствора индикатора фенолфталеина. Как изменился цвет раствора?
Б) В пробирку налейте 1 мл раствора серной кислоты H2SO4, добавьте 2-3 капли раствора индикатора метилоранжа. Как изменился цвет раствора?
В) пробирку налейте 1 мл воды H2O, добавьте 2-3 капли раствора индикатора метилоранжа. Как изменился цвет индикатора?
Опыт 2. Реакция нейтрализации
В пробирку налейте 1 мл раствора гидроксида натрия NaOH., добавьте 2-3 капли индикатора фенолфталеина, затем прилейте 1 мл раствора серной кислоты H2SO4.
Запишите уравнение реакции. Сделайте вывод, какие вещества образуются при взаимодействии кислоты и щелочи.
Опыт 3. Получение сульфата цинка
В пробирку с гранулой цинка добавьте 1 мл раствора серной кислоты H2SO4.
Запишите уравнение реакции. Сделайте вывод, какой газ можно получить взаимодействием кислоты и активного металла.
Опыт 4. Получение и свойства гидроксида меди (II)
В пробирку налейте 1 мл раствора сульфата меди (II) CuSO4, добавьте 1 мл раствора гидроксида натрия NaOH.
Отметьте цвет выпавшего осадка. Запишите уравнение реакции. Сделайте вывод, взаимодействием каких веществ можно получить нерастворимое в воде основание
Результаты выполнения работы записывают в таблицу:
| № | Что делали | Что наблюдали | Выводы |
| 1.
| А)
Б)
В) |
|
|
|
2.
|
|
|
|
| 3 |
|
|
|
| 4. |
|
|
|













 .
.







 Вывод:
Вывод:

 Взаимодействие оксида меди (II) с водородом
Взаимодействие оксида меди (II) с водородом










