| МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ федеральное государственное АВТОНОМНОЕ образовательное учреждение высшего образования «Национальный исследовательский ядерный университет «МИФИ» |
| Московский областной политехнический колледж– филиал федерального государственного автономного образовательного учреждения высшего образования «Национальный исследовательский ядерный университет «МИФИ» (МОПК НИЯУ МИФИ) |
МЕТОДИЧЕСКИЕ УКАЗАНИЯ К ВЫПОЛНЕНИЮ ЛАБОРАТОРНЫХ РАБОТ ПО УЧЕБНОЙ ДИСЦИПЛИНЕ ОУП.08 (базовый уровень)
ХИМИЯ
по специальности
среднего профессионального образования
15.02.16 «Технология машиностроения»
г. Электросталь, 2023г
CОДЕРЖАНИЕ
1.Введение..........................................................................................................3
2.Основные сведения о работе в химической лаборатории..........................4
2.1.Порядок выполнения лабораторных работ...............................................4
2.2. Меры предосторожности при выполнении лабораторных работ..........4
2.3. Необходимые меры при несчастных случаях..........................................6
3.Лабораторные работы.................................................................................... 6
4. Приложение………………………………………………………………...19
5.Информационное обеспечение обучения…………………………………20
1.Введение
Дисциплина «Химия» в системе СПО занимает важное место, являясь одной из дисциплин, формирующих научно-теоретическую и
экспериментальную основу профессиональной компетентности.
Границы химии на сегодня необозримо широки, а задача ее познания
студентами в полном объеме невыполнима. Поэтому важно произвести
оптимальный отбор разделов, в результате изучения которых на основе общих закономерностей будет сформирована химическая картина мира.
Овладение химией немыслимо без лабораторного эксперимента, так как
здесь приобретаются навыки работы с веществами. Учебный химический эксперимент является важной формой повышения эффективности учебно-познавательной деятельности учащихся.
Выполнению лабораторно-практических работ должно предшествовать детальное повторение обучающимися соответствующего раздела теоретического курса, ознакомление с ходом работы. При выполнении лабораторных работ обучающийся должен научиться вдумчивому отношению к наблюдаемым явлениям, понимать их химическую сущность, уметь выразить ее через схемы протекающих реакций. Эти занятия способствуют развитию навыков у студентов по практическому применению усвоенного ими материала лекций и учебников.
Настоящий практикум предназначен для использования обучающимися на 1 курсе при домашней подготовке к выполнению лабораторных работ и в процессе выполнения их в лаборатории.
Лабораторные работы знакомят со способами получения органических и неорганических веществ и с их свойствами.
Методики лабораторных работ представлены в виде таблиц с конкретными заданиями и вопросами, что существенно облегчает работу обучающихся и преподавателя. В теоретической части каждой работы даны задания для выполнения домашних работ, включающие решение расчетных задач; список вопросов для самостоятельной проверки знаний. Использование данного практикума в учебном процессе поможет обучающимся усвоить основные понятия, законы и теории химии, приобрести навыки химических расчетов, необходимые для дальнейшего обучения и формирования профессиональной компетентности.
2.Основные сведения о работе в химической
лаборатории.
2.1 Порядок выполнения лабораторных работ.
При проведении лабораторных работ необходимо выполнить следующее:
1. Внимательно ознакомиться с содержанием темы практического занятия.
2. Выполнять каждую работу индивидуально, на своем рабочем месте.
3. Внимательно следить за ходом процесса, не отходя от рабочего места во время работы.
4. Не держать на лабораторном столе вещи, не имеющие отношения к данной лабораторной работе, соблюдать на рабочем месте образцовую чистоту и порядок.
5. Строго соблюдать правила техники безопасности.
2.2 Меры предосторожности при выполнении работ.
1. При выполнении каждого опыта сначала необходимо внимательно ознакомиться с описанием постановки опыта, а затем приступать к его выполнению.
2. Все опыты с ядовитыми и довольно пахнущими веществами проводить под тягой.
3. При нагревании пробирок следить за направлением их отверстий, не направлять отверстия пробирок на себя, работающих рядом или напротив.
4. Для определения запаха какого-либо газа или другого вещества не наклоняться над сосудом, не подносить его к лицу и не вдыхать полной грудью, а осторожно направить к себе поток воздуха от сосуда легким движением руки.
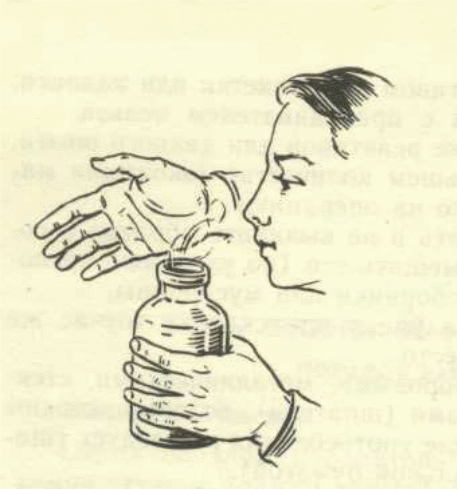
5. Особую осторожность следует проявлять при работе с газами, дающими взрывчатые смеси с воздухом (метан, этилен, ацетилен), а так же при работе с крепкими (концентрированными) кислотами и щелочами.
6. Химическая посуда и обращение с нею
Основным требованием, предъявляемым к стеклянной посуде, является
ее химическая и термическая устойчивость. Химическая устойчивость - это
свойство стекла противостоять разрушающему действию растворов щелочей,
кислот и других веществ. Термическая устойчивость - способность посуды
выдерживать резкие колебания температуры. Лучшим стеклом считается пирекс, оно обладает термической и химической устойчивостью, имеет малый коэффициент расширения.
Пирексное стекло содержит 80% оксида кремния (IV). Температура размягчения его +620 °С. Для проведения опытов при высоких температурах
используют кварцевую посуду. Кварцевое стекло содержит 99,95% оксида
кремния (IV), температура размягчения его +1650 °С.
Лабораторную посуду изготовляют в основном из стекла типов ТУ(термически устойчивое), ХУ-1 и ХУ-2 (химически устойчивое). Содержание
оксида кремния (IV) в обычном лабораторном стекле составляют ~ 70%.
На рисунках представлена стеклянная посуда, применяемая в лабораторной практике.


2.3 Необходимые меры при несчастных случаях.
1. При попадании на кожу кислоты тщательно промывают пораженный участок водой и нейтрализуют раствором бикарбоната.
2. При попадании на кожу щелочи промывают пораженный участок водой, а затем нейтрализуют разбавленной уксусной или лимонной кислотой.
3. Если на кожу попал бром, фенол и другие вещества, раздражающие кожный покров, то смывают органическими растворителями (спирт, эфир).
4. При отравлении парами брома, хлора вдыхают ртом пары разбавленного нашатырного спирта.
5. При ожоге промывают обожженные места 10%-ным раствором марганцовокислого калия.
6. При возникновении пожара, сохраняя спокойствие, выключают во всей лаборатории газ, электронагревательные приборы, засыпают песком или покрывают войлочным одеялом очаг пожара. Большое пламя гасят огнетушителями.
3.Лаборатнорные работы.
Лабораторная работа №1
Основное классы неорганических соединений .
Реактивы: штатив с пробирками, растворы: нитрата свинца, йодида калия, серной и соляной кислот, хлорида бария, карбоната натрия, гидроксида натрия, сульфата хрома.
Опыт №1. Получение солей сульфата свинца и йодида свинца.
Пользуясь имеющимися растворами солей получите: сульфат и йодид свинца.
Проделайте реакции. Отметьте наблюдения. Сделайте вывод. Уравнения реакций запишите в молекулярной и ионной формах.
Pb(NO3)2 + H2 SO4 → PbSO₄↓ + HNO₃
Pb(NO3)2 + KI → PbI₂↓ + KNO₃
Опыт №2. Получение гидроксида хрома и изучение его свойств.
Поместите в пробирку 1-2 мл раствора сульфата хрома и добавьте столько же раствора щелочи до образования гидроксида хрома. Отметьте наблюдения.
Полученный осадок вместе с раствором разделите в две пробирки. В одну из них прилейте несколько капель раствора серной кислоты, в другую - гидроксида натрия до растворения осадка. Отметьте наблюдения.
Напишите уравнения реакций в молекулярной ионной формах:
а) образование гидроксида хрома
Cr2(SO4)3 + NaOH → Cr(OH)₃↓ + +Na₂SO₄
б) взаимодействие гидроксида хрома с соляной кислотой и с избытком гидроксида натрия.
Cr(OH)₃+ HCl → CrCl₃ + H₂O
Cr(OH)₃+ NaOH → Na₃[Cr(OH)₆]
Сделайте вывод о свойствах гидроксида хрома.
Опыт №3. Случаи течения реакций до конца.
Пользуясь таблицей растворимости солей и оснований в воде, подберите из имеющихся растворов солей, кислот, щелочей такие растворы которые при взаимодействии между собой привели бы:
а) к образованию осадка
BaCl2 + H2SO4 → BaSO₄↓ + HCl
б) к выделению газообразного вещества
Na2 CО3 + HCl → NaCl + CO₂↑ + H₂O
в) к образованию малодиссоциирующего вещества.
NaOH + H2SO4 → Na₂SO₄ + H₂O
или
NaOH + HCl → NaCl + H₂O
Проделайте эти реакции. Отметьте наблюдения. Напишите уравнения химических реакций в молекулярной и ионной формах.
Результаты работы оформите в тетради в виде таблицы.
| Название опыта | Результаты наблюдений | Уравнения химических реакций | Вывод |
| 1. Получение солей сульфата свинца и йодида свинца 2. Получение гидроксида хрома и изучение его свойств. 3. Случаи течения реакций до конца. |
|
|
|
Вопросы для защиты лабораторной работы:
Понятия «оксид», «кислотный оксид», «основной оксид», «амфотерный оксид», «кислота», «основание», «щелочь» и «соль».
Номенклатура, классификация, свойства, способы получения оксидов, кислот, оснований и солей.
3.Напишите уравнения реакций для превращений, приведенных ниже.




CuSO4 CuCl2 ZnCl2 Na2ZnO2 Zn(OH)2





Mg MgО Mg(OH)2 MgOHCl MgCl2 Mg.
4. Закончите уравнения реакций:
а) Ca + HCl ...; б) К2O + H2O ...;
в) FeCl2 + NaOH ...; г) NaOH + H2SO4 (избыток) ... .
д) CO2 + CaO …; е) H2SiO3 + NaOH ;
ж) Mg(OH)2 + HBr (недостаток) ... .
5. Назовите вещества: Ca(HCO3)2; MgOHF; P2O5; FeCl2; NaHSO3; Fe(OH)2Cl Ba(HSO3)2; AlOHCl2; SO3; CuCl2; NaHS; K2HPO4
Лабораторная работа №2
Соединения марганца и хрома
Реактивы: штатив с пробирками, спички, растворы: сульфата марганца (Ⅱ), гидроксида натрия, перманганата калия, сульфата натрия, серной кислоты, дихромата калия, дихромата аммония (кристаллический ).
Опыт №1. Получение гидроксида марганца (Ⅱ) и окисление его кислородом воздуха.
В пробирку с раствором соли двухвалентного марганца прилить раствор щелочи, Каков цвет полученного осадка гидроксида марганца(Ⅱ) ?
Отметить побурение осадка вследствие окисления двухвалентного марганца до четырехвалентного состояния.
Составьте уравнения реакции. Сделайте вывод.
MnSO4 + NaOH → Na₂SO₄ + Mn(OH)₂↓
Mn(OH)2 + O2 → Mn(OH)₄↓
Опыт №2. Взаимодействие перманганата калия с сульфитом натрия в кислой и нейтральной cредах.
В 2 пробирки налить 1-2 мл раствора перманганата калия. В одну пробирку добавить разбавленную серную кислоту, а в другую - столько же воды. В обе пробирки прилить раствор сульфита натрия. Отметить изменение первоначальной окраски раствора перманганата калия в каждом случае.
KMnO4 + H2SO4 + Na2 SO3 → MnSO₄ + K₂SO₄ + Na₂SO₄ + H₂O
KMnO 4 + H₂O + Na2 SO3 → MnO₂ + KOH + Na₂SO₄
Составьте электронные схемы и подберите коэффициенты.
Сделайте вывод.
Опыт №3. Окислительные свойства солей шестивалентного хрома.
К 2-3 мл дихромата калия прибавить разбавленной серной кислоты и раствора сульфита натрия. Следите за изменением окраски от оранжевой
(Cr2 O7)²⁻до зеленой (Cr)³⁺.
K2Cr2O7 + Na2 SO3+ H2SO4 → Cr₂(SO₄)₃ + K₂SO₄ + Na₂SO₄ + H₂O
Составьте электронную схему и подберите коэффициенты.
Небольшое количество кристаллического дихромата аммония поместить на металлический поднос и поджечь. Следить за выделением газов и изменением окраски от оранжевой до зеленой.
Составьте электронную схему и подберите коэффициенты. Сделайте вывод.
(NH4)2 Cr2O7 →(нагреть) Cr2 O3 + N2↑ + H₂O↑
Проделайте эти реакции. Отметьте наблюдения. Напишите уравнения химических реакций.
Результаты работы оформите в тетради в виде таблицы.
| Название опыта | Результаты наблюдений | Уравнения химических реакций | Вывод |
| 1.Получение гидроксида марганца (Ⅱ) и окисление его кислородом воздуха. 2.Взаимодействие перманганата калия с сульфитом натрия в кислой и нейтральной cредах. 3.Окислительные свойства шестивалентного хрома. |
|
|
|
Вопросы для защиты лабораторной работы:
1.Какой металл следует взять для вытеснения хрома из Cr(NO3)3:
Zn Fe Ag Cu Sn
2.Напишите уравнения реакций для превращений, приведенных ниже:




 CrO3 Cr2O3 Cr Cr2(SO4)3 CrCl3 NaCrO2
CrO3 Cr2O3 Cr Cr2(SO4)3 CrCl3 NaCrO2
3.Для ОВР напишите электронную схему, расставьте коэффициенты. Окончательную реакцию напишите в ионной форме:
Cr2(SO4)3 + Н2О2 + NaOH = Na2SO4
4.Как получают металлический марганец и хром, где их применяют.
5.С какими из следующих веществ будет взаимодействовать марганец:
Hg(NO3)2 H2O KOH H2 O2 HNO3 HCl
6. Сколько граммов KMnO4 потребуется для окисления а)15,2 г FeSO4 в кислом растворе; б) 12,6 г Na2SO3 в щелочной среде; в) 16,6 г KI в нейтральной среде (Ответ: 3,16г; 31,6 г; 5,26г).
7.Осуществите превращения:
а) K2Cr2O7 → Cr2(SO4)3 → CrOHSO4 → Cr(OH)3 → Na3[Cr(OH)6]
Лабораторная работа №3
Соединения железа.
Реактивы: штатив с пробирками, растворы: сульфата железа, хлорида железа (Ⅲ), гидроксида натрия, серной кислоты, перманганата калия, желтой кровяной соли, красной кровяной соли, роданида калия.
Опыт №1. Получение гидроксида железа (Ⅱ), превращение его в гидроксид железа(Ⅲ).
В пробирке к 1-2 мл раствора сульфата железа (Ⅱ) добавить такой же объем раствора гидроксида натрия. Отметить образование белого осадка, переходящего в зеленый, а затем в бурый.
Напишите уравнения взаимодействия сульфата железа (Ⅱ) с гидроксидом натрия и окисления гидроксида железа(Ⅱ) на воздухе.
FeSO4 + NaOH → Fe(OH)₂↓ + Na 2SO₄
Fe(OH)2 + O2 + H2O→ Fe(OH)3↓
Сделайте вывод.
Опыт №2. Получение гидроксида железа (Ⅲ) и изучение его основных свойств.
В пробирку к 1-2 мл раствора хлорида железа (Ⅲ) прилейте 1-2 капли раствора гидроксида натрия. Наблюдайте образование бурого осадка. К полученному гидроксиду железа (Ⅲ) прилейте несколько капель серной кислоты до растворения осадка. Запишите наблюдения.
Напишите уравнения реакций в молекулярной и ионной формах:
FeCl3 + NaOH → Fe(OH)₃↓ + NaCl
Fe(OH)3 + H2SO4 → Fe(SO₄)₃ + H₂
Сделайте вывод.
Опыт №3. Окисление сульфата железа (Ⅱ) перманганатом калия в кислой среде.
В пробирку с 2-3 мл раствора перманганата калия добавьте 2-3 капли раствора серной кислоты и 4-5 капель раствора сульфата железа(Ⅱ). Наблюдайте изменение окраски.
Составьте электронную схему, подберите коэффициенты.
KMnO4 + H2SO4 + FeSO4 → MnSO₄ + K₂SO₄ + Fe₂(SO₄)₃ + H₂O
Сделайте вывод.
Опыт №4. Качественные реакции на соли железа (Ⅱ) и железа(Ⅲ).
Ионы двухвалентного железа дают с гексацианоферратом (Ⅲ) калия (красной кровяной солью) характерный темно-синий осадок гексацианоферрат(Ⅲ) железа(Ⅱ) (турнбулеву синь). Ионы трехвалентного железа с гексацианоферратом(Ⅱ) калия ( желтой кровяной солью) образуют сине-зеленый осадок гексацианоферрат(Ⅱ) железа(Ⅲ) (берлинскую лазурь), а с тоцианатом калия или аммония (роданидом калия или аммония) – кроваво-красное окрашивание тоцианата железа(Ⅲ) (роданида железа(Ⅲ)).С помощью указанных реакций можно определить присутствие ничтожных количеств ионов железа(Ⅱ) и железа(Ⅲ) в растворе. Проделать данные реакции, отметить наблюдения, записать уравнения реакций в молекулярной и ионной формах:
FeSO4 + K3[Fe(CN)6] → Fe₃[Fe(CN)₆]2↓ + K₂SO₄
FeCl3 + K4[Fe(CN)6] → Fe₄[Fe(CN)₆]₃↓ + KCl
FeCl3 + KCNS → Fe(CNS)₃ + KCl
Сделайте вывод.
Проделайте эти реакции. Отметьте наблюдения. Напишите уравнения химических реакций.
Результаты работы оформите в тетради в виде таблицы.
| Название опыта | Результаты наблюдений | Уравнения химических реакций | Вывод |
| 1.Получение гидроксида железа(Ⅱ), превращение его в гидроксид железа(Ⅲ). 2.Получение гидроксида железа(Ⅲ)и изучение его основных свойств. 3. Окисление сульфата железа (Ⅱ) перманганатом калия в кислой среде. 4. Качественные реакции на соли железа(Ⅱ)и железа(Ⅲ).
|
|
|
|
Вопросы для защиты лабораторной работы:
1.Определите степень окисления железа в следующих соединениях:
Ba(FeO2)2 NaFe(CrO4)2 Fe4[Fe(CN)6]3 K2FeO4
2. С какими из следующих веществ взаимодействует оксид железа (3):
H2O KOH Na2CO3 FeO H2SO4 MgO
Напишите уравнения химических реакций. Какие свойства проявляет оксид железа (3) в этих реакциях?
3.Осуществите превращения:
а) FeO → Fe → Fe(NO3)3 → Fe(OH)3 → K3[Fe(OH)6]
Лабораторная работа №4
Спирты. Фенолы. Альдегиды.
Реактивы: штатив с пробирками, спиртовка, медная проволока, этиловый спирт (этанол), глицерин, растворы: сульфата меди, гидроксида натрия, нитрата серебра, гидроксида аммония, муравьиного альдегида (метаналь, формальдегид), хлорида железа(Ⅲ).
Опыт №1. Окисление спирта в альдегид .
Налейте в пробирку 1 мл этилового спирта. Сильно раскалите кусочек медной проволоки в пламени спиртовки до образования черного налета. Не давая меди остыть, отпустите ее в пробирку со спиртом. Быстро понюхайте выделившиеся пары, имеющие запах свежих яблок, который указывает на образование уксусного альдегида. Что происходит с медью ?
Написать уравнение реакции.
Cu + O2 →(нагреть) CuO
C2H5OH + CuO → CH₃ – СОН + Cu + H₂O
Сделайте вывод.
Опыт №2. Получение глицерата меди.
Налейте в пробирку немного раствора сульфата меди и добавьте раствора гидроксида натрия. К образовавшемуся осадку в этой пробирке добавьте 0,5 мл глицерина и тщательно перемешайте содержимое. Отметьте наблюдения. Написать уравнения реакций.
CuSO4 + NaOH → Cu(OH)₂↓ + Na₂SO₄
СН2 – OH OH ↘ СН2 – OH ↘
| Cu → | Cu
СН – OH + OH ↗ СН – OH ↗ + H2 O
| |
СН2 – OH СН2 – OH
Сделайте вывод.
Опыт №3. Взаимодействие фенола с хлоридом железа (Ⅲ).
Налейте в пробирку 1мл концентрированного раствора фенола и добавьте 1-2 капли раствора хлорида железа (Ⅲ). Отметьте наблюдения.
Напишите уравнения реакции.
С6 H5OH + FeCl3 → С6 H5 OFeCl2 + HCl
Сделайте вывод.
Опыт №4: Окисление альдегидов.
Окисление формальдегида (формалина) будем проводить аммиачным раствором оксида серебра (реакция «серебряного зеркала»). Реакция «серебряного зеркала» осуществима только в совершенно чистой пробирке. Так как оксид серебра не растворяется в воде, то для получения аммиачного раствора оксида серебра используют реакцию между нитратом серебра и гидроксидом аммония (водным раствором аммиака). В чистую пробирку налейте 5-6 капель раствора нитрата серебра, затем прибавляйте по каплям гидроксид аммония, выпадает осадок гидроксида серебра, прибавляйте гидроксид аммония до растворения выпавшего осадка. К полученному раствору, вращая пробирку, по стенкам прибавьте немного формальдегида (формалина). Полученную смесь быстро и осторожно слегка нагреть (до кипения не доводить). Как только заметите, что содержимое пробирки побурело и на стенках начал образовываться зеркальный слой серебра, прекратите нагревание.
Отметьте наблюдения. Напишите уравнения реакций.
AgNO3 + NH4OH → AgOH↓ + NH₄NO₃
AgOH → Ag₂O + H₂O
H – COH + Ag2O →(нагреть) Ag↓ + HCOOH
Сделайте вывод.
Результаты работы оформите в тетради в виде таблицы.
| Название опыта | Результаты наблюдений | Уравнения химических реакций | Вывод |
| 1.Окисление спирта в альдегид.
2.Получение глицерата меди 3.Взаимодействие фенола с хлоридом железа (Ⅲ).
4. Окисление альдегидов. |
|
|
|
Вопросы для защиты лабораторной работы:
1.Напишите структурные формулы следующих одноатомных спиртов:
а) 2-метилпропанол-2; в) 2,4,4-триметилпентанол-2;
б) 2,3-диметилпентанол-3; г) 2,3- диметилбутанол-2.
2. Сколько миллилитров 40% азотной кислоты (плотность 1,2 г/см3 ) потребуется для получения 11,3 г тринитрата глицерина? (Ответ: 8мл).
3.При помощи каких реакций можно осуществить следующие превращения:



 С СН4 С2Н2 С6Н6 С6Н5ОН
С СН4 С2Н2 С6Н6 С6Н5ОН
4.В двух пробирках находятся уксусный альдегид и этиленгликоль. Как определить, где какое вещество? Напишите уравнения реакций.
5.При окислении 6 г технического препарата этаналя аммиачным раствором оксида серебра (1) образовалось 20 г металла. Определите массовую долю (%) этаналя в техническом препарате. (Ответ: 67,9%).
Лабораторная работа №5
Углеводы.
Реактивы: штатив с пробирками, спиртовка, растворы: глюкозы, нитрата серебра, гидроксида аммония, сульфата меди, гидроксида натрия, крахмала, йода.
Опыт №1. Окисление глюкозы аммиачным раствором оксида серебра.
В чистую пробирку налейте немного раствора глюкозы и в 2 раза меньше аммиачного раствора оксида серебра (кто забыл, как он готовиться, читайте опыт 4 в лабораторной работе №4 «Спирты. Фенолы. Альдегиды.»).
Пробирку слегка нагрейте. Как только заметите на стенках образование зеркального налета, нагревание прекратите. Отметьте наблюдения. Напишите уравнения реакции «серебряного зеркала».
СН2OH – (CHOH)4 – СОН + Ag2O →(нагреть) Ag↓ + СН2OH – (CHOH)4–СООН
Сделайте вывод.
Опыт №2. Окисление глюкозы гидроксидом меди (Ⅱ) при нагревании.
В пробирку налейте 1мл раствора глюкозы, в 2 раза меньше гидроксида меди и столько же раствора гидроксида натрия. Все тщательно перемещайте, осадок раствориться. Затем пробирку с содержимым нагрейте до образования кирпично-красного осадка оксида меди (Ⅰ).
Отметьте наблюдения. Напишите уравнение реакции окисления глюкозы.
СН2OH – (CHOH)4 – СОН + Cu(OH)2 →(нагреть) Cu2O↓ + СН2OH – (CHOH)4–СООН + Н2О
Сделайте вывод.
Опыт №3. Окисление глюкозы гидроксидом меди (Ⅱ) без нагревания.
В пробирку налейте 1мл раствора глюкозы, 0,5мл сульфата меди и 0,5мл гидроксида натрия. Все тщательно перемешайте, осадок раствориться. Какая окраска раствора? Отметьте наблюдения. Напишите уравнения реакции окисления глюкозы.
OH↘
СН2OH – (CHOH)4 – СОН+ Cu → Н2О +
OH↗
+ СН2ОН - СН – CH - (CHOH)2 – СОН
| |
O O
↘ ↙
Cu
Сделайте вывод.
Опыт №4. Реакция крахмала с йодом.
В пробирку налейте немного раствора крахмала в воде (клейстера) и 2-3 капли раствора йода. Отметьте наблюдения. Напишите уравнения реакции.
(C6 H10O5)n + I2 → I₂(C₆H₁₀O₅)n
Сделать вывод.
Результаты работы оформите в тетради в виде таблицы.
| Название опыта | Результаты наблюдений | Уравнения химических реакций | Вывод |
| 1.Окисление глюкозы аммиачным раствором оксида серебра. 2. Окисление глюкозы гидроксидом меди (Ⅱ) при нагревании.
3. Окисление глюкозы гидроксидом меди (Ⅱ) без нагревания. 4. Реакция крахмала с йодом. |
|
|
|
Вопросы для защиты лабораторной работы:
1.Какие из углеводов подвергаются гидролизу:
а) фруктоза; в) сахароза;
б) крахмал; г) глюкоза.
2. Для каких углеводов характерна реакция «серебряного зеркала»?
а) целлюлоза; б) глюкоза; в) фруктоза.
3. Сколько кг сахарной свеклы, содержащей 20% сахарозы, будет подвергаться гидролизу для получения 50 кг глюкозы? (Ответ; 475 кг).
4. Приложение.


5. Информационное обеспечение обучения.
Перечень рекомендуемых учебных изданий, Интернет-ресурсов, дополнительной литературы.
Основная литература
Химия:10 класс: базовый уровень: учебник/О.С.Габриелян, И.Г.Остроумов. С.А.Сладков.-5-е изд.,стер.- Москва: Просвещение, 2023.- 128 с. : ил.
Химия:10 класс: базовый уровень: учебник/О.С.Габриелян, И.Г.Остроумов. С.А.Сладков.-5-е изд.,стер.- Москва: Просвещение, 2023.- 127(1) с.: ил.
3.Сергеев П.М. Общая и неорганическая химия: учебник для СПО/П.М.Сергеев.-2-у изд., стер.- Санкт-Петербург: Лань. 2023.-275с.: ил.-Текст: непосредственный.
4.Химия для профессий и специальностей технического и естественнонаучного профилей: Ерохин Ю.М., Ковалёва И.Б. учебник для студ. СПО. - М.: Академия, 2020.
5. Химия; задачи и упражнения: учебное пособие для студентов СПО. Ерохин Ю.М. - М.: Академия (Academia), 2019.
6. Яблоков В.А. Основы неорганической и органической химии: учебное пособие для СПО/ В.А. Яблоков. Н.В. Яблокова.- Санкт – Петербург: Лань. 2023.-288с. : ил. - Текст непосредственный.
7. О.С.Габриелян, П.В.Решетов, И.Г.Остроумова «Задачи по химии и способы их решения» - М.: «Дрофа», 2021год.
Дополнительная литература
1. Кириллов В.А. Основы неорганической химии: учебник для СПО / В.В. Кириллов. – 2-е изд., стер. - Санкт – Петербург: Лань. 2023.-352с. : ил. - Текст непосредственный.
2. Резников В.А. Сборник задач и упражнений по органической химии: учебно – методическое пособие для СПО / В.А. Резников. – 3-е изд., стер. – Санкт – Петербург: Лань. 2023. – 336 с.: ил. – Текст непосредственны
3.О.С.Габриелян, И.Г.остроумов «Химический эксперимент в школе 11 класс»; - М.: Дрофа. – 2019 год. _
Интернет ресурсы:
«Инфоурок.ру» – материалы для учителей. Режим доступа: https://infourok.ru
Онлайн-школа Фоксфорд. Режим доступа: https://foxford.ru
Российская электронная школа. Режим доступа: https://resh.edu.ru
Единая коллекция образовательных ресурсов. Режим доступа: http://school-collection.edu.ru/
Федеральный центр информационно – образовательных ресурсов. Режим доступа: http://fcior.edu.ru/
6.https://jread.top/scientific-journals/43334-nauka-i-zhizn-10-2023.html наука и жизнь







































