Технологическая карта урока по химии для 9 класса по теме
«Хлороводород. Соляная кислота.»
Цель урока: изучить способы получения и физические свойства хлороводорода и его водного раствора — соляной кислоты. Систематизировать и углубить знания о химических свойствах соляной кислоты, охарактеризовать области её применения. Сформировать умение распознавать хлорид-ион.
Предметные умения
-умение объяснять тип химической связи в молекуле хлороводорода,
- умение характеризовать физические свойства хлороводорода как молекулярного вещества с ковалентно- полярным типом связи,
- умение составлять уравнения реакций ( молекулярных и ионных), характеризующих свойства соляной кислоты, проводить химические опыты с соляной кислотой
Познавательные.
- умение находить сходство и различие между объектами, обобщать полученную информацию;
- умение вести наблюдение;
-умение понимать различие между теоретическими моделями и реальными объектами
Регулятивные.
- умение выполнять учебное задание в соответствии с целью;
- умение соотносить учебные действия с известными правилами;
-умение осознавать уровень усвоения учебного материала.
Коммуникативные.
- умение формулировать высказывание;
- умение анализировать и перерабатывать информацию в соответствии с поставленными задачами
- умение адекватно использовать речевые средства и символы для представления результата.
Функциональная грамотность: применение хлороводорода и соляной кислоты, умение выполнять работу по инструкции, креативный подход к решению поставленных задач
Оборудование и реактивы: Компьютер, мультимедийный проектор, таблицы «Электронное строение атомов химических элементов», ПСХЭ Д.И. Менделеева, оборудование и реактивы для химического эксперимента (по списку)
Тип урока: изучение нового материала (с элементами беседы, химического эксперимента и самостоятельной работы учащихся).
План урока
1. Организационный этап.
2. Актуализация опорных знаний.
3. Мотивация учебной деятельности
4. Целеполагание и планирование совместной с учениками деятельности
5. Изучение нового материала.
7. Рефлексия, обратная связь и коррекция
8. Инструктаж о домашнем задании, инструкция к его выполнению
9. Подведение итогов урока, оценивание
Ход урока
| Этапы
| Деятельность учителя | Деятельность учащихся | Примечание |
| 1 этап. Организационный момент
2 этап. Актуализация опорных знаний
| Добрый день, садитесь, пожалуйста. Очень рада видеть вас на сегодняшнем уроке. Надеюсь, что наша совместная с вами работа будет полезной и интересной. Давайте настроимся на поиск и творчество, улыбнемся друг другу и начнем урок.
- Расскажите о физических свойствах хлора (хлор – газ, желто-зеленого цвета, имеет резкий, удушливый запах. Яд для всех живых организмов. Тяжелее воздуха в 2,5 раза. Кипит при температуре от +15 ºС). - Как меняется химическая активность галогенов от фтора к йоду? (фтор химически наиболее активен, а йод наименее активен). - Как меняется вытеснительная активность галогенов в растворах их солей? (более активные галогены вытесняют менее активные галогены из их соединений). - С какими простыми веществами реагирует хлор? (с металлами и водородом). - Опишите взаимодействие хлора с водой, раскрыв сущность реакции ( Cl2 + H2O = HCl + HClO. Реакция обмена, в результате образуются две кислоты: соляная и хлорноватистая; ОВР). | Слушают учителя
Ответы учащихся |
Фронтальный опрос |
| 3 Мотивация учебной деятельности |
Проанализируйте текст, определите вещества ,которые и будут предметом изучения сегодня на уроке. «Во время Первой мировой войны (1915 г.) около города Ипр на западе Фландрии впервые был использован отравляющий газ. Эта газовая атака унесла жизни 5 тыс. солдат и около 15 тыс. сделала инвалидами. Взаимодействие этого газа с водородом может происходить со взрывом, водный раствор продукта этой реакции раньше называли «муриевой кислотой». Одним из первооткрывателей ядовитого газа стал шведский химик и аптекарь Карл Шееле, получивший его нагреванием минерала пиролюзита (MnO2) с муриевой кислотой». Дополню: водный раствор «муриевая кислота» - соляная кислота. При нагревании минерала пиролюзита с соляной кислотой образуется хлор по реакции: 4HCl + MnO2 = MnCl2 + Cl2 + 2H2O Несколько интересных фактов: Желудок человека вынужден ежедневно обновлять свою поверхность взамен пострадавшей от желудочного сока, то есть соляной кислоты; Желудочный сок человека достаточно агрессивен для того, чтобы полностью растворить бритвенное лезвие за неделю — это происходит благодаря соляной кислоте; Соляная кислота — может полностью испарится; Соляная кислота — способствует перевариванию пищи в желудке и убивает различные болезнетворные бактерии.
| Ответы учащихся- Этот газ – хлор. При взаимодействии хлора с водородом образуется хлороводород, |
|
| 4. Целеполагание и планирование совместной с учениками деятельности | Учитель записывает тему урока на доске, учащиеся записывают в тетрадях дату и тему урока. Давайте составим план изучения темы. Учитель записывает план на доске: Формула вещества Получение Свойства физические и химические Применение
| Работа в тетради
Ответы детей |
|
Изучение новой темы |
Ситуативное задание |
|
|
|
| Учащиеся работают с рабочей инструкцией Опишите качественный, количественный состав хлороводорода. Составьте структурную и электронную формулы хлороводорода. Вычислите относительную плотность хлороводорода по воздуху. Определите тип связи. Результаты занесите в таблицу. | Химическая формула Молярная масса | Электронная формула | Структурная формула | Тип химической связи | Относительная плотность по воздуху | |
|
|
|
|
|
|
| Индивидуальная работа |
|
| Назовите области применения Хлороворода
Зпишите способы получения хлороводорода в промышленности и в лаборатории
В промышленности хлороводород получают взаимодействие хлора с водородом. Cl 2+ H 2= 2 HCl. В лаборатории получают нагреванием хлорида натрия с концентрированной серной кислотой. В таких условиях, при отсутствии воды, выделяется газообразный хлороводород, его затем растворяют в воде и получают соляную кислоту. 2NaCl + H 2 SO 4= Na2SO4+HCL↑.
Используя знания о химической связи HCL скажите, растворим ли хлороводорд в воде? Что при этом образуется? (Кислота)
А теперь получим хлороводород. Прежде чем приступить к проведению эксперимента всполмним правила ТБ при работе с кислотами, спиртовкой
Получение HCL и изучение его свойств | Выполняемые операции
(что делали) | Рисунки с обозначениями исходных и полученных веществ | Наблюдения.
Условия
проведения реакций. Уравнения реакций | Объяснения наблюдений.
Выводы | | 1. Получение соляной кислоты | 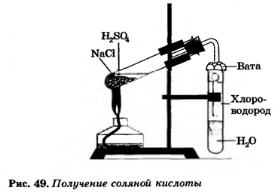
| В пробирке с водой наблюдаем выделение газа
2NaCl + H 2 SO 4= Na2SO4+HCL↑. | Получили НCL | | Доказательство получения соляной кислоты |
| В побирку добавим бесцветный ф/ф, раствор окрасился в малиновый цвет | Растворенный в воде хлороводород обладает кислотными свойствами. Получили соляную кислоту | | Исследование свойств соляной кислоты
С Ме
сМехOy
c Mex(OH)y
c солями |
| НСl-жидкость, без цвета, с резким запахом Zn+HCL=ZnCl2+H2, при внесении горящей спички хлопок
CuO+HCL=CuCl2+H2O
CuSO4+KOH=Cu(OH)2↓+K2SO4 Cu(OH)2+HCL=CuCL2+H2O
CaCO3+HCL=CaCL2+CO2↑+H2O
|
Выделение H2↑
CuCl2голубой
Cu(OH)2↓голубой осадок Осадок растворился, образ. CuCl2голубой Выделяется CO2. Спичка гаснет | | качественная реакция на хлориды
|
| HCl + AgNO3 =HNO3+AgCL↓
NaCl + AgNO3 = NaNO3+AgCL↓ | AgCL↓ белый осадок
|
| Работа с учебником. Записывают
Дети перечисляют правила ТБ
Выполняют химический эксперимент | Индивидуальная работа
Работа в парах |
| 6. Закрепление новой темы (5 мин) | Тест на экране 1.Какой газ легче воздуха 1)SO2 2)NO 3)O2 4)HCl 2. Ковалентно неполярная связь в соединении 1) HCl 2) H2O 3) HF 4) Cl2 3. Какой газ можно собирать, вытесняя воду 1) O2 2) NH3 3) F2 4) HCl 4. Соляная кислота не взаимодействует с 1) Zn 2) SiO2 3) KOH 4) CuO 5. Гидроксид натрия взаимодействует с 1) Na2O 2) Mg(OH)2 3) HCl 4) NaCl Взаимопроверка в парах, сопоставление с эталоном | Самостоятельная работа с взаимопроверкой | Индивидуальная работа |
| 7..Рефлексивная деятельность (1-2 мин) | Самоанализ и самооценка ученика |
|
|
|
| Самоанализ Ответьте на вопросы. -Что узнал нового? - Что меня удивило? - Что показалось трудным? - Как я буду преодолевать трудности? Самооценка Закончите предложения: Я доволен(льна) тем, что сегодня самостоятельно смог(ла) Я не доволен(льна) тем, что сегодня ………………… |
|
|
| 8. Домашнее задание (1 мин)
| §14, применение соляной кислоты, упр. №1,2 ― Творческое задание: Подготовить сообщение или презентацию «Применение соляной кислоты и её солей»
|
|
| 9. Подведение итогов урока, оценивание
|
|
|
Рабочий лист
Опишите качественный, количественный состав хлороводорода. Составьте структурную и электронную формулы хлороводорода. Вычислите относительную плотность хлороводорода по воздуху. Определите тип связи. Результаты занесите в таблицу.
| Химическая формула Молярная масса | Электронная формула | Структурная формула | Тип химической связи | Относительная плотность по воздуху |
|
|
|
|
|
|
Назовите области применения Хлороворода
Зпишите способы получения хлороводорода в промышленности и в лаборатории
В промышленности хлороводород
В лаборатории получают
Получение HCL и изучение его свойств
| Выполняемые операции
(что делали) | Рисунки с обозначениями исходных и полученных веществ | Наблюдения.
Условия
проведения реакций. Уравнения реакций | Объяснения наблюдений.
Выводы |
| 1. Получение соляной кислоты | 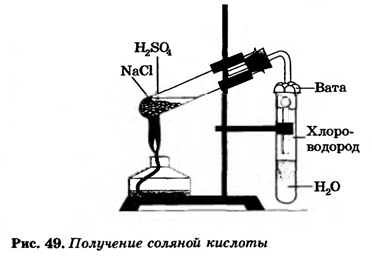
| В пробирке с водой наблюдаем …………………….…………………….
Запишите уравнение реакции |
|
| Доказательство получения соляной кислоты |
| В побирку добавим бесцветный ф/ф, раствор ……………………………… |
|
| Исследование свойств соляной кислоты
С Ме
сМехOy
c Mex(OH)y
c солями | HCL.Zn | НСl-……………………………………………………………………………………………………………………………………………..
Zn+HCL=………………………………., при внесении горящей спички ……….
CuO+HCL=……………………………..
CuSO4+KOH=………………………….. Cu(OH)2+HCL=…………………………
CaCO3+HCL=………………………….. при внесении горящей спички ………. |
Выделение газа………….↑
Выделяется газ……. |
| качественная реакция на хлориды
|
| HCl + AgNO3 =…………………………
NaCl + AgNO3 …………………………. | .
|

























