
Тема урока: «Соединения углерода»
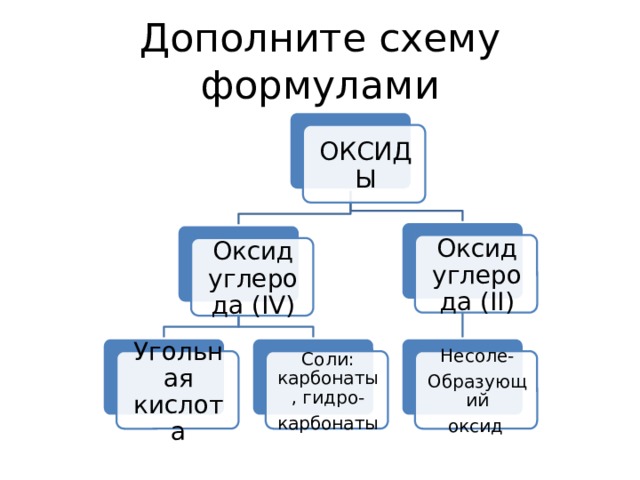
Дополните схему формулами
ОКСИДЫ
Оксид углерода (II)
Оксид углерода (IV)
Соли: карбонаты, гидро-
Угольная кислота
Несоле-
карбонаты
Образующий
оксид
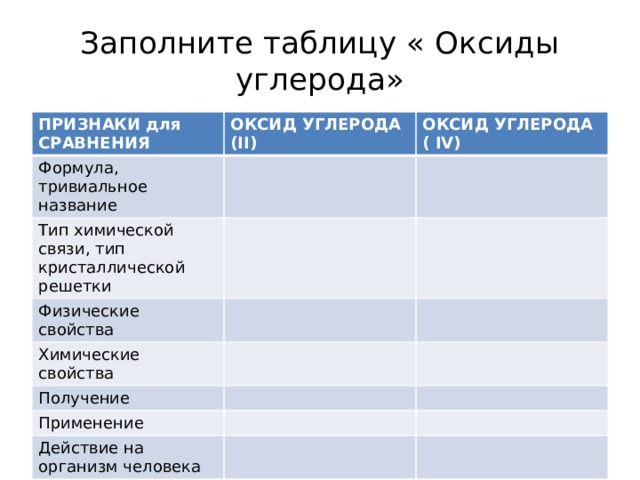
Заполните таблицу « Оксиды углерода»
ПРИЗНАКИ для
CРАВНЕНИЯ
ОКСИД УГЛЕРОДА (II)
Формула, тривиальное название
ОКСИД УГЛЕРОДА ( IV)
Тип химической связи, тип кристаллической решетки
Физические свойства
Химические свойства
Получение
Применение
Действие на организм человека

ВЫВОД
Оксиды углерода имеют черты сходства, а именно:………………………………………………………, что свидетельствует о…………………………………., а также отличия:………………………………………….., что говорит о…………………………………………………
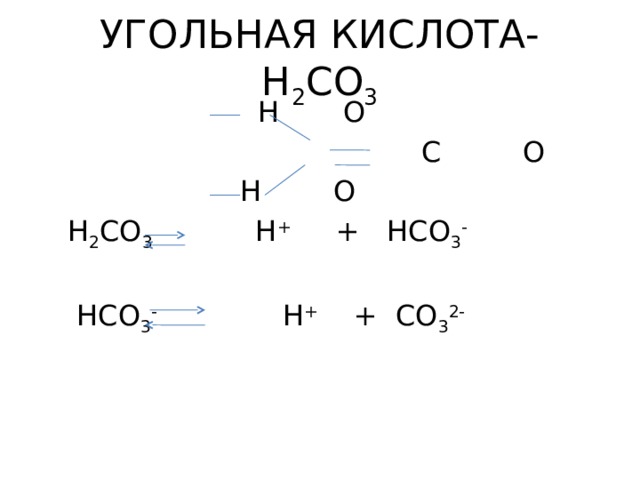
УГОЛЬНАЯ КИСЛОТА- H 2 CO 3
H O
C O
H O
H 2 CO 3 H + + HCO 3 -
HCO 3 - H + + CO 3 2-
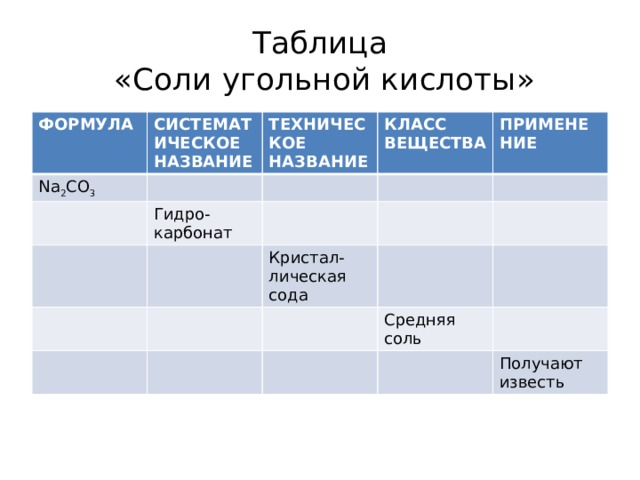
Таблица «Соли угольной кислоты»
ФОРМУЛА
СИСТЕМАТИЧЕСКОЕ НАЗВАНИЕ
Na 2 CO 3
ТЕХНИЧЕСКОЕ
НАЗВАНИЕ
КЛАСС
Гидро-
ВЕЩЕСТВА
карбонат
ПРИМЕНЕНИЕ
Кристал-лическая сода
Средняя соль
Получают известь

ДОМАШНЕЕ ЗАДАНИЕ
- Параграф « Кислородные соединения углерода» учить, подготовиться к самостоятельной работе по теме « Углерод и его соединения»

Практическая работа
« Получение оксида углерода (IV). Распознавание карбонатов»

Оборудование и реактивы:
1)NaHCO 3 - гидрокарбонат натрия(пищевая сода)
2) HCL – соляная кислота
3) Ca(OH) 2 – известковая вода
4)NaOH - гидроксид натрия
5)Дистиллированная вода
6)Фенолфталеин, лакмус
7) Пробирка, пустая ампула
8) Пробка с газоотводной трубкой
9)Держатель
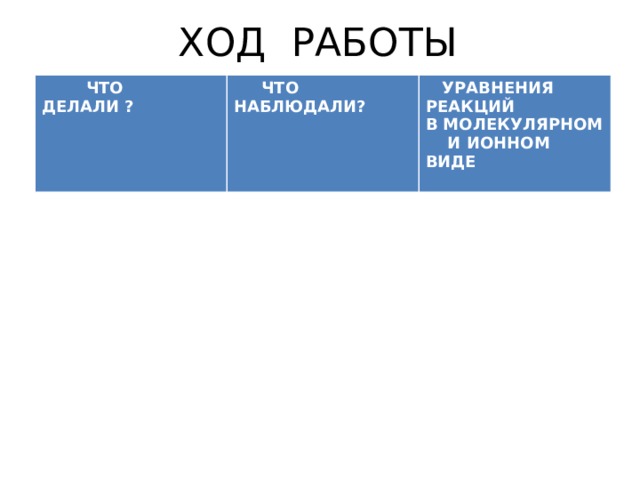
ХОД РАБОТЫ
ЧТО ДЕЛАЛИ ?
ЧТО НАБЛЮДАЛИ?
УРАВНЕНИЯ РЕАКЦИЙ
В МОЛЕКУЛЯРНОМ И ИОННОМ ВИДЕ

Получение CO 2 и изучение его свойств
- В пробирку с порошком пищевой соды прилейте немного разбавленной соляной кислоты. Быстро закройте пробирку пробкой с газоотводной трубкой. Конец трубки опустите в раствор известковой воды.
2) Наблюдайте, как через известковую воду проходят пузырьки газа.
3) Затем опустите трубку в другую ампулу с 2-3 мл дистиллированной воды и пропустите через нее газ. Через несколько минут выньте трубку из раствора, добавьте к полученному раствору несколько капель раствора синего лакмуса.
4) При растворении оксида углерода (IV) в воде образуется нестойкая угольная кислота, которая окрашивает фиолетовый раствор лакмуса в красный цвет.
5 ) В пустую ампулу налейте 2-3 мл разбавленного раствора гидроксида натрия и добавьте к нему несколько капель фенолфталеина. Затем через раствор пропустите газ.
6) Наблюдайте обесцвечивание малинового раствора фенолфталеина.
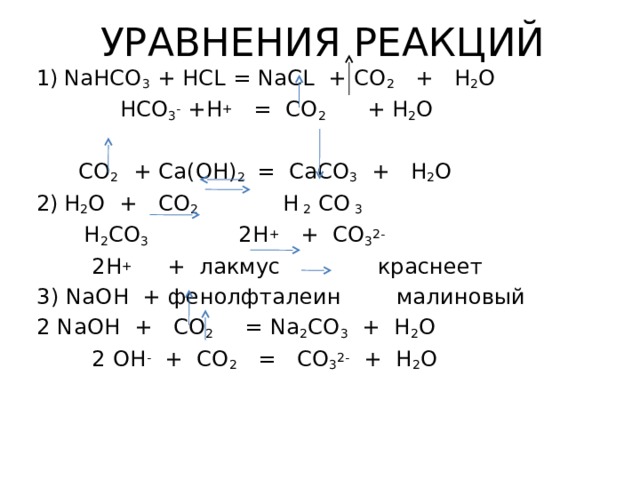
УРАВНЕНИЯ РЕАКЦИЙ
- NaHCO 3 + HCL = NaCL + CO 2 + H 2 O
HCO 3 - +H + = CO 2 + H 2 O
CO 2 + Ca(OH) 2 = CaCO 3 + H 2 O
H 2 CO 3 2H + + CO 3 2-
2H + + лакмус краснеет
3) NaOH + фенолфталеин малиновый
2 NaOH + CO 2 = Na 2 CO 3 + Н 2 O
2 OH - + CO 2 = CO 3 2- + H 2 O

РАСПОЗНАВАНИЕ КАРБОНАТОВ
- Карбонаты и гидрокарбонаты можно обнаружить с помощью растворов кислот
2) Наблюдается характерное « вскипание» из – за выделяющегося углекислого газа
3) Эта реакция является качественной реакцией на соли угольной кислоты

ВЫВОД
- ПОЛУЧИЛИ оксид углерода (IV), изучили свойства углекислого газа. Узнали, как распознавать карбонаты. Составили уравнения реакций в молекулярном и ионном виде.

ДОМАШНЕЕ ЗАДАНИЕ
- Параграфы 28,29 читать, выполнить упражнения: 1,4,6,7 (б) письменно в тетради.










































