
Кислоты в свете ТЭД 8 класс(по программе О.С. Габриелян)

Цели урока
- Сформировать понятие о кислотах как классе электролитов.
- Рассмотреть их классификацию по различным признакам
- Охарактеризовать общие свойства кислот в свете ионных представлений
- Научиться пользоваться рядом напряжений металлов и таблицей растворимости для прогнозирования возможных химических реакций кислот.
 30% СРЕДНИЕ 3% СЛАБЫЕ ст. дис. Все щелочи H 2 SO 4 HNO 3 HCl Растворимые соли HF H 2 SO 3 H 3 PO 4 Mg(OH) 2 H 2 CO 3 H 2 SiO 3 HNO 2 NH 4 OH H 2 O " width="640"
30% СРЕДНИЕ 3% СЛАБЫЕ ст. дис. Все щелочи H 2 SO 4 HNO 3 HCl Растворимые соли HF H 2 SO 3 H 3 PO 4 Mg(OH) 2 H 2 CO 3 H 2 SiO 3 HNO 2 NH 4 OH H 2 O " width="640"
КЛАССИФИКАЦИЯ ВЕЩЕСТВ В СВЕТЕ ТЭД
Электролиты
Неэлектролиты
Ионная, ковалентная сильно
полярная связь
(в растворе и расплаве
проводят
злектрический ток)
Ковалентная слабополярная,
неполярная связь
(в растворе и расплаве
не проводят
электрический ток)
СИЛЬНЫЕ
ст. дис. 30%
СРЕДНИЕ
3%
СЛАБЫЕ
ст. дис.
Все щелочи
H 2 SO 4
HNO 3
HCl
Растворимые соли
HF
H 2 SO 3
H 3 PO 4
Mg(OH) 2
H 2 CO 3
H 2 SiO 3
HNO 2
NH 4 OH
H 2 O

Что такое кислоты?
- Сложные вещества, состоящие из атомов водорода, соединенных с кислотным остатком HR
- Электролиты, диссоциирующие с образованием катионов водорода и анионов кислотного остатка H + R n-
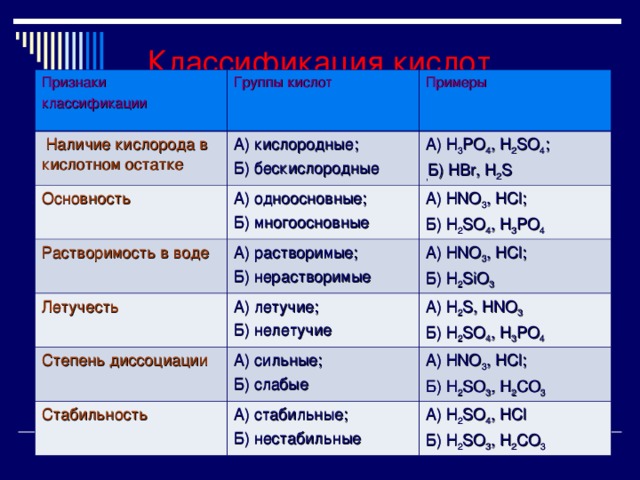
Классификация кислот
Признаки
классификации
Группы кислот
Наличие кислорода в кислотном остатке
Основность
Примеры
А) кислородные;
Б) бескислородные
Растворимость в воде
А) одноосновные;
Б) многоосновные
А) H 3 PO 4 , H 2 SO 4 ;
, Б) HBr, H 2 S
А) HNO 3 , HCl ;
Б) H 2 SO 4 , H 3 PO 4
А) растворимые;
Б) нерастворимые
Летучесть
А) HNO 3 , HCl ;
Б) H 2 SiO 3
А) летучие;
Б) нелетучие
Степень диссоциации
А) H 2 S, HNO 3
Б) H 2 SO 4 , H 3 PO 4
А) сильные;
Б) слабые
Стабильность
А) HNO 3 , HCl ;
Б) H 2 SO 3 , H 2 CO 3
А) стабильные;
Б) нестабильные
А) H 2 SO 4 , HCl
Б) H 2 SO 3 , H 2 CO 3

Химические свойства кислот
- Диссоциация
- Действие на индикатор
- Взаимодействие с металлами
- Взаимодействие с
основаниями. Реакция
нейтрализации
- Взаимодействие с оксидами
металлов
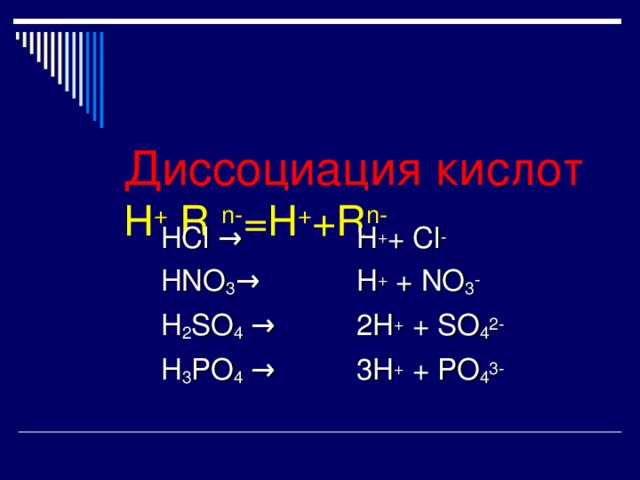
Диссоциация кислот H + R n- =H + +R n-
HCl →
HNO 3 →
H 2 SO 4 →
H 3 PO 4 →
H + + Cl -
H + + NO 3 -
2H + + SO 4 2-
3H + + PO 4 3-

Сильные кислоты - опасные вещества!!!!

Индикаторы

Кислоты и индикаторы

Отличаются ли ион и молекула водорода?

Взаимодействие с индикатором
Индикатор
Нейтральная среда
Лакмус
Кислая среда
Фиолетовый
Фенолфталеин
Красный
Бесцветный
Метиловый
оранжевый
Бесцветный
Оранжевый
Розовый
Помни! Нерастворимые кислоты не меняют окраску индикаторов.

Взаимодействие с металлами

Взаимодействие с металлами
Ме + Н R → Ме R+ Н 2
металл + кислота→соль + водород
2 Zn + H 2 SO 4 → Zn SO 4 + H 2
Реакция возможна, если:
- Металл находится в ряду активности до водорода;
- В результате реакции получается растворимая соль;
- Кислота растворима
- Щелочные металлы для подобной реакции не берут ( они взаимодействуют с водой)
- Фосфорная кислота с металлом реакции не дает . Т.к растворимы лишь фосфаты щелочных Ме, а эти Ме брать нельзя.
Все ли активные металлы реагируют с кислотами одинаково?

Железо активный металл, но пассивируется в концентрированной серной и азотной кислотах

Нейтрализация-взаимодействие кислот с основаниями, н-р со щелочами(растворимыми)

Также кислоты реагируют с нерастворимыми основаниями

Ме(ОН) m + Н R → MeR+ H 2 O
Основание + кислота → соль + вода
2LiOH + H 2 SO 4 → Li 2 SO 4 + 2H 2 O
2Li + + 2OH - + 2H + + SO 4 2- → 2Li + + SO 4 2- + 2H 2 O
2H + + 2OH - → 2H 2 O
Реакция между щелочью и кислотой с образованием соли и воды называется реакцией нейтрализации.
С u(OH)2 + 2HCL= CuCL2 +2 H2O
Cu(OH)2 +2H+ =CU2+ +2H2O
Взаимодействие с основаниями
Кислоты реагируют с оксидами металлов

Иногда при нагревании

Взаимодействие с основными оксидами
Ме x O y + HR → Ме R+ H 2 O
Основный оксид + кислота → соль + вода
С uO + 2HCl →Cu Cl 2 + H 2 O
CuO + 2H + + 2Cl - → Cu 2+ + 2Cl - + H 2 O
CuO + 2H + → Cu 2+ + H 2 O
Реакция возможна, если в результате получается растворимая соль

Особые свойства кислот определяются кислотным остатком

Особые свойства кислот определяются кислотным остатком
H 2 SO 4 +BaCl 2 = 2HCL+BaSO 4
Ba 2+ +SO 4 2- =BaSO 4
- Нестабильные кислоты разлагаются
H 2 CO 3 = CO 2 +H 2 O
H 2 SO 3 =SO 2 + H 2 O

Взаимодействие с солями
Ме+ HR → HR + Ме R
Соль + кислота → новая кислота + новая соль
3 Na 2 CO 3 + 2 H 3 PO 4 →2Na 3 PO 4 + 3 H 2 O + 3 CO 2
6Na + + 3CO 3 2- + 6H + + PO 4 3- → 6Na + + 2PO 4 3- + 3H 2 O + 3CO 2
6H + + 3CO 3 2- → 3H 2 O + 3CO 2
Реакция возможна, если в результате образуется осадок, газ или вода.



Литература
- Химия поурочные планы по учебнику О.С. Габриеляна 8 класс. Автор В.Г. Денисова
- Химия О.С. Габриелян 8 класс
- Химия. Настольная книга учителя 8 класс О.С. Габриелян







 30% СРЕДНИЕ 3% СЛАБЫЕ ст. дис. Все щелочи H 2 SO 4 HNO 3 HCl Растворимые соли HF H 2 SO 3 H 3 PO 4 Mg(OH) 2 H 2 CO 3 H 2 SiO 3 HNO 2 NH 4 OH H 2 O " width="640"
30% СРЕДНИЕ 3% СЛАБЫЕ ст. дис. Все щелочи H 2 SO 4 HNO 3 HCl Растворимые соли HF H 2 SO 3 H 3 PO 4 Mg(OH) 2 H 2 CO 3 H 2 SiO 3 HNO 2 NH 4 OH H 2 O " width="640"



































