Государственное профессиональное образовательное учреждение
«Новокузнецкий транспортно-технологический техникум»
Методическая разработка бинарного урока по химии и физике на тему:
«Кислоты как электролиты»
Подготовили:
преподаватель химии Стежко Т.М.
преподаватель физики Титовец И.В.
Новокузнецк, 2022 г.
Аннотация к методической разработке
В методической разработке раскрыта методика проведения урока различными методами и формами: интерактивная урок-лекция с применением проблемных ситуаций и мультимедиа оборудованием. На уроке интерактивная лекция применяются активные методы обучения: разбор проблемных ситуаций, обосновывающих проблематику лекции; обсуждение; проблемные ситуации с демонстрацией графиков, таблиц. Данные методы дают возможность учащимся принимать активное участие в процессе обучения, обмениваться знаниями со своими одноклассниками, отстаивать и представлять свою точку зрения на данную проблему. Кроме того, такие методы обучения позволяют повысить активизацию учащихся, углубить их знания, повысить интерес к изучаемому материалу. Занятие с разными формами и методами обучения помогает учащимся лучше усвоить базовые знания по дисциплине, повысить наглядность обучения, систематизирует усвоенные знания, формирует мотивацию к учению, следовательно, значительно повышает результаты обучения дисциплине «Основы агрохимии». Пояснительная записка. Методика по теме: «Почва. Что такое почва?» написана с целью систематизации учебного материала данной темы. В этой методике раскрыта методика проведения: а) урока - интерактивная лекция- презентация; Важность и актуальность данной темы определяется необходимостью накопления знаний в вопросах формирования использования почвы. Почва является одним из наиболее важных факторов развития сельского хозяйства. В методической разработке показана широкая реализация межпредметных связей, большое внимание уделяется актуализации опорных знаний, так как именно актуализация мотивирует учащихся на освоение знаний, на протяжении всей интерактивной лекции - презентации используется мультимедиосистема, использование слайдов позволяет лучше запомнить информацию и ее конкретизировать . Положительным является и то, что интерактивная лекция – презентация беседы, что позволяет учащимся высказать собственное мнение ,выслушать другие точки зрения и прийти к общему решени
Технологическая карта открытого учебного занятия открыт урока (
| № | Основные пункты технологической карты | Содержание |
| 1 | ФИО преподавателей | Стежко Татьяна Михайловна, Титовец Ирина Владимировна |
| 2 | Наименование дисциплины | Химия, Физика |
| 3 | Номер урока (учебного занятия) | 31 |
| 4 | Группа, специальность | ЭМ-121, 13.01.10 Электромонтер по ремонту и обслуживания электрооборудования (по отраслям)
|
| 5 | Дата проведения | 11.03.2022 |
| 6 | Тема урока (номер) | «Кислоты как электролиты» |
| 7 | Цель занятия (как ожидаемый результат обучения) | Сформировать знания у обучающихся об электролитах и не электролитах, о диссоциации веществ, о строении и свойствах кислот в свете теории электролитической диссоциации. |
| 8 | Задачи (образовательные, развивающие, воспитывающие) | А) образовательная – систематизировать знания обучающихся о химических свойствах кислот; формировать умение записывать химические уравнения с учетом ТЭД, научить обучающихся, используя ряд напряжения металлов и таблицу растворимости, прогнозировать возможность протекания химических реакций с кислотами. Б) развивающая – развивать познавательные способности, мышление, внимание, умения использовать изученный материал для познания нового. В) воспитательная – показать обучающимся необходимость изучения свойств веществ для объяснения различных процессов, происходящих в жизни; воспитать интерес к дисциплинам Химия и Физика |
| 9 | Тип и вид занятия (если выделяется) | Бинарный урок первичного предъявления новых знаний по физике и химии;
|
| 10 | Методы обучения | Словесный: объяснение, беседа с элементами лекции; наглядный: демонстрация (слайдов, опытов продуктов и напитков, содержащих кислоты.); практический: лабораторный опыт; рефлексивный: итоговая рефлексия. |
| 11 | Формы организации | фронтальная, групповая, индивидуальная |
| 12 | Педагогические технологии | ИКТ, игровые технологии, элементы проблемного обучения, здоровье сберегающие технологии. |
| 13 | Формируемые компетенции (общие компетенции (ОК) и профессиональные компетенции (ПК)) | ОК 1. Понимать сущность и социальную значимость своей будущей профессии, проявлять к ней устойчивый интерес. ОК 2. Организовывать собственную деятельность, исходя из цели и способов ее достижения. ОК 3. Анализировать рабочую ситуацию, осуществлять текущий и итоговый контроль, оценку и коррекцию собственной деятельности, нести ответственность за результаты своей работы., ОК 4. Осуществлять поиск и использование информации, необходимой для эффективного выполнения профессиональных задач, профессионального и личностного развития ОК.6 Работать в команде, эффективно общаться с коллегами. |
| 14 | Учебно-методическое оснащение урока | Презентация по теме: "Кислоты как электролиты", инструкции к практической работе, пробирки, набор реактивов, индикаторы, таблицы «Степени окисления», стихи, загадки, отрывок поэмы «Ленинские горы», музыкальное сопровождение, ЛОК, оценочная таблица, демонстрационный материал: фрукты, напитки и моющие средства, содержащие кислоты. |
| 15 | Междисциплинарные и межкурсовые связи | Физика, Химия, ОБЖ, Математика. |
| 16 | Образовательные ресурсы (в том числе Internet) | 1. Габриелян О.С. Химия. 8 класс, [Текст]: учебник для общеобразовательных учреждений: базовый уровень. -6-е изд., М.: Дрофа,2016. 2. Габриелян О.С., И.П.Воскобойникова, [Текст]: Настольная книга для учителя., М.: Дрофа, 2002 г. 3. Трофимова Т.И., Фирсов А.В. Физика для профессий и специальностей технического и естественнонаучного профилей [Текст]: учебник для студентов учреждений сред. Проф. образования /Т.И. Трофимова, А.В. Фирсов. – 4-е изд., стр. – М.: Издательский центр “Академия”, 2018. – 288 с. 4.«Федеральный институт педагогических измерений» (банк открытых заданий) http://www.fipi.ru/content/otkrytyy-bank-zadaniy-ege
|
Структура и содержание занятия
| Этапы занятия | Длительность этапа (мин) | Планируемые результаты | Критерии и способ оценки | Содержание деятельности преподавателя | Содержание деятельности студента |
| 1.Организационный момент | 2 | Настрой на работу |
| Предлагают студентам занять рабочие места; Взаимное приветствие преподавателей и студентов; Создание атмосферы доброжелательности. | Занимают свои места. Приветствуют преподавателей. Докладывают количество отсутствующих |
| 2.Мотивация учебной деятельности студентов. Постановка цели и задач урока.
| 5 | Интерес к теме урока | Сотрудничество Оценка процесса | Организуют работу студентов. Читают отрывок поэмы «Ленинские горы», объясняют взаимосвязь химии и физики. Читают загадки для определения темы обучающимися. В форме подводящего диалога подводят студентов к формулированию темы урока. Обобщают высказывания обучающихся и объявляют тему урока. Задают наводящие вопросы, для формулировки цели урока.. | Слушают преподавателя, отвечают на вопросы. Анализируют строки "поэмы". Отгадывают загадки;
Формулируют тему урока.
Формулируют цель урока вместе с преподавателем. Записывают тему урока в ЛОК |
| 3.Актуализация знаний | 2 | Подготовка к работе, к восприятию нового материала | Сотрудничество Оценка процесса | Объясняют практическую значимость темы урока в будущем.
| Слушают, отвечают на вопросы |
| 4.Первичное усвоение новых знаний | 30 | Определение, формулы кислот и их свойства, электролиты и не электролиты, теория электролитической диссоциации. | Сотрудничество Оценка процесса | Рассказывают план работы на уроке и систему оценивания. Объясняют новую тему по плану: 1.Определение кислот. 2.Формулы кислот. 3.Классификация. 4.Физические свойства. 5.Электролиты и не электролиты 6.Электролитическая диссоциация 7.Положение ТЭД 8.Степень диссоциации 9.Кислоты с точки зрения ТЭД 10.Химические свойства. 11.Применение кислот. Ведут беседу, задают вопросы обучающимся. | Слушают, задают вопросы.
Работают с ЛОК, записывают новую информацию.
Отвечают на вопросы преподавателей, беседуют.. |
| 5.Первичная проверка понимания | 25 | Изучение химических свойств кислот как электролитов | Бально-рейтинговая оценка Групповая работа обучающихся. | Преподаватель делит класс на группы. Проводит инструктаж выполнения лабораторных опытов, напоминает о правилах техники безопасности. Создает проблемную ситуацию. Раздает инструкции и зачитывает проблемные вопросы: 1. Почему нельзя варить кислые щи, борщ или компот из свежих ягод в алюминиевой кастрюле? 2.Почему металлические конструкции в природе постепенно разрушаются. Все ли металлы подвергаются такому разрушению? 3.Известно, что гашеная известь, входит в состав штукатурки, стеновых покрытий, строительных материалов. Устойчива ли она к действию кислот? 4. Почему после того, как вы съели кислое яблоко, нельзя чистить зубы? 5.Как определить наличие кислот в пище и напитках? Контролирует проведение опытов, оказывает помощь в проведении. Заслушивает отчет и выводы обучающихся к лабораторным опытам, оценивает работу групп. Задает вопросы, подводит обучающихся к формулировке химических свойств кислот. Собирает листы с оформленными лабораторными опытами.
Обобщает и делает выводы о свойствах кислот.
Демонстрирует слайды применение кислот Заслушивают докладчиков «История развития кислот» | Объединяются в группы. Повторяют правила техники безопасности при работе с кислотами. Получают инструкции с алгоритмом работы в группе и проблемным вопросом для каждой группы. Работают в группах, проводят лабораторные опыты по инструктивным картам.
Предоставляют отчет по работе Формулируют химические свойства кислот. Сдают листы с оформленными лабораторными опытами и выводами по работе. Записывают химические свойства кислот. Выступают с докладами. |
| 6. Первичное закрепление. | 12 | Сформированные знания по теме | Бально- рейтинговая система оценки. Сотрудничество Оценка процесса | Проводит игру -викторину с заданиями по химии и физике: «Кислоты» «Электролиты» «Опыты» | Отвечают на вопросы викторины по командам (1,2,3 ряд)
|
| 7. Домашнее задание | 2 | Закрепление материала | Формирующее, развивающее оценивание | Предлагают д/з, объясняют ход выполнения: -
составить кроссворд из 10 слов по теме «Кислоты» -
Написать мини-сказку из 10 предложений по теме «Электролиты». | Слушают, задают вопросы. |
| 8. Рефлексия | 2 | Анализ собственной деятельности и полученных знаний | Формирующее, развивающее оценивание | Преподаватели обобщают материал, формулируют выводы по теме. Предлагают студентам прикрепить разноцветные кружки к «Дереву Успеха» и поставить оценки в баллах Акцентируют внимание на конечных результатах деятельности студентов на уроке, выставляют оценки за урок. Благодарят за работу, прощаются с обучающимися |
Прикрепляют разноцветные кружки к дереву, выставляют оценки за урок: себе, группе, преподавателю. Прощаются с преподавателями |
План-конспект бинарного урока по физике и химии на тему
«Кислоты как электролиты»
«Просто знать еще не все,
знания надо уметь использовать».
Гете.
1.Организационный этап (2 мин): здравствуйте, ребята, садитесь. Кто отсутствует на уроке? Все готовы к уроку? У всех есть тетради ручки?
2.Мотивация учебной деятельности студентов. Постановка цели и задач урока (5 мин).
Преподаватель химии: сегодня мы проведем необычный урок, а урок физики и химии в одном. Данный урок называется бинарным.
Я предлагаю прослушать строчки из поэмы М.Алигери «Ленинские горы»
Преподаватели по очереди читают отрывок поэмы:
«О, физика, наука из наук!
Все впереди! Как мало за плечами!
Пусть химия нам будет вместо рук,
Пусть станет математика очами.
Не разлучайте этих трех сестер
Познания всего в подлунном мире,
Тогда лишь будет ум и глаз остер
И знание человеческое шире».
Преподаватель физики: как вы понимаете данные строки? А в чем же связь двух наук? Как вы думаете?
Преподаватель химии: вся история взаимодействия химии я физики полна примеров обмена идеями, объектами и методами исследования. Связь эта носит генетический характер. Химия и физика изучают практически одни и те же объекты, но только каждая из них видит в этих объектах свою сторону, свой предмет изучения. Т.О. 2 науки непрерывно дополняют друг друга.
Как сказал М.В.Ломоносов: «Химия — это правая рука физики».
Преподаватель физики: и сегодня мы объединим две темы по двум предметам в одно целое. А какие темы? Попробуйте догадаться сами.
Преподаватель химии: мы будем изучать определенный класс соединений, а какой?
1. В составе кока-колы присутствует данное вещество. Популярный напиток широко применяется для очистки канализации, заржавевших болтов.
2. Это вещество, выделяемое муравьями в момент опасности, служит сигналом для всех остальных особей этого вида и является средством защиты при нападении хищников.
3. С древнейших времен люди разводили виноград и запасали впрок виноградный сок. При хранении в сосудах сок бродил, получалось вино. Иногда вино скисало и превращалось в уксус. Впоследствии его научились использовать как лекарство, приправу к пище, растворитель красок. О чем речь?
Отгадайте данный класс (читает загадки):
«Этих веществ очень много на свете,
Их опасаются взрослые, дети!
Если не так их смешаешь с водой,
Может все обернуться бедой!»
Преподаватель химии: да, ребята, мы сегодня действительно познакомимся с одним из классов «Неорганических соединений» – кислотами. «Кислоты…» — это первая часть формулировки нашей темы. А какова же вторая?
Преподаватель физики:
Мы с тобой – два электрода,
Между нами жизнь, природа,
Медный купорос небес.
…. процесс.
О каком процессе идет речь? Верно, электролиз! А где протекает данный процесс? В каких веществах? В электролитах, правильно! Итак, тема нашего урока «Кислоты как электролиты».
Преподаватель химии: А какова цель нашего урока? Подумайте и сформулируйте. Что мы должны изучить и закрепить?
Опорные слова: сформировать, расширить, углубить. Обобщив высказывания, давайте сформулируем цель урока:
сформировать знания об электролитах и не электролитах, о диссоциации веществ, о строении и свойствах кислот в свете теории электролитической диссоциации.
Работать будем и индивидуально, и в группах, осуществляя химический эксперимент, и самостоятельно на этапе закрепления знаний
Оценивать будем работу на каждом этапе урока по оценочному листу по бальной системе, в конце, при подведении итогов, выставим оценку за урок наиболее активным ребятам и за «Задания на закрепления-игра викторина». Выполненные эксперименты вы оформите на листах и сдадите на проверку. За данную групповую работу оценка будет озвучена на следующем уроке.
3.Актуализация знаний (2 мин):
Преподаватель физики: Ребята а для чего нам нужно знать кислоты и электролиты? Где в дальнейшем будут полезны знания, полученные на уроке? Кислоты окружают нас повсюду: и в природе, и в быту, даже в нашем организме присутствуют кислоты. А какие?Вы должны знать их свойства, правила работы с кислотами, влияние на организм человека. А так как кислота является электролитом, значит знание свойств кислот как электролитов, будут полезны в дальнейшем при изучении темы по физике «Токи в жидкостях» и «Электролиз».
4.Первичное усвоение новых знаний (25 мин):
Преподаватель химии: Работать сегодня будем не в тетрадях, а в «Логических опорных конспектах»(ЛОК) темы, вы их вклеите в тетрадь. В ЛОК есть план изучения темы, определенная информация пропечатана, что то нужно будет заполнить по ходу урока. (приложение 1)
Итак, в ЛОК Запишите тему урока: «Кислоты как электролиты»
Изучать тему будем по плану :
1.Определение кислот.
2.Формулы кислот.
3.Классификация.
4.Физические свойства.
5.Электролиты и не электролиты
6.Электролитическая диссоциация
7.Положение ТЭД
8.Степень диссоциации
9.Кислоты с точки зрения ТЭД
10.Химические свойства.
11.Применение кислот.
Преподаватель химии: вот они кислоты: лимон, аскорбинка, уксусная кислота, яблоко.
Так что же такое кислоты? Что это за вещества? Почему так названы? Какие они на вкус? Где мы встречаемся с кислотами в природе?
«Кислота» - кислые на вкус, отсюда и название. «От кислых яблок – сразу кисну». В.Шекспир
– Что же объединяет все эти кислоты, кроме кислого вкуса?
1.Дадим определение:
«Кислоты — это вещества, состоящие из водорода и кислотного остатка».
2. Обратимся к составу кислот, посмотрим на формулы:
| НСl– соляная кислота | H2S-сероводородная кислота |
| HNO3– азотная кислота | HI-йод водородная кислота |
| H2SO4– серная кислота | HBr-бром водородная кислота |
| H2CO3– угольная кислота | H2SiO3-кремниевая кислота |
| H3PO4 – фосфорная кислота |
|
«Мы состоим из двух частей:
Во первых, водород-о,кей
Во вторых, остаток наш,
Вот и весь наш экипаж!»
3.Классификация кислот:
Делятся на органические и неорганические
По какому признаку разделены кислоты?
А. по количеству водорода: 1-основные, 2-основные, 3-основные.
По какому признаку разделены кислоты?
Б. по наличию водорода: бескислородные, кислородсодержащие.
В. По состоянию: жидкие, твердые.
4.Физические свойства:
Кислоты могут быть жидкие, твердые вещества, растворимые в воде (кроме H2SiO3), вызывают ожоги! Опасны! Проводят электрический ток! Значит являются электролитами.
Преподаватель физики: А что же такое электролиты и не электролиты?
Понятие электролитов и не электролитов впервые ввёл М. Фарадей в первой половине 19 века.
5.Электролиты-вещества, растворы или расплавы которых проводят электрический ток.
Электролитами являются вещества с сильно полярной ковалентной или ионной связью. К ним относятся соли, щёлочи, кислоты.
Неэлектролиты - вещества, растворы или расплавы которых не проводят электрический ток.
А что такое электролитическая диссоциация?
Почему растворы кислот, солей и щелочей проводят электрический ток.
Почему температура кипения раствора электролита всегда будет выше, чем температура кипения раствора не электролита той же концентрации.
Сванте Аррениус: В 1887 году шведский физико-химик Сванте Аррениус, исследуя электропроводность водных растворов, высказал предположение, что в таких растворах вещества распадаются на заряженные частицы – ионы, которые могут передвигаться к электродам – отрицательно заряженному катоду и положительно заряженному аноду.
Это и есть причина электрического тока в растворах. Данный процесс получил название 6.электролитической диссоциации (дословный перевод – расщепление, разложение под действием электричества). Такое название также предполагает, что диссоциация происходит под действием электрического тока.
Дальнейшие исследования показали, что это не так: ионы являются только переносчиками зарядов в растворе и существуют в нем независимо от того, проходит через раствор ток или нет. При активном участии Сванте Аррениуса была сформулирована теория электролитической диссоциации, которою часто называют в честь этого ученого. Основная идея данной теории заключается в том, что электролиты под действием растворителя самопроизвольно распадаются на ионы. И именно эти ионы являются носителями заряда и отвечают за электропроводность раствора.
Электрический ток - это направленное движение свободных заряженных частиц. Вы уже знаете, что растворы и расплавы солей и щелочей электропроводны, так как состоят не из нейтральных молекул, а из заряженных частиц – ионов. При расплавлении или растворении ионы становятся свободными переносчиками электрического заряда.
7.Теорию электролитической диссоциации можно представить в виде следующих положений.
-
При растворении в воде электролиты диссоциируют (распадаются) на ионы.
Свойства ионов отличаются от свойств атомов или группы атомов, из которых они образовались.
-
Причиной диссоциации электролита в водном растворе является его гидратация, т. е. взаимодействие электролита с молекулами воды и разрыв химической связи в нём.
В растворе ионы существуют в гидратированном виде, в отличие от безводных солей, в которых ионы негидратированные.
-
Под действием электрического тока катионы движутся к отрицательному полюсу источника тока — катоду, а анионы — к положительному полюсу источника тока — аноду.
-
Химические свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при диссоциации.
Количественной характеристикой диссоциации электролита является степень диссоциации.
Степень диссоциации – это отношение числа частиц, распавшихся на ионы (Nд), к общему числу растворенных частиц (NP):
α=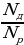
Степень диссоциации электролита определяется опытным путем и выражается в долях или процентах. Если α=0, то диссоциация отсутствует, а если α=1, или 100%, то электролит полностью распадается на ионы. Различные электролиты имеют различную степень диссоциации, то есть степень диссоциации зависит от природы электролита. Она также зависит и от концентрации: с разбавлением раствора степень диссоциации увеличивается.
По степени электролитической диссоциации электролиты разделяют на сильные и слабые.
Сильные электролиты – такие электролиты, которые при растворении в воде практически полностью диссоциируют на ионы. У таких электролитов значение степени диссоциации стремится к единице.
К сильным электролитам относятся:
1) все растворимые соли;
2) сильные кислоты, например: H2SO4, HCl, HNO3;
3) все щелочи, например: NaOH, KOH.
Слабые электролиты – это такие электролиты, которые при растворении в воде почти не диссоциируют на ионы. У таких электролитов значение степени диссоциации стремится к нулю.
К слабым электролитам относятся:
1) Слабые кислоты – H2S, H2CO3, HNO2;
2) водный раствор аммиака NH3*H2O;
3) вода.
8.Степень диссоциации зависит от природы электролита, его концентрации, природы растворителя, температуры.
Степень диссоциации может изменяться от 0 до 1, т. е. от 0 до 100%. Если степень диссоциации равна 0%, это означает, что диссоциации вещества не происходит. Если степень диссоциации равна 100%, это означает, что вещество полностью диссоциирует на ионы.
В зависимости от значения степени диссоциации различают сильные и слабые электролиты.
Преподаватель химии: при диссоциации кислот образуются катионы водорода и анионы кислотного остатка.
HNO3 → H+ NO3
HCl → H + Cl-
Многоосновные кислоты диссоциируют ступенчато.
Н3РО4 ↔ Н+ + Н2РО4 (первая ступень)
Н2РО4 ↔ Н+ НРO4 (вторая ступень)
НРО4 ↔ Н+ PО4 (третья ступень)
9.Т.е. с точки зрения ЭД Кислоты — это электролиты, при диссоциации которых образуются катионы водорода и анионы кислотного остатка.
10.Химические свойства:
Чтобы перейти к химическим свойствам кислот, нам нужно повторить технику безопасности при работе с кислотами .
Назовите мне «4 не» при работе с кислотами (не пробовать, не разливать, не нюхать!)
Преподаватель химии: как вы думаете, какими химическими свойствами будут обладать кислоты?
-Как кислоты окрашивают цвета индикаторов?
-Давайте вспомним, какие вещества существуют в природе?
Ответы: соли, металлы, неметаллы, оксиды, щелочи.
-Как вы думаете, с какими из них могут взаимодействовать кислоты?
-Предположите свойства кислот.
5.Первичная проверка понимания (25 мин)–«химический эксперимент»:
Преподаватель химии: предлагаю химические свойства изучить самостоятельно, работая в группах.
Каждая группа получает инструктивную карту (всего 6 карт, содержащих по одному вопросу), выполняют по ней экспериментальную задачу, отвечают на вопросы, пишут уравнения и делают выводы. (приложение 2):
1. Устойчива ли гашеная известь к действию кислот?
2. Почему нельзя варить компот в алюминиевой кастрюле?
3. Почему металлические конструкции в природе постепенно разрушаются?
4. Почему после того, как вы съели кислое яблоко, нельзя чистить зубы?
5.Как определить наличие кислот в продуктах питания и в напитках?
6.Почему кока-колу рекомендуют употреблять после приема пищи?
Обучающиеся работают в группах под руководством преподавателей, выполняя химический эксперимент. Предоставляют отчет о проделанной работе.
Преподаватель химии: итак, мы с вами выяснили и подтвердили, что кислоты взаимодействуют с металлами, основаниями, солями, изменяют цвета индикаторов.
Почему проходит реакция с данными веществами, какой ион вступает в реакцию? Правильно, ион водорода.
11. Применение:
1.Удобрения.
2.электролит.
3.паяние.
4.в лечебных целях.
5.в пищевой промышленности.
Вывод: 1.Кислота – это сложное вещество, в молекуле которого имеется один или несколько атомов водорода и кислотный остаток. 2.Кислоты классифицируются по 4 признакам.3.Кислоты реагируют с металлами, солями, основаниями.
6. Первичное закрепление (12 мин.): игра-викторина
Преподаватель физики: а сейчас проведем игру-викторину по номинациям
«Кислоты»
«Электролиты»
«Опыты».
Каждый правильный ответ-1 балл. Обучающийся, набравший 3 балла, получает «5», 2 балла-«4», 1 балл-«3».
Начнем мини-игру!
7.Домашнее задание (2 мин.): 1.Составить кроссворд по теме «Кислоты»
2.Написать мини -сказку из 10 предложений по теме: «Электролиты».
8.Итог урока. Рефлексия (2 мин):
1. обучающиеся оценивают работу по критериям: «Я, Группа, Преподаватель» - по 5-бальной шкале.
2.«Дерево успеха»-зеленые, оранжевые, красные «Яблоки».
Прикрепите к дереву «Яблоки»-зеленое, если все понятно и урок понравился. Оранжевое, если были затруднения. Розовое, если ничего не понятно, урок не понравился.
Мы видим, что урок прошел на позитивной ноте. Спасибо за работу на уроке. До свидания!
Приложение 1.
ЛОК урока по химии и физике на тему «……………………………………………………………»
1.Кислоты -вещества, состоящие из атомов водорода и кислотного остатка.
2.Формулы кислот- выучить!
| НСl– соляная кислота | H2S-сероводородная кислота |
| HNO3– азотная кислота | HI-йод водородная кислота |
| H2SO4– серная кислота | HBr-бром водородная кислота |
| H2CO3– угольная кислота | H2SiO3-кремниевая кислота |
| H3PO4 – фосфорная кислота |
|
3.Класификация кислот:…………………………………………………………………………………………………………………………………
………………………………………………………………………………………………………………………………………………………………
4. Физические свойства кислот…………………………………………………………………………………………………………………………
5. Электролиты-……………………………………………………………………………………………………………..............................................
А. Сильные электролиты - ………………………………………………………………………………………………………………………………...
Б. Слабые электролиты - ………………………………………………………………………………………………………………………………….
В.Неэлектролиты-………………………………………………………………………………………………………………………………………….
6.Электролитическая диссоциация - …………………………………………………………………………………………………………………..
7.Положения ТЭД:1. При растворении в воде электролиты диссоциируют (распадаются) на ионы.
2.Причиной диссоциации электролита в водном растворе является его гидратация, т. е. взаимодействие электролита с молекулами воды и разрыв химической связи в нём.
3.Под действием электрического тока катионы движутся к отрицательному полюсу источника тока — катоду, а анионы — к положительному полюсу источника тока — аноду.
4.Химические свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при диссоциации.
8.Степень диссоциации……………………………………………………………………………………………………………………
9.Кислоты (с точки зрения ТЭД) — это…………………………………………………………………………………………………
………………………………………………………………………………………………………………………………………………..
10.Химические свойства: кислоты взаимодействуют с…………………………………………………………………………………
………………………………………………………………………………………………………………………………………………..
11.Применение кислот:……………………………………………………………………………………………………………………
Приложение 2.
Инструктивная карта №1
Группа №1:…………………………………………………………………
Проблемный вопрос: почему металлические конструкции в природе постепенно разрушаются. Все ли металлы подвергаются такому разрушению?
Опорные знания: взаимодействие кислот с металлами, электрохимический ряд напряжений (ряд активности) металлов, реакции замещения.
Цель эксперимента: исследовать действие кислот на различные металлы.
Ход эксперимента:
1. В первую пробирку с 1 мл. соляной кислоты поместить железный порошок. Что наблюдаете?
2. Во вторую пробирку с 1-2 мл. соляной кислоты поместите гранулу цинка. Что наблюдаете?
Заполните таблицу:
| Название кислоты | Металл | Наблюдения | Уравнения реакции в молекулярном и ионном виде |
| 1.Соляная кислота
| Fe |
| Fe+HCl=…………………………
|
| 2.Соляная кислота | Zn
|
| Zn+HCl=……………………….
|
Сделайте вывод о взаимодействии кислот с металлами. С какими металлами взаимодействуют кислоты?....................................................
Критерии оценивания: без ошибок выполненные и оформленные опыты- 5 баллов,
1-2 ошибки-4 балла, 3-4 ошибки-3 балла, более 4 ошибок-2 балла.
Приложение 2.
Инструктивная карта №2
Группа №2……………………………………………………………………
Проблемный вопрос: почему в алюминиевой кастрюле нельзя варить кислые щи или компот из свежих ягод?
Опорные знания: алюминий, из которого изготовлена кастрюля, покрыт неядовитой оксидной пленкой. Типы реакций.
Цель эксперимента: определить, будет ли реагировать оксид алюминия с кислотами.
Ход эксперимента:
1. В первую пробирку с 1-2 мл Серной кислоты добавьте немного оксида алюминия, Что наблюдаете?
2. Во вторую пробирку с 1-2 мл Соляной кислоты добавьте немного оксида алюминия, Что наблюдаете?
Заполните таблицу:
| Кислота | Оксид алюминия | Наблюдения | Уравнения реакции |
| 1.Серная кислота | AL2O3
|
| AL2O3+H2SO4=………………………
|
| 2.Соляная кислота | AL2O3
|
| AL2O3+HCl=………………………….
|
Сделайте вывод о взаимодействии кислот с оксидами металлов………………………….……………………………………
Критерии оценивания: без ошибок выполненные и оформленные опыты- 5 баллов,
1-2 ошибки-4 балла, 3-4 ошибки-3 балла, более 4 ошибок-2 балла.
Приложение 2.
Инструктивная карта №3
Группа №3:………………………………………………………………………
Проблемный вопрос: известно, что гашеная известь, входит в состав штукатурки, стеновых покрытий, строительных материалов. Устойчива ли она к действию кислот?
Опорные знания: гашеная известь Сa (OH)2; взаимодействие кислот с основаниями, реакция нейтрализации, реакции обмена.
Цель эксперимента: определить, будет ли реагировать гашеная известь с кислотами.
Ход эксперимента:
1.В первую пробирку с 1-2 мл. гидроксида кальция Сa (OH)2 добавьте соляной кислоты. Что наблюдаете?
2. Во вторую пробирку с 1-2 мл гидроксида кальция Са(OH)2 прилейте немного серной кислоты. Что наблюдаете?
Заполните таблицу:
| Кислота | Основание | Наблюдение | Уравнение реакции в молекулярном и ионном виде |
| 1.Соляная кислота | Сa(OH)2 |
| Сa (OH)2+ HCl=………………………………….
|
| 2.Серная кислота
| Са(OH)2 |
| Сa (OH)2+ H2SO4=…………………………………..
|
Сделайте вывод о взаимодействии кислот с основаниями……………………………………………………………………
Критерии оценивания: без ошибок выполненные и оформленные опыты- 5 баллов,
1-2 ошибки-4 балла, 3-4 ошибки-3 балла, более 4 ошибок-2 балла.
Приложение 2.
Инструктивная карта №4
Группа №4:……………………………………………………………………
Проблемный вопрос: почему после того, как вы съели кислое яблоко, нельзя чистить зубы?
Опорные знания: В состав эмали зубов входят соли: карбонаты и фосфаты кальция (Сa CO3, Сa3 (PO4)2 ); угольная кислота неустойчивая, разлагается на воду и углекислый газ.
Цель эксперимента: определить, как реагируют соли с кислотами.
Ход эксперимента:
1.В первую пробирку с соляной кислотой добавьте кусочек карбоната кальция. Что наблюдаете?
2. Во вторую пробирку с серной кислотой добавьте кусочек карбоната кальция. Что наблюдаете?
Заполните таблицу:
| Кислота | соль | наблюдения | Уравнения реакции в молекулярном и ионном виде |
| 1.Соляная кислота
| СaCO3
|
| СaCO3 + HCl=………………………………….
|
| 2.Серная кислота
| СaCO3 |
| СaCO3 +H2SO4=………………………………..
|
Сделайте вывод о взаимодействии кислот с солями……………………………………..
Критерии оценивания: без ошибок выполненные и оформленные опыты- 5 баллов,1-2 ошибки-4 балла, 3-4 ошибки-3 балла, более 4 ошибок-2 балла.
Приложение 2.
Инструктивная карта №5
Группа №5:……………………………………………………………………
Проблемный вопрос: как можно определить наличие кислот в продуктах питания и напитках? (пробовать на вкус запрещено!!!)
Опорные знания: индикаторы, окрашивание индикатора в различные цвета.
Цель эксперимента: определить, как изменяется цвет индикатора при взаимодействии с кислотами.
Ход эксперимента:
1.В первую пробирку с содержимым опустите лакмусовую бумажку. Что наблюдаете?
2. Во вторую пробирку с содержимым добавьте фенолфталеин. Что наблюдаете?
3.В 3 пробирку с содержимым добавьте фенолфталеин. Что наблюдаете?
Заполните таблицу:
| Кислота | индикатор | наблюдения | Диссоциация веществ |
| 1.Соляная кислота | Лакмусовая бумага
|
| HCl= |
| 2.Серная Кислота
| Фенолфталеин |
| H2SO4= |
| 3.Шелочь | Фенолфталеин |
| NaOH= |
Сделайте вывод о смене окраски индикаторов в кислой и щелочной средах………………………………………………………
Критерии оценивания: без ошибок выполненные и оформленные опыты- 5 баллов,
1-2 ошибки-4 балла, 3-4 ошибки-3 балла, более 4 ошибок-2 балла.
Приложение 2.
Инструктивная карта №6
Группа №6:…………………………………………………………………
Проблемный вопрос: почему напитки Фанта и Кока-кола рекомендуют употреблять после приема пищи?
Опорные знания: индикаторы, окрашивание индикатора при реакции с кислотой, содержание ортофосфорной кислоты в напитках.
Цель эксперимента: определить, как изменяется цвет индикатора при взаимодействии с Соляной кислотой и образцом напитка Кока-кола.
Ход эксперимента:
1.В первую пробирку с Соляной кислотой (HCl) опустите лакмусовую бумажку. Что наблюдаете? Распишите диссоциацию веществ.
2. Во вторую пробирку с напитком Кока-кола опустите лакмусовую бумажку. Что наблюдаете? Составьте многоступенчатую диссоциацию фосфорной кислоты.
Заполните таблицу:
| Кислота | индикатор | наблюдения | Диссоциация веществ |
| 1.Соляная кислота (HCl) | Лакмусовая бумага
|
|
HCl= |
| 2.Кока-кола (H3PO4) | Лакмусовая бумажка |
| H3РO4= |
Сделайте вывод о смене окраски индикаторов в соляной кислоте и напитке Кока-кола………………………………………………………………………………………….
Критерии оценивания: без ошибок выполненные и оформленные опыты- 5 баллов,1-2 ошибки-4 балла, 3-4 ошибки-3 балла, более 4 ошибок-2 балла.