Тема: Количество теплоты. Удельная теплоемкость
Цель: дать понятие количества теплоты и удельной теплоемкости вещества
1. Количество теплоты. Единицы количества теплоты
Пути изменения внутренней энергии тела:
1) Совершение работы (например, трение).

Если работа совершается над телом, его внутренняя энергия увеличивается, а если работу совершает само тело, то его внутренняя энергия уменьшается.
2) Теплопередача (без совершения работы):
а) теплопроводность — передача внутренней энергии от одной части тела к другой или от одного тела к другому при их непосредственном контакте;
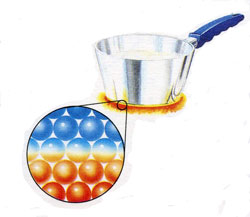
б) конвекция — перенос теплоты в жидкостях, газах или сыпучих средах потоками самого вещества (вынужденно или самопроизвольно);

3) излучение — испускание и распространение энергии в виде волн и частиц.

Энергия, которую получает или теряет тело при теплопередаче, называется количеством теплоты.
Количество теплоты, которое необходимо для нагревания тела (или выделяемое им при остывании), зависит:
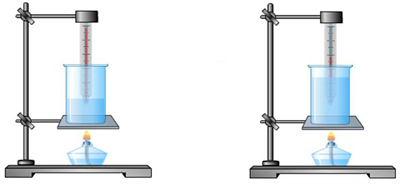
1) От массы тела.
Пример:
При нагревании 2 кг воды потребуется в 2 раза большее количество теплоты, чем при нагревании 1 кг воды на то же число градусов.
Обрати внимание!
Чем больше масса тела, тем большее количество теплоты надо затратить, чтобы изменить его температуру на одно и то же число градусов.
При остывании тело передаёт окружающим предметам тем большее количество теплоты, чем больше его масса.
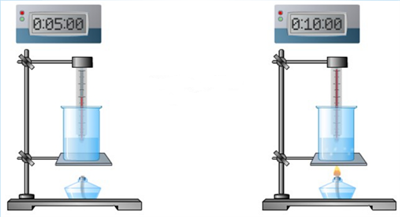
2) От того, на сколько градусов нагревается тело (от разности температур тела).
Пример:
При нагревании воды на 5°С необходимо в 2 раза меньшее количество теплоты, чем при нагревании этой же воды на 10°С.
Обрати внимание!
Чем больше разность температур тела, тем большее количество теплоты необходимо для его нагревания.
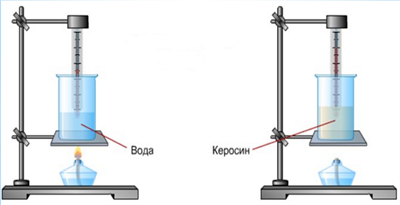
3) От того, из какого вещества тело состоит, т.е. от рода вещества тела.
Пример:
При нагревании керосина и воды одинаковой массы на одно и то же число градусов требуется разное количество теплоты. Для нагревания керосина необходимо в 2 раза меньшее количество теплоты, чем для нагревания воды.
Обрати внимание!
Количество теплоты обозначают буквой Q и измеряют, как работу и энергию, — в джоулях (Дж).
Применяют кратные и дольные единицы измерения количества теплоты. Например:
1 МДж =1000000 Дж;
1 кДж =1000 Дж;
1 мДж =0,001 Дж.
2. Измерение количества теплоты
Измерять количество теплоты учёные стали задолго до того, как в физике появилось понятие энергии. Тогда была установлена особая единица для измерения количества теплоты — калория (кал).
Калория — это количество теплоты, которое необходимо для нагревания 1 г воды на 1°С.
1 кал =4,19 Дж ≈4,2 Дж.
Термин «калория» (от латинского «calor» — тепло) ввёл в научный оборот французский химик Николя Клеман-Дезорм (1779—1842).
Его определение калории как единицы измерения тепла было впервые опубликовано в 1824 году в журнале «Le Producteur», а во французских словарях оно появилось в 1842 году.
Однако задолго до появления этого термина были сконструированы первые калориметры — приборы для измерения теплоты.
Первый калориметр изобрёл английский химик Джозеф Блэк и в 1759—1763 годах с его помощью определил теплоёмкости разных веществ, скрытую теплоту плавления льда и испарения воды.

Джозеф Блэк
Изобретением Д. Блэка воспользовались знаменитые французские учёные Антуан Лоран Лавуазье (1743—1794) и Пьер Симон Лаплас (1749—1827).

Антуан Лоран Лавуазье

Пьер Симон Лаплас
В 1780 году они начали серию калориметрических экспериментов, которые позволили измерить тепловую энергию.
Это понятие встречается ещё в XVIII веке в трудах шведского физика Иоганна Карла Вильке (1732—1796), который занимался исследованием электрических, магнитных и тепловых явлений и задумывался об эквивалентах, в которых можно измерять тепловую энергию.

Иоганн Карл Вильке
Устройство, которое впоследствии начали называть калориметром, Лавуазье и Лаплас использовали, чтобы измерять количество теплоты, выделяющееся в различных физических, химических и биологических процессах. Тогда ещё не было точных термометров, поэтому для измерения теплоты приходилось идти на ухищрения.

Первый калориметр был ледяным. Внутренняя полая камера, куда помещали объект, излучающий тепло (например, мышку), была окружена рубашкой, заполненной льдом или снегом. А ледяная рубашка, в свою очередь, была окружена воздушной, чтобы лёд не плавился под действием внешнего нагрева. Тепло от объекта внутри калориметра нагревало и плавило лёд. Взвешивая талую воду, стекавшую из рубашки в специальный сосуд, исследователи определяли теплоту, выделенную объектом.
Этот прибор позволил Лавуазье и Лапласу измерить теплоту многих химических реакций: сгорания угля, водорода, фосфора, чёрного пороха. Своими работами они заложили основы термохимии и сформулировали её основной принцип:
Всякие тепловые изменения, которые испытывает какая-нибудь материальная система, переменяя своё состояние, происходят в обратном порядке, когда система вновь возвращается в своё первоначальное состояние.
Иными словами, чтобы разложить воду на водород и кислород, надо затратить столько же энергии, сколько выделяется при реакции водорода с кислородом с образованием воды.
В том же 1780 году Лавуазье поместил в калориметр морскую свинку. Тепло от её дыхания растапливало снег в рубашке. Потом последовали и другие эксперименты, которые имели огромное значение для физиологии.
Тогда-то Лавуазье высказал мысль, что дыхание животного подобно горению свечи, за счёт которого в организме поддерживается необходимый запас тепла. Он также впервые связал три важнейшие функции живого организма: дыхание, питание и транспирацию (испарение воды). Видимо, с тех пор и заговорили о том, что пища сгорает в нашем организме.
В XIX веке благодаря стараниям знаменитого французского химика Марселена Бертло (1827—1907), который опубликовал более 200 работ по термохимии, точность калориметрических методов сильно повысилась и появились более совершенные приборы — водяной калориметр и герметичная калориметрическая бомба.

Марселен Бертло
Последний прибор нам особенно интересен, потому что в нём можно измерять теплоту, выделяемую при очень быстрых реакциях — горении и взрыве.
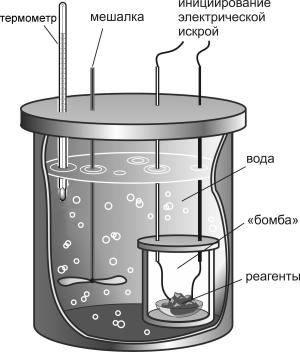
Навеску сухого исследуемого вещества насыпают в тигель, помещают внутри бомбы и герметично закрывают этот сосуд. Затем вещество поджигают электрической искрой. Оно сгорает, отдавая тепло воде в окружающей его водяной рубашке. Термометры позволяют точно фиксировать изменение температуры воды.
В похожем калориметре в тридцатых годах XIX века проводил первые опыты с пищей знаменитый немецкий химик Юстус фон Либих (1803—1873), который разделял идеи Лавуазье о том, что пища — это топливо для организма, как дрова для печки.

Юстус фон Либих

Юлиус фон Майер
Либих назвал эти дрова: белки, жиры и углеводы. Он сжигал навески пищи в калориметре и измерял выделившееся тепло. На основании результатов этих опытов Либих вместе со своим коллегой Юлиусом фон Майером составил первые в мире таблицы калорийности продуктов питания и на их основе попытался рассчитать научно обоснованный рацион для прусских солдат.
Знаменитым последователем Юстуса фон Либиха стал американский агрохимик Уилбур Олин Этуотер (1844—1907).

Уилбур Олин Этуотер
Этуотер первым додумался измерять энергоёмкость компонентов пищи и придумал схему подсчёта калорийности любых продуктов питания. Ему не пришлось начинать с нуля. Три года (1869—1871) Этуотер провёл в Германии, где изучал опыт европейских коллег-агрохимиков. Здесь он не только вдохновился идеями физиологической калориметрии, посеянными Либихом, но и освоил некоторые методики эксперимента.
Сегодня Этуотера называют отцом диетологии. Значения калорийности углеводов (4 ккал/г), белков (4 ккал/г) и жиров (9 ккал/г) впервые экспериментально получил Этуотер. Но и теперь, спустя сто двадцать лет, диетологи используют эти цифры при подсчёте энергетической ценности продуктов питания. Система Этуотера по сей день лежит в основе маркировки продуктов. И в этом смысле, как верно подметил кто-то из журналистов, Уилбур Этуотер — самый цитируемый учёный в мире.
1. Удельная теплоёмкость
Теория:
Для того чтобы нагреть на определённую величину тела, взятые при одинаковой температуре, изготовленные из различных веществ, но имеющие одинаковую массу, требуется разное количество теплоты.
Пример:
Для нагревания 1 кг воды на 1°С требуется количество теплоты, равное 4200 Дж. А если нагревать 1 кг цинка на 1 °С, то потребуется всего 400 Дж.
Физическая величина, численно равная количеству теплоты, которое необходимо передать веществу массой 1 кг для того, чтобы его температура изменилась на 1 °С, называется удельной теплоёмкостью вещества.
Обрати внимание!
Удельная теплоёмкость обозначается буквой с и измеряется в Дж/(кг·°С).
Пример:
Удельная теплоёмкость серебра равна 250 Дж/(кг·°С). Это означает, что для нагревания серебра массой 1 кг на 1 °С необходимо количество теплоты, равное 250 Дж.
При охлаждении серебра массой 1 кг на 1 °С выделится количество теплоты, равное 250 Дж.
Это означает, что если меняется температура серебра массой 1 кг на 1 °С, то оно или поглощает, или выделяет количество теплоты, равное 250 Дж.
Таблица 1. Удельная теплоёмкость некоторых веществ.
Твёрдые вещества
| Вещество | c, Дж/(кг·°С) |
| Алюминий | 920 |
| Бетон | 880 |
| Дерево | 2700 |
| Железо, сталь | 460 |
| Золото | 130 |
| Кирпич | 750 |
| Латунь | 380 |
| Лёд | 2100 |
| Медь | 380 |
| Нафталин | 1300 |
| Олово | 250 |
| Парафин | 3200 |
| Песок | 970 |
| Платина | 130 |
| Свинец | 120 |
| Серебро | 250 |
| Стекло | 840 |
| Цемент | 800 |
| Цинк | 400 |
| Чугун | 550 |
| Сера | 710 |
Жидкости
| Вещество | c, Дж/(кг·°C) |
| Вода | 4200 |
| Глицерин | 2400 |
| Железо | 830 |
| Керосин | 2140 |
| Масло подсолнечное | 1700 |
| Масло трансформаторное | 2000 |
| Ртуть | 120 |
| Спирт этиловый | 2400 |
| Эфир серный | 2300 |
Газы (при постоянном давлении и температуре 20 °С)
| Вещество | c, Дж/(кг·°C) |
| Азот | 1000 |
| Аммиак | 2100 |
| Водород | 14300 |
| Водяной пар | 2200 |
| Воздух | 1000 |
| Гелий | 5200 |
| Кислород | 920 |
| Углекислый газ | 830 |
Удельная теплоемкость реальных газов, в отличие от идеальных газов, зависит от давления и температуры. И если зависимостью удельной теплоемкости реальных газов от давления в практических задачах можно пренебречь, то зависимость удельной теплоемкости газов от температуры необходимо учитывать, поскольку она очень существенна.
Обрати внимание!
Удельная теплоёмкость вещества, находящегося в различных агрегатных состояниях, различна.
Пример:
Вода в жидком состоянии имеет удельную теплоёмкость, равную 4200 Дж/(кг·°С), в твёрдом состоянии (лёд) — 2100 Дж/(кг·°С), в газообразном состоянии (водяной пар) — 2200 Дж/(кг·°С).
Вода — вещество особенное, обладающее самой высокой среди жидкостей удельной теплоёмкостью. Но самое интересное, что теплоёмкость воды снижается при температуре от 0 °С до 37 °С и снова растёт при дальнейшем нагревании.
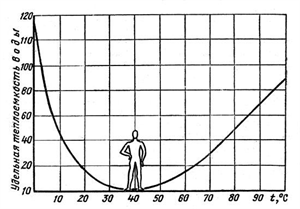
В связи с этим вода в морях и океанах, нагреваясь летом, поглощает из окружающей среды огромное количество теплоты. А зимой вода остывает и отдаёт в окружающую среду большое количество теплоты. Поэтому в районах, расположенных вблизи водоёмов, летом не бывает очень жарко, а зимой очень холодно.
Из-за высокой удельной теплоёмкости воду широко используют в технике и быту. Например, в отопительных системах домов, при охлаждении деталей во время их обработки на станках, в медицине (в грелках) и др.
Именно благодаря высокой удельной теплоёмкости вода является одним из лучших средств для борьбы с огнём. Соприкасаясь с пламенем, она моментально превращается в пар, отнимая большое количество теплоты у горящего предмета
Помимо непосредственного отвода тепла, вода гасит пламя ещё и косвенным образом. Водяной пар, образующийся при контакте с огнём, окутывает горящее тело, предотвращая поступление кислорода, без которого горение невозможно.
Какой водой эффективнее тушить огонь: горячей или холодной? Горячая вода тушит огонь быстрее, чем холодная. Дело в том, что нагретая вода скорее превратится в пар, а значит, и отсечёт поступление воздуха к горящему объекту.
2. Расчёт количества теплоты, необходимого для нагревания тела
Теория:
На практике часто приходится проводить различные тепловые расчёты. Например, при строительстве зданий необходимо учитывать, какое количество теплоты должна отдавать зданию вся система отопления, и какое количество теплоты будет уходить в окружающее пространство через окна, стены, двери.
Выведем формулу для расчёта количества теплоты, необходимого для нагревания некоторого вещества массой m на разность температур Δt=tконечная−tначальная.
Чтобы нагреть некоторое вещество массой 1 кг на 1°C, необходимо затратить количество теплоты, равное удельной теплоёмкости с данного вещества, то есть в данном случае:
Q=c.
Если масса нагреваемого вещества в m раз больше, то и необходимое количество теплоты также в m раз больше:
Q=cm.
Аналогично, если разность температур вещества не 1°C, а в Δt=tконечная−tначальная раз больше, то и теплоты понадобится в Δt=tконечная−tначальная раз больше.
Количество теплоты, получаемое веществом при нагревании, прямо пропорционально удельной теплоёмкости вещества, его массе и разности температур, то есть:
Q=cmΔt
или
Q=cm(tкон−tнач).
Обрати внимание!
Данная формула даёт возможность найти и выделяемую при охлаждении вещества теплоту.
Чтобы рассчитать количество теплоты, необходимое для нагревания вещества (или выделяемое им при охлаждении), следует удельную теплоёмкость вещества умножить на его массу и на разность между конечной и начальной температурой вещества.
Так как конечная температура остывающего вещества меньше его начальной температуры:
tконнач,
то изменение температуры оказывается отрицательным числом:
tкон−tнач
Значит, и выделяемое веществом количество теплоты выражается отрицательным числом:
Qотданное
Последний факт обозначает не рост, а убыль внутренней энергии вещества.











































