СТРОЕНИЕ АТОМА.
Данный конспект учащиеся списывают или распечатывают дома, оставляя пустое место для примеров, схем строения атома, электронных и графических формул, которые записываются на уроке.
1. Модель атома по Томсону (1903 год): атом - шар с положительными зарядами и отрицательными электронами (е).
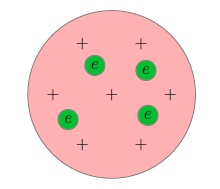
2. Модель атома Бора, 1913 год (планетарная модель) : атом = ядро + электроны.
Ядро — положительно заряженная часть атома, состоящая из протонов и нейтронов.
Электрон - отрицательно заряженные частицы е-.
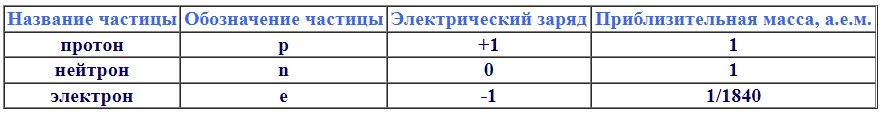
3. Заряд ядра равен порядковому номеру химического элемента.
4. Заряд ядра атома = Порядковому номеру (N) = Числу протонов = Число электронов.
ПРОПУСТИТЬ 8 КЛЕТОЧЕК
5. Число нейтронов = Атомная масса (Ar) – Порядковый номер (N)
Задача №1. Определите состав атома бора?
Бор
N (порядковый номер) – 5
Ar(B) = 11
e-= Порядковому номеру (N) = 5
p+= Порядковому номеру (N) = 5
n0= Атомная масса (Ar) – Порядковый номер (N) = 11 – 5 = 6
6. Изотопы — разновидности атомов какого-либо химического элемента, которые имеют одинаковый атомный номер, но при этом разные массовые числа.
Например, изотопы природного водорода:
Протий: +11 H (e-= 1; p+= 1; n0 = 1-1 = 0)
Дейтерий: +12Н (e-= 1; p+= 1; n0 = 2-1 = 1)
Тритий: +13Н (e-= 1; p+= 1; n0 = 3-1 = 2)
Изотопы одного и того же химического элемента имеют разную массу, так как в их атомных ядрах содержится разное количество нейтронов.
7. Химический элемент – это вид атомов с одинаковым зарядом ядра.
Современная формулировка периодического закона.
8. Электроны вращается вокруг ядра атома по энергетическим уровням (электронным слоям).
Число энергетических уровней определяют по номеру периода, в котором находится химический элемент.
ПРОПУСТИТЬ 8 КЛЕТОЧЕК
9. 
10. Для элементов главных подгрупп (А) число электронов на внешнем уровне = номеру группы.
+15P – V группа (А) – на внешнем уровне 5 электронов
Для элементов побочных подгрупп (В) число электронов на внешнем уровне = двум.
Исключения (один электрон) – хром, медь, серебро, золото и некоторые другие.
ПРОПУСТИТЬ 8 КЛЕТОЧЕК
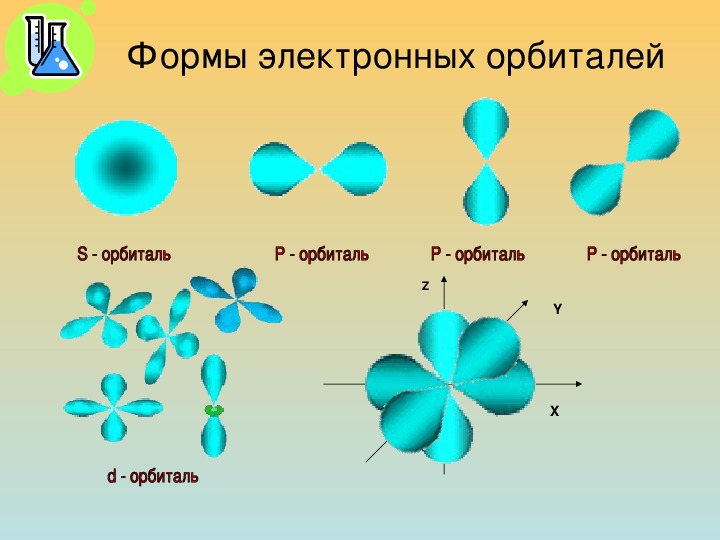
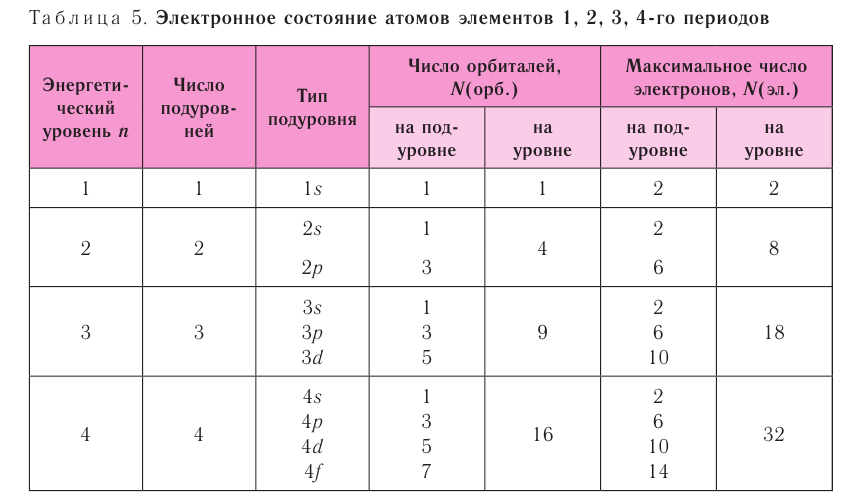
11. Энергетический уровень представляет собой совокупность энергетических подуровней (s, р, d, f). Число подуровней, из которых состоит данный энергетический уровень, равно его номеру.
12. Электронное облако – это модель, которая описывает состояние (движение) электрона в атоме.
13. Часть атомного пространства, в котором вероятность нахождения электрона наибольшая (~90%), называется орбиталь. На одной орбитали может находиться не более двух электронов, имеющих противоположные (антипараллельные) спины.
s-подуровень состоит из одной s-орбитали,
р-подуровень состоит из трех р-орбиталей,
d-подуровень состоит из пяти d-орбиталей;
f-подуровень - из семи f-орбиталей.
ПРОПУСТИТЬ 8 КЛЕТОЧЕК
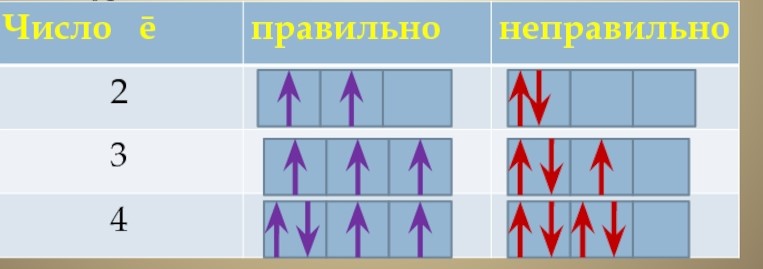
14. Условное обозначение электрона – стрелка, направленная вверх ↑ или ↓
На одной орбитали могут находиться только ДВА электрона с противоположными спинами: ↑↓.