Открытый урок по теме : Алюминий
Подготовила учитель химии Ахмедова З.С.
Тип урока: изучение нового материала
Цели урока:
Обучающие:
познакомить учащихся с историей открытия алюминия, изучить физические свойства и применении алюминия;
познакомить учащихся со строением и химическими свойствами алюминия и его соединений.
Развивающие:
развивать умения обобщать, сравнивать, делать выводы о наличии взаимосвязей между составом и свойствами веществ;
развивать мотивацию изучения предмета при обращении к жизненному опыту школьников;
развивать речь, творческие и интеллектуальные способности учащихся, самостоятельность.
Воспитательные:
развивать познавательный интерес к предмету;
воспитать у учащихся наблюдательность, внимание, пытливость, инициативу и культуру эксперимента.
Оборудование и реактивы: алюминиевая проволока, алюминиевая фольга, алюминиевая посуда; пробирки, растворы: хлорида алюминия, гидроксида натрия, гидроксида аммония, соляной кислоты; таблица периодической системы химических элементов Д. И. Менделеева, компьютер, проектор, интерактивная доска
Структура урока:
1. Организационный момент
2. Введение в новую тему
3. Изучение нового:
Алюминий как химический элемент
- Положение в ПС;
- Строение атома;
- Нахождение в природе
Алюминий как простое вещество
- История открытия и получения алюминия
- Физические свойства алюминия;
- Химические свойства алюминия;
- Получение алюминия
- Применение алюминия и его соединений;
- Биологическая роль алюминия.
4. Закрепление полученных знаний
5. Домашнее задание
6.. Рефлексия
Ход урока.
1.Организационный момент.
2. Введение в новую тему
Сегодня нам предстоит познакомиться с металлом хорошо знакомым вам.
Отгадайте загадки и урока узнайте тему
Удельный вес его так мал,
Что стал крылатым тот металл.
Во все детали входит он,
Являясь важной составной.
Ответ: Алюминий
Какой металл назван металлом будущего?
Ответ: Алюминий
Шпаты, глины, мусковит, какой металл объединит?
Ответ: Алюминий
Я крылатый элемент,
В небеса лечу на керосине,
Провожу тепло и ток,
Нахожусь в природе в глине.
Ответ: Алюминий
Тема урока: Алюминий.
3.Изучение нового.
I. Характеристика химического элемента
Вставьте пропущенные слова
1. Алюминий - элемент … периода, … группы, … подгруппы.
2. Заряд ядра атома алюминия равен +.
3. В ядре атома алюминия … протонов, … нейтронов.
4. В атоме алюминия … электронов.
5. Электронное строение алюминия …
6. На внешнем уровне в атоме … электронов.
7. Степень окисления атома алюминия равна … .
8. Простое вещество алюминия является ….
9. Формула оксида алюминия …, его характер ….
10. Формула гидроксида алюминия …, его характер ….
«История открытие алюминия» Документально зафиксированное открытие алюминия произошло в 1825. Впервые этот металл получил датский физик Ганс Христиан Эрстед, когда выделил его при действии амальгамы калия на безводный хлорид алюминия (полученный при пропускании хлора через раскаленную смесь оксида алюминия с углем). Отогнав ртуть, Эрстед получил алюминий, правда, загрязненный примесями. В 1827 немецкий химик Фридрих Вёлер получил алюминий в виде порошка восстановлением гексафторалюмината калием. Современный способ получения алюминия был открыт в 1886 молодым американским исследователем Чарльзом Мартином Холлом. (С 1855 до 1890 было получено лишь 200 тонн алюминия, а за следующее десятилетие по методу Холла во всем мире получили уже 28000т. этого металла) Алюминий чистотой свыше 99,99% впервые был получен электролизом в 1920г. В 1925 г. в работе Эдвардса опубликованы некоторые сведения о физических и механических свойствах такого алюминия. В 1938г. Тэйлор, Уиллей, Смит и Эдвардс опубликовали статью, в которой приведены некоторые свойства алюминия чистотой 99,996%, полученного во Франции также электролизом. Первое издание монографии о свойствах алюминия вышло в свет в 1967г. Еще недавно считалось, что алюминий как весьма активный металл не может встречаться в природе в свободном состоянии, однако в 1978г. в породах Сибирской платформы был обнаружен самородный алюминий - в виде нитевидных кристаллов длиной всего 0,5 мм (при толщине нитей несколько микрометров). В лунном грунте, доставленном на Землю из районов морей Кризисов и Изобилия, также удалось обнаружить самородный алюминий.
План характеристики физических свойств алюминия:
Агрегатное состояние.
Физические свойства: блестящий металл серебристого цвета, легкий, , t пл = 660°C , высоко пластичный, характеризуется высокой электро- и теплопроводностью.
Химические свойства алюминия:
Взаимодействие алюминия с простыми веществами
С кислородом.
4АI +3 O2 → 2AI2 O3 Эту реакцию мы наблюдаем при горении бенгальских огней и фейерверков.
С галогенами
2АI +3 Вr2 → 2AI Вr3
3.С серой
2АI +3 S→ AI2 S3
С азотом
2АI + N2 → 2AIN
С углеродом
4АI +3 C → AI4 C
Взаимодействие алюминия со сложными веществами рассмотрим экспериментально, пользуясь инструкцией.
Правила работы с кислотами и щелочами: Соблюдай осторожность при работе с кислотами и щелочами! В случае попадания на кожу – промой водой! При нагревании, прогрей сначала всю пробирку.
Опыт 1. В пробирку положите 2 кусочка алюминия и прилейте 3–4 мл раствора соляной кислоты. Пробирку слегка нагрейте.
Опыт 2. В пробирку положите 2 кусочка алюминия и прилейте 3–4 мл раствора гидроксида натрия. Пробирку слегка прогрейте.
Записываем уравнения реакций:
2Al +6 HCl → 2AICI3 + 3H2
2Аl + 6KOH + 2H2O → 2K[Al(OH)4 ] + 3H2
Реакция алюминия с соляной кислотой – само ускоряющаяся. Сначала растворяется оксидная плёнка, а затем в реакцию вступает металл, в растворе накапливается хлорид алюминия, играющий каталитическую роль. Поэтому после обнаружения водорода, без промедления алюминиевую проволочку переносят в пробирку с раствором щёлочи!
Какой вывод можно сделать из работы?
ВЫВОД:
Алюминий реагирует с HCl, проявляя при этом … … … химические свойства. Но алюминий реагирует и с KOH, проявляя … … …химические свойства. Следовательно, алюминий проявляет … … …химические свойства.
4. Закрепление полученных знаний:
1. Номер группы, в которой расположен алюминий
1) I 2) II 3) III 4) VII
2. Заряд ядра атома алюминия
1) 11 2) +11 3) 13 4) +13
3. Электронная формула алюминия
1)1s2 2s22p6 3s23p1 2) 1s2 2s22p6 3s23p2 3) 1s2 2s22p6 3s23p3 4) 1s2 2s22p6 3s23p4
4. Число валентных электронов в атоме алюминия
1) 1 2 ) 2 3) 3 4) 4
5. Сумма протонов, нейтронов и электронов в атоме 27Al равна
1) 13 2) 14 3) 27 4) 40
6. Способ промышленного получения алюминия
1) алюмотермия 2) электролиз 3) пиролиз 4) гидролиз
7. Температура плавления алюминия
1) 120 0С 2) 360 0С 3) 660 0С 4) 1200 0С
8. При нагревании гидроксида алюминия образуются
1)Al2O3 и H2O 2)Al и H2O 3)Al и H2 4) Al2O3 и H2
9. Степень окисления алюминия в его хлориде
1) +1 2) +2 3) +3 4) -3
10. Распределению электронов по энергетическим уровням атома алюминия соответствует ряд чисел
1) 3,8,2 2) 2,3,8 3) 8,2,3,3 4) 2,8,3
11. С какими из перечисленных веществ реагирует алюминий: сера (1), магний (2), оксид хрома (III) (3); соляная кислота (4); раствор гидроксида натрия (5); раствор сульфата меди (II) (6)
1) 1,2,3,4,5 2) 1,3,5,6 3) 1,2,4,6 4) 1,3,4,5,6
12. Оксид и гидроксид алюминия обладает
1) основными свойствами 3) амфотерными свойствами
2) кислотными свойствами 4) несолеобразующий оксид и гидроксид
13. Веществами Х и Y в схеме химической реакции Al2S3 + H2O → X + Y являются
1) Al(HS)3 и H2S 2) Al(OH)3 и H2S 3) Al(OH)S и H2S 4) Al2O3 и Al(HS)3
14. Гидроксид алюминия проявляет амфотерные свойства при взаимодействии с
1) NaOH и Cs2SO4 3) HCl и NaOH
2) KOH и Na2O 4) HCl и CaCl2
15. Установите вещество X
Al → X → Al2(SO4)3
1) Na2SO4 2) SO3 3) Al2O3 4) H2SO4
5.Домашнее задание : п.16 стр.107-111, индивидуальные задания:
- Советы при выполнении индивидуального выбора задания.
1. Внимательно прочти все задания.
2. Соотнеси своё желание в получении хорошей отметки с собственными возможностями правильного выполнения задания.
3. Выбирай и решай!
Задания
Часть А. на “3”
Al + Br2 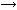
Al + H2SO4 (p-p) 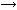
Часть В. на “4”
Al 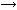 Al2 O3
Al2 O3 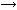 Al Cl3
Al Cl3
Al 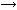 AlCl3
AlCl3 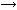 Al2 (SO4)3
Al2 (SO4)3
Часть С. на “5”
Что является веществом Х в реакциях:
Al + X 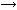 Al (OH)3
Al (OH)3
Al + X 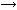 Al2 O3
Al2 O3
. Какая масса алюминия необходима для получения 78 г хрома из оксида хрома (III) алюмотермическим способом
6. Рефлексия



















